Плоскоклеточная карцинома in situ является новообразованием, происходящим из эпидермальных кератиноцитов. Заболевание впервые было описано дерматологом Джоном Бовеном в 1912 году у двух пациентов как «хроническая эпителиальная пролиферация при предопухолевом поражении кожи». В 1920 году французский дерматолог Жан Дарье предложил назвать данную патологию «дискератоз лентикулярный и дискоидный», однако термин «болезнь Бовена» продолжал применяться при характеризации плоскоклеточного рака in situ. Данное новообразование медленно развивается и в ряде случаев достигает нескольких сантиметров в поперечных размерах. Считается, что заболевание может в любой момент прогрессировать в инвазивный плоскоклеточный рак кожи. По литературным данным, порядка 3–9% случаев трансформируются в плоскоклеточный рак кожи. Обычно пациенты отмечают у себя наличие длительно существующей бляшки, без субъективных ощущений, розовато-красного цвета с шелушением [1].
Представление о механизмах развития болезни Бовена дополнено недавними исследованиями, реализуемыми на основе полноэкзомного секвенирования. В частности, определено, что в очагах поражений определяется свыше 700 соматических мутаций, при этом число мутаций может широко варьировать. Более половины мутаций имеют признаки индуцированных воздействием ультрафиолетового излучения, что является специфичным не только для этой патологии [2]. Из числа драйверных мутаций определяются многочисленные изменения в гене – опухолевом супрессоре ТР53, кроме того, к числу драйверных мутаций относятся также мутации в генах ARID2 и RB1. ARID2 является ДНК-связывающимся белком, регулятором клеточного цикла и модификации структуры хроматина, а также компонентом хроматинремоделирующего комплекса «SWI/SNF». Известно, что белковые субъединицы SWI и SNF принимают активное участие в регуляции метаболических процессов. Например, установлено, что нокдаун ARID2 в клетках печени стимулирует развитие стеатоза [3]. В отношении причастности мутаций гена ARID2 к канцерогенезу ранее было показано, что мутации в данном гене определяются в клетках рака легкого, меланомы кожи [4]. Ген RB1 кодирует белок, являющийся негативным регулятором клеточного цикла, который вызывает репрессию транскрипционных программ генов, необходимых для репликации ДНК. Мутационная инактивация RB1 вызывает прогрессию клеточного цикла, переход клетки в фазу S и далее. Помимо этого, показано участие RB1 в репарации ДНК и эпигенетическом перепрограммировании [5]. В целом, полноэкзомное исследование показало, что в области поражения кожи при болезни Бовена определяются низкая мутационная нагрузка, достаточно невысокий уровень мутаций, ассоциированных с воздействием ультрафиолетового излучения, отсутствие мутаций в гене NOTCH, что специфично для плоскоклеточного рака кожи. Разнонаправленность мутаций не позволила определить превалирующие механизмы развития, ключевые этиологические факторы новообразования. Известно, что к последним относят ультрафиолетовое излучение, вирус папилломы человека, контакт с мышьяком, воздействие ионизирующей радиации, генетическую предрасположенность. Таким образом, полноэкзомное исследование в большей степени подчеркнуло полиэтиологический характер развития заболевания.
Вместе с тем, болезнь Бовена рассматривается как наиболее распространенное опухолевое заболевание кожи, индуцированное воздействием соединений мышьяка. Известно, что мышьяк обладает способностью вызывать повреждение ДНК, активированное окислительным стрессом. В свою очередь, подобные процессы способствуют повышению уровня р53 и аресту клеточного цикла. В норме в таком случае развивается дальнейшая гибель клеток (в частности, кератиноцитов) посредством апоптоза. Однако было обнаружено, что повышение уровня циклина D1 при болезни Бовена повышает вероятность уклонения кератиноцитов с поврежденной ДНК от апоптоза, что, собственно, и может приводить к развитию данного заболевания. Однако установлено, что мышьяк не является полноценным канцерогеном, в связи с чем требуется наличие дополнительного фактора, обеспечивающего формирование заболевания [6].
Полиморфизм ряда генов, опосредующих интенсивность развития окислительного стресса, в частности каталазы, также вносит вклад в развитие изменений, индуцированных мышьяком, и может быть отнесен к таким дополнительным факторам [7].
При болезни Бовена отмечаются изменения в уровнях экспрессии матриксных металлопротеиназ, что свойственно инвазивным новообразованиям [8, 9]. Однако в патологических очагах при болезни Бовена не зарегистрировано изменений уровня экспрессии трансформирующего фактора роста бета, повышение которого часто также ассоциировано с канцерогенезом [10].
Протеомное исследование образцов кожи, полученных из очагов поражения у пациентов с болезнью Бовена, определило порядка 500 белков, дифференциально экспрессирующихся в коже больных по сравнению с кожей здоровых людей и кожей больных плоскоклеточным раком кожи, полученной из участков новообразований. Дифференциально экспрессирующиеся белки являлись компонентами сигнальных каскадов, связанных с воспалением, иммунной функцией, фокальной адгезией, взаимодействием с внеклеточным матриксом. Отмечалось изменение уровней экспрессии белков внеклеточного матрикса – тенасцина-С, альфа-1 цепи коллагена 3-го типа, про-альфа-1 цепи коллагена 1-го типа, белка, обладающего ингибиторными эффектами на протеиназы, – серпина В1, а также белка фасцина, функционирующего в качестве актин-связывающего белка и тем самым участвующего в перестройках цитоскелета клеток при направленной миграции. В целом, протеомный анализ при болезни Бовена показал активацию процессов, связанных не только с воспалением и иммунным ответом, но и с характером межклеточных контактов, фагоцитозом, клеточной адгезией (что указывает на наличие изменений белкового профиля, специфичного для процесса трансформации клеток), перестройкой процессов формирования контактов с внеклеточным матриксом, формированием ответа со стороны иммунной системы [11]. Безусловно, неоднократные исследования показали связь болезни Бовена с вирусом папилломы человека 16, 18, 31, 33, 58 типов, который, как предполагается, также связан со злокачественной трансформацией кератиноцитов [12].
Болезнь Бовена манифестирует в виде единичной эритематозной бляшки с четко отграниченными краями. Выделяют и пигментную форму болезни Бовена, которая чаще отмечается у лиц с темным цветом кожи. Для лиц с темной кожей, относящихся к пятому и шестому фототипам по шкале Фитцпатрика, немеланомные поражения кожи являются более характерными, и в таких случаях при наличии у пациента подобного рода бляшки думать о плоскоклеточном раке кожи, базальноклеточном раке, а также болезни Бовена нужно в первую очередь.
Описаны случаи поражения болезнью Бовена и ногтевых пластинок [13]. Локализация клинических проявлений этой патологии в области ногтевых пластинок может в значительной степени затруднять постановку правильного диагноза. Наилучшим решением в таком случае является проведение гистологического исследования. При гистологическом исследовании в эпидермисе обычно определяются акантоз, утолщение эпидермальных выростов, атипия кератиноцитов. Кератиноциты могут быть многоядерными, ядра – гиперхромными. Также могут наблюдаться признаки дискератоза, наличия крупных клеток с гомогенной эозинофильной цитоплазмой и ядром с признаками пикноза, многочисленные фигуры митоза. При этом сохраняется четкая эпидермально-дермальная граница, визуализируется базальная мембрана.
Дифференциальный диагноз болезни Бовена проводится с собственно плоскоклеточным раком, базалиомой, псориазом, солнечным лентиго, экземой кожи.
При экземе кожи специфичными являются полиморфизм сыпи, наличие феномена «серозных колодцев», в меньшей степени – выраженная инфильтрация кожи в области поражения, отмечается положительный эффект от применения наружной терапии глюкокортикостероидами, у пациентов имеются жалобы на кожный зуд, кроме того, отмечается тенденция к множественности высыпаний. Высыпания при экземе часто располагаются симметрично на участках тела. Для псориаза характерны наличие заболевания в анамнезе, в том числе у родственников, присутствие феномена «псориатической триады» в области поражения, а единичные бляшки на туловище обычно отмечаются в области наружной поверхности коленных и локтевых суставов, возможно поражение ногтевых пластинок, а также кожи волосистой части головы. В области псориатических высыпаний также возможен кожный зуд. Дифференциальная диагностика болезни Бовена с плоскоклеточным раком кожи проводится на основе гистологического исследования. При плоскоклеточном раке кожи определяются массивы опухолевых клеток с признаками атипии, различных по форме и размерам, обычно увеличенные в размерах, с признаками патологических митозов, кроме того, патогномоничным является формирование феномена «роговых жемчужин», представляющих собой округлые скопления дискератотических паракератотических клеток, окруженных внеклеточными депозитами роговых масс. Клинически при плоскоклеточном раке кожи также может определяться одиночная, реже множественная бляшка розовато-красного цвета, покрытая чешуйками, корками и даже бородавчатыми разрастаниями. Элемент прогрессирует, в том числе вглубь, плотно инфильтрируя нижележащие структуры кожи. Как и при плоскоклеточном раке, дифференциальная диагностика с поверхностной формой базалиомы тоже проводится при помощи патогистологической картины, при этом специфичными проявлениями базалиомы будут являться дольчатые образования, не связанные с эпидермисом, состоящие из темных палисадообразно расположенных базалиомоподобных и светлых клеток, окруженных гиалиновыми мембранами.
Солнечное лентиго, в отличие от пигментной формы болезни Бовена, чаще всего представляет собой пятно коричневого цвета не более 1–2 см в диаметре, расположенное на открытых участках тела, без зуда. При указанной патологии не имеется признаков инфильтрации, нет выраженных чешуек и корок, солнечное лентиго обычно редко представляет единичное образование.
Локализация болезни Бовена в области ногтевых пластинок требует дифференциальной диагностики заболевания с вульгарными бородавками, онихомикозом, ониходистрофией, экземой, пиогенной гранулемой, псориазом, красным плоским лишаем, беспигментной формой меланомы кожи, кератоакантомой. Заподозрить болезнь Бовена требуется, в первую очередь, при длительно существующем поражении, а также низкой эффективности стандартных методов терапии, применяемых для лечения заболеваний, перечисленных выше.
В последнее время особое значение приобретает дерматоскопическая диагностика. Наиболее специфичными дерматоскопическими признаками болезни Бовена являются гломерулярные сосуды и чешуйчатая поверхность поражения. При пигментной форме болезни определяются коричневые точки, расположенные линейно. Стоит отметить, что дифференциальная диагностика болезни Бовена с помощью дерматоскопии является неоднозначной и недостаточной для постановки диагноза, и, как отмечалось выше, лишь гистологическое исследование имеет определяющее значение.
Цель исследования – описать клинический случай болезни Бовена экстрагенитальной формы у пациента мужского пола.
Клинический случай
Представляем клинический случай экстрагенитальной формы болезни Бовена у пациента мужского пола, 54 лет, обратившегося в клинику Центральной научно-исследовательской лаборатории ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России. Выполнен анализ жалоб пациента, собран анамнез, включая семейный, осуществлен клинический осмотр кожных покровов.
Пациент обратился к врачу-дерматовенерологу с жалобами на наличие единичной бляшки на пояснице. Бляшка существует на протяжении нескольких лет, без каких-либо субъективных ощущений, зудом, болезненностью не сопровождается. Постепенно увеличивается в размерах. Ранее обращался к врачу-дерматовенерологу, поставленный диагноз не знает. Применял наружно топические глюкокортикостероиды в течение 2–3 недель, эффекта не отмечал. Ранее заболевания кожи, онкологические заболевания отрицает. Страдает гипертонической болезнью. У родственников кожные заболевания отрицает.
Кожные покровы больного обычной окраски и влажности. Признаки фотоповреждения кожи отсутствуют – на открытых участках тела не определяются пятна гиперпигментации, телеангиэктазий и атрофии кожи при осмотре также не выявлено. Эластичность кожи не изменена. Фототип кожи пациента по шкале фототипов Фитцпатрика относится к третьему типу.
В поясничной области определяется розовато-красного цвета бляшка неправильной формы, с неровными краями, размером до 7 см в диаметре, с очагами гиперкератоза, покрытая белыми чешуйками и имеющая единичные серозные корки (рисунок). В области новообразования отчетливо определяется инфильтрация. Признаков атрофии нет.
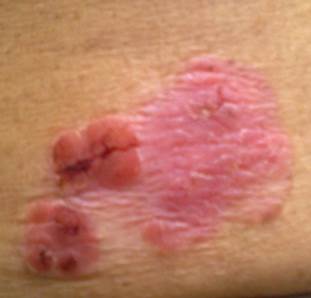
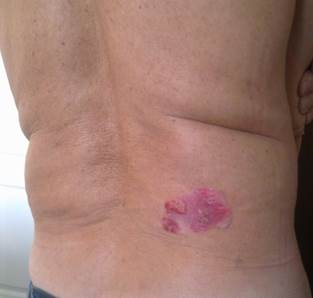
Эритематозная одиночная бляшка с четко очерченными краями и выраженной пролиферацией, наличием на поверхности шелушения
С учетом отсутствия эффекта от проводимой терапии, а также роста новообразования пациенту было рекомендовано выполнить гистологическое исследование.
Результаты гистологического исследования: в представленных препаратах срезы фрагмента кожи, эпителий многослойный плоский ороговевающий с признаками акантоза, дискератоза, наличием атипичных клеток с большими гиперхромными ядрами, крупных округлых клеток с гомогенной эозинофильной цитоплазмой и пикнотичным ядром. Граница между эпидермисом и дермой четкая, в дерме определяется лимфогистиоцитарный инфильтрат, в фолликулярном эпителии также встречаются атипичные вышеописанные клетки. Заключение врача-патологоанатома: «При соответствующей клинической картине гистологические изменения могут соответствовать болезни Бовена».
Больной направлен в региональный онкологический диспансер для проведения лечения. В литературе описаны способы успешной терапии заболевания, включающие применение фотодинамической терапии, 4-фторурацила, имиквимода, а также хирургическое иссечение поражения кожи [14].
Выводы
Данный клинический случай свидетельствует о необходимости тщательного сбора анамнеза, клинического осмотра и последующего динамического наблюдения пациентов с единичными элементами на коже по типу бляшек, плохо поддающимися терапии топическими глюкокортикоидами, существующими на коже с постепенной прогрессией и без признаков периодического разрешения.
Молекулярные изменения в клетках кожи при болезни Бовена, определяемые на транскриптомном уровне, соотносятся с данными протеомного профиля и свидетельствуют о наличии ряда черт, свойственных канцерогенезу, что подтверждает возможность прогрессирования болезни Бовена в любой момент в злокачественную опухоль, поэтому выявленное данное новообразование должно быть расценено как предраковое состояние.
С целью профилактики развития болезни Бовена следует обращать внимание на состояние кожи лиц, находящихся в контакте с химическими канцерогенами. Безусловно, как и в отношении других злокачественных заболеваний кожи, рекомендуется применение солнцезащитных средств, особенно при характере работы, связанной с длительным пребыванием на открытом воздухе, при наличии фактора инсоляции.
Библиографическая ссылка
Палкина Н.В., Окладникова Е.В., Мерк В.М., Плохих А.В. БОЛЕЗНЬ БОВЕНА КАК ПРИМЕР ПРИМЕНЕНИЯ ТЕХНОЛОГИЙ СЕКВЕНИРОВАНИЯ ЭКЗОМА И АНАЛИЗА ПРОТЕОМА ДЛЯ ХАРАКТЕРИСТИКИ ЗЛОКАЧЕСТВЕННОЙ ТРАНСФОРМАЦИИ КЕРАТИНОЦИТОВ // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32706 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32706



