Осложненное течение послеоперационного периода при выполнении реконструктивных хирургических вмешательств (ХргВм) больным раком молочных желез, перенесшим мастэктомию, в ряде случаев оказывается сопряженным с формированием обширных дефектов покровных тканей груди, сочетающихся с явлениями хирургической инфекции. Аналогичные изменения происходят и в случаях формирования у пациенток инфицированных ран под воздействием других этиологических факторов. Применение раневых покрытий – базисный компонент устранения дефектов покровных тканей, обусловленных разными причинами [1; 2]. В настоящее время специалистами уже разработаны и продолжают модифицироваться не только универсальные покрытия, используемые в зонах раневых дефектов с целью сокращения сроков их эпителизации, но и рассматриваются варианты комбинированного применения препаратов для повышения эффективности оказания медицинской помощи больным [2].
В ряде клинических ситуаций изолированное топическое применение сугубо антибактериальных средств оказывается недостаточным [3]. В этом плане обнадеживающим направлением в поиске путей улучшения результатов устранения дефектов покровных тканей может считаться сочетанное применение раневых покрытий, содержащих ионы серебра и мазей, в состав которых входят антибактериальные препараты широкого спектра противомикробной активности [4].
Цель исследования: оценить возможности сочетанного применения современных ранозаживляющих лекарственных препаратов в случаях дефектов покровных тканей груди.
Материал и методы исследования. В 2020–2022 гг. в Санкт-Петербургской клинической больнице Российской академии наук (СПб КлБ РАН) проведено проспективное исследование, соответствующее требованиям к проведению подобных работ и направленное на оценку результатов применения сочетания лекарственных препаратов для топического воздействия, содержащих антибиотик широкого спектра действия, относящийся к группе фторхинолонов (офлоксацин), и раневого покрытия с серебром, одобренное локальным этическим комитетом.
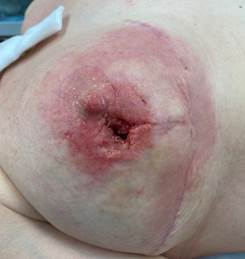
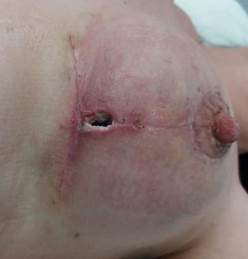
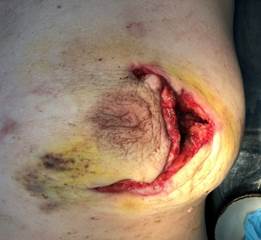
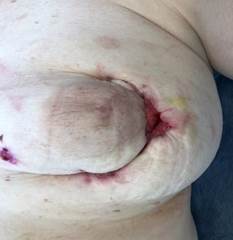
При проведении исследования проанализированы данные о 60 пациентках, у которых после хирургической обработки гнойного очага сформировались дефекты мягких тканей грудной клетки разной площади. Случайным образом среди пациенток сформированы группа исследования (ГрИ) и группа сравнения (ГрС) численностью по 30 человек. Возраст больных, данные о которых оценены при проведении исследования, варьировал от 45 до 60 лет, в среднем составил 53,5 и 52,5 лет в ГрИ и ГрС соответственно (СО – 6,7). В состав групп в том числе включены пациентки, у которых проведение плановых реконструктивных ХргВм на молочных железах в послеоперационном периоде оказалось сопряжено с компликациями (рис. 1).
|
|
|
Рис. 1. Вид раневых дефектов молочных желез пациенток, сведения о которых анализировались при проведении исследования
Хирургическую санацию очага инфекции с некрэтомией осуществляли под местной инфильтрационной анестезией 0,5% раствором лидокаина. В день ХргВм рана туго тампонировалась марлевой турундой, смоченной 0,05% водным раствором хлоргексидина. На вторые сутки после санации очага хирургической инфекции и некрэктомии больным из ГрИ после обработки раны применяли комбинированную повязку, в состав которой входили противомикробные вещества местного действия: мазь с офлоксацином – Офломелид (ОАО «Синтез», Россия) и раневое покрытие с серебром – Atrauman Ag (Paul Hartman, Германия). Методика формирования повязки представлена на рисунке 2.
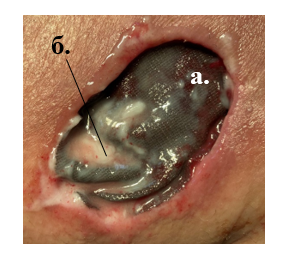
Рис. 2. Вид раны пациентки из ГрИ. Раневой дефект укрыт покрытием, содержащим ионы серебра (а), нанесена мазь с офлоксацином (б)
Для лечения пациенток из ГрС применяли мазь «Левомеколь» (АО «Нижфарм», Россия). В дальнейшем до эпителизации ран смена повязок осуществлялась через день.
Площадь ран оценивали посредством расчета площади эллипса. Для этого использовали по формулу: S=π×R×r, где R – длина большой полуоси (см), r – длина малой полуоси (см). Измерение площади раневых дефектов осуществляли через 1, 2, 3 и 4 недели от начала хирургического лечения. Статистический анализ полученных данных осуществлен посредством компьютерной программы Statistica 12 (TIBCO, США). Для сравнения двух групп данных применен критерий Мана – Уитни. Отличия считали статистически значимыми при р ˂ 0,05.
Результаты исследования и их обсуждение. Проанализированы сведения о результатах лечения 60 пациенток (ГрИ и ГрС, по 30 клинических наблюдений соответственно) СПб КлБ РАН в 2020–2022 гг. по поводу раневых дефектов грудной клетки.
На первоначальных сроках наблюдения отличия в группах исследования и контроля в отношении площади раневых дефектов отсутствовали, что позволяет считать группы сопоставимыми, р=0,381 (табл.).
Показатели площади раневых дефектов груди в группах исследования с учетом сроков наблюдения
|
Сроки наблюдения, недели |
Параметры площади дефектов, см2 в группах |
p* |
|
|
исследования, n=30 |
сравнения, n=30 |
||
|
0 |
7,5 |
7,6 |
0,381 |
|
1 |
4,8 |
5,6 |
0,015 |
|
2 |
2,6 |
3,8 |
0,003 |
|
3 |
1 |
1,8 |
0,01 |
|
4 |
0,1 |
1,1 |
0,008 |
* Критерий Манна – Уитни, отличия статистически значимы при p˂0,05.
С течением времени, по мере очищения и завершения явлений воспалительного процесса, площадь ран уменьшалась (рис. 3).
|
|
|
|
а) |
б) |
Рис. 3. Вид раневых дефектов в области молочных желез на 2-е сутки (а) и через 2 недели (б) от начала хирургического лечения
За 4 недели от начала лечения медиана площади раневых дефектов в ГрИ сократилась с 7,5 см2 до 0,1 см2, что интерпретировано как устранение раны с ее заживлением вторичным натяжением. В то же время в ГрС медиана площади ран сократилась на 78%, что в количественном отношении выражалось как 7,6 см2 на этапе начала лечения и 1,1 см2 на завершающем этапе.
При сравнении показателей уменьшения медиан площади раневых дефектов в ГрИ и ГрС констатированы статистически значимые отличия в этих параметрах, рассчитанных через 1, 2, 3 и 4 недели наблюдения, что в числовом выражении составило 0,8; 1,2; 0,8 и 1,0 см2 соответственно.
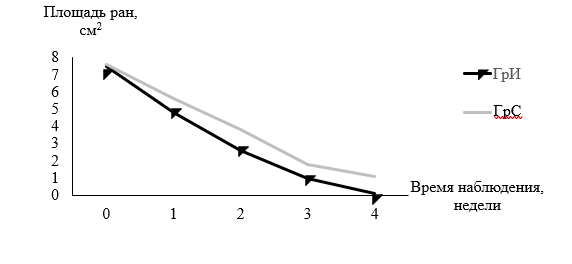
Рис. 4. Распределение площади раневых дефектов у пациенток ГрИ и ГрС с учетом времени наблюдения
Оказание медицинской помощи больным с дефектами покровных тканей – длительный и сложный процесс. Ключевым патофизиологическим процессом, характеризующим хронические раневые дефекты, считается чрезмерное воспаление, способствующее продолжению разрушения тканей в области раны. В хронических ранах выявляется большое количество клеток Лангерганса, нейтрофилов, провоспалительных макрофагов, а также протеаз, определяющих степень тяжести клинических проявлений язвы [5]. Длительному заживлению дефектов кожи способствует не только повышенная инфильтрация раны специфическими субпопуляциями клеток иммунной системы, но и нарушение их функций [6]. Например, нейтрофилы чрезмерно подвержены нетозу (формированию нейтрофильных внеклеточных ловушек), в связи с чем оказывают цитотоксическое действие, препятствуя физиологической эпителизации ран [7]. В эксперименте у лабораторных животных с сахарным диабетом (СД) нейтрофилы оказываются более устойчивыми к апоптозу и менее эффективно удаляются макрофагами, что способствует увеличению их популяции в хронических ранах. Макрофаги больных СД также характеризуются нарушениями эффероцитоза апоптотических клеток, фагоцитоза бактерий, а также обладают пониженной способностью к переходу в противовоспалительное состояние [8]. Даже в неповрежденной коже больных СД содержится больше тучных клеток и провоспалительных макрофагов, чем у здоровых людей.
В комплексе эти особенности иммунных клеток, выявляемые в хронических ранах, не только препятствуют смене фазы воспаления на пролиферацию, но и значительно снижают резистентность тканей в области раневого дефекта к инфекции. Пролонгация фазы воспаления также может обусловливаться персистирующей раневой инфекцией, поддерживая рану в непрерывном цикле инфекции, воспаления, являясь причиной отсутствия эпителизации.
В последние годы в качестве основной причины формирования хронических ран рассматривается персистирование инфекции в области дефекта кожного покрова. В хронических ранах часто выявляются St. aureus и P. aeruginosa [9]. Эти бактерии нередко формируют полимикробные биопленки, резистентные ко многим антибактериальным препаратам и реакциям иммунной системы пациента [10]. Критическая колонизация раны происходит в результате неадекватной функции иммунных клеток больных, гипоперфузии и персистирующей открытой раны.
Несомненно, что оказание медицинской помощи пациентам с дефектами покровных тканей должно предусматривать успешную борьбу с инфекцией посредством адекватной санации раны на фоне применения современных раневых покрытий с учетом стадии раневого процесса. Поэтому разработка и внедрение в повседневную практику использования современных раневых покрытий – неотъемлемая часть совершенствования технологий оказания медицинской помощи больным с длительнонезаживающими дефектами покровных тканей [11; 12]. В настоящее время проводятся многочисленные исследования по экспериментальному обоснованию эффективности применения раневых покрытий, способствующих скорейшей эпителизации дефектов тканей, обеспечивающих формирование влажной среды в ране и удаление излишков экссудата с поддержанием в раневой среде оптимальной температуры [1; 13].
Вариантов раневых покрытий множество. Все они имеют достоинства и недостатки. Однако считается, что так называемая идеальная повязка оказывается биосовместимой, полупроницаемой для воды и кислорода, не препятствует процессам обновления тканей, обладает гипоаллергенными свойствами, не вызывая дополнительной травмы раневой поверхности при перевязке [2].
При лечении ран в течение длительного времени используется серебро, остающееся распространенным компонентом перевязочных средств и раневых покрытий и в настоящее время. Достижения в использовании серебра для заживления ран были сосредоточены на обеспечении его длительного высвобождения в достаточно высоких концентрациях, чтобы сохранить эффективность. С учетом этого разработаны повязки с нанокристаллическим серебром. Также существуют многочисленные лекарственные формы для его местного применения, в том числе комбинированные, содержащие антибактериальные препараты. Ряд авторов приводит данные об эффективности сочетанного топического применения частиц серебра и антибактериальных препаратов широкого спектра действия, что способствовало скорейшему очищению раны и ее эпителизации [14].
В целом перспективы топического сочетанного применения повязок, содержащих ионы серебра и антибактериальные препараты широкого спектра действия, существуют.
Заключение. В ходе проведенного исследования, основываясь на оценке изменения медиан площади дефектов покровных тканей груди, можно полагать, что сочетанное применение мази, в состав которой входит антибактериальный препарат широкого спектра действия, и серебросодержащего раневого покрытия оказывает позитивное влияние на ускорение темпов эпителизации раневых дефектов, в том числе при осложненном течении послеоперационного периода у пациенток, перенесших реконструктивные ХргВм на МолЖ. Результаты клинико-экспериментального изыскания могут быть масштабно использованы в плане реализации усилий, направленных на ускорение заживления раневых дефектов в случаях оказания МедП пациенткам с инфицированными ранами груди разной этиологии, в частности при осложнениях реконструктивных операций у больных, подвергшихся мастэктомии по поводу рака молочных желез.
Библиографическая ссылка
Романенков Н.С., Мовчан К.Н., Некрасов А.А., Яковенко О.И., Гедгафов Р.М., Кремлев Д.И. РЕЗУЛЬТАТЫ ИЗУЧЕНИЯ ЭФФЕКТИВНОСТИ СОЧЕТАННОГО ПРИМЕНЕНИЯ СОВРЕМЕННЫХ РАНОЗАЖИВЛЯЮЩИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В СЛУЧАЯХ ДЕФЕКТОВ ПОКРОВНЫХ ТКАНЕЙ ГРУДИ // Современные проблемы науки и образования. 2023. № 3. ;URL: https://science-education.ru/ru/article/view?id=32687 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32687