Адаптивный клеточный иммунитет играет основную роль в предотвращении роста и развития злокачественной опухоли. Особое место в противоопухолевом иммунитете занимают цитотоксические Т-лимфоциты (CD3+CD8+). Проявление различных эффекторных свойств (синтез цитокинов, перфоринов, гранзимов) зависит от зрелости и дифференцировки цитотоксических Т-клеток. Значение в определении зрелости и дифференцировки играют поверхностные антигены, которые также определяют свойства клетки [1]. Выделяют следующие субпопуляции цитотоксических Т-клеток: наивные (Naïve, CD8+CD45RA+CD62L+), центральной памяти (CM, CD8+CD45RA-CD62L+), эффекторной памяти (EM, CD8+CD45RA-CD62L-) и терминально-дифференцированные клетки памяти (TEMRA, CD8+CD45RA+CD62L-) [2]. Наивные Т-клетки (CD8+Naïve) на своей поверхности имеют такие маркеры, как CD45RA (форма трансмембранного белка, обладающего тирозин-фосфатазной активностью) и CD62L (L-селектин, отвечает за миграцию клеток сквозь венулы), а также CD197 (CCR7, рецептор для хемокинов, отвечающий за миграцию клеток в Т-зависимые зоны). Благодаря этим поверхностным маркерам CD8+Naïve активно проникают в лимфатические узлы, где происходит их антиген-зависимая дифференцировка. Также «наивные» Т-лимфоциты постоянно экспрессируют ко-стимулирующие молекулы CD27 и CD28, что способствует активации Т-клеток [3]. В ходе антиген-зависимой дифференцировки и нескольких циклов клеточного деления происходит снижение уровня некоторых поверхностных маркеров, что влечет за собой переход в стадию CM, затем - в EM, а после - в TEMRA. Основные особенности CD8+EM заключаются в экспрессии огромного количества адгезивных молекул и различных хемокинов, что способствует проникновению в различные ткани. Также низкая способность к пролиферации компенсируется высоким уровнем продукции эффекторных цитокинов. Субпопуляция CD8+CM, напротив, после прохождения антиген-зависимой дифференцировки способна длительно мигрировать по организму от одного лимфатического узла к другому, при необходимости быстро активироваться и развивать антиген-специфичный иммунный ответ. Кроме того, CM эффективно продуцируют IL-2. Особое место занимает популяция CD8+ TEMRA, которая рассматривается как финальная стадия созревания Т-клеток. Ключевой особенностью является выделение гранзимов и перфоринов, которые уничтожают чужеродную клетку (злокачественная опухоль). Также на поверхности CD8+TEMRA отсутствуют CD27 и CD28, что свидетельствует об отсутствии необходимости стимуляции, активация происходит под влиянием IL-6, IL-8, IL-12, IL-18. Однако эти клетки имеют низкую способность к пролиферации [4]. В дополнение существует поверхностный маркер – CD57 (углеводный эпитоп HNK1), наличие этого дифференцировочного антигена позволяет характеризовать эффекторные свойства клетки. Клетки, имеющие CD57 на поверхности, имеют способность выделять перфорин и играют ключевую роль в «киллинге» злокачественных клеток. Однако этот маркер также свидетельствует о «зрелости» клетки и достижении ею конечной стадии развития [5].
Цитотоксические Т-лимфоциты нацелены на злокачественные клетки и их уничтожение. Роль различных субпопуляций цитотоксических Т-лимфоцитов в противоопухолевом иммунном ответе была описана ранее у пациентов с раком желудка, лейкозом, раком лёгкого [6-8]. Результаты этих исследований демонстрируют истощение различных популяций цитотоксических Т-лимфоцитов в опухолевой ткани и периферической крови, нарушение функций этих клеток, которое проявлялось в снижении уровня выделяемых гранзимов и перфоринов. В настоящее время ведется исследование роли различных субпопуляций цитотоксических Т-лимфоцитов в периферической крови и опухолевой ткани при колоректальном раке, а также их баланс при прогрессировании заболевания [9; 10].
Целью нашей работы стала оценка количественного состава основных субпопуляций цитотоксических Т-лимфоцитов в крови у больных с новообразованиями толстого кишечника.
Материалы и методы исследования. В рамках исследования 94 пациента были разделены на три группы: 44 пациента с колоректальным раком, средний возраст пациентов в группе составлял 68,6 (65,2; 73,1) года. Двадцать пять больных с доброкачественным новообразованием толстой кишки, средний возраст - 59,4 (57,4; 62,4) года. В контрольную группу были включены 25 пациентов, поступивших для планового или экстренного оперативного вмешательства (пластика колостомы, сформированной ранее по поводу травмы толстой кишки, экстренное оперативное пособие по поводу травмы толстой кишки, плановое оперативное вмешательство по поводу врождённой аномалии развития толстого кишечника). Средний возраст пациентов в контрольной группе составил 47,2 (44,8; 52,4) года. Все пациенты с колоректальным раком были обследованы в соответствии с клиническими рекомендациями, утвержденными Минздравом России. В каждом случае получено информированное добровольное согласие пациента, исследование выполнено согласно требованиям комиссии по этике ФГБОУ ВО «Читинская государственная медицинская академия» Минздрава России, а также в соответствии с требованиями декларации Всемирной медицинской ассоциации (2013). Критерии включения больных в исследование: согласие на участие в исследовании, наличие опухоли толстого кишечника. Критерии исключения: больные с положительным ВИЧ-статусом, аутоиммунными заболеваниями, вирусными и бактериальными инфекциями, а также с опухолевым поражением иной локализации; больные, предварительно получавшие химио- и лучевую терапию. При гистологическом исследовании микропрепаратов пациентов с КРР в 39 случаях (88,6%) ткань опухоли была представлена умереннодифференцированной аденокарциномой (G2). В 3 случаях (6,8%) – высокодифференцированной аденокарциномой (G1). В 2 случаях (4,6%) – низкодифференцированной аденокарциномой (G3). В основной группе у 8 пациентов диагностирована I стадия процесса, у 22 – II стадия, у 7 – III стадия и у 7 – IV стадия рака. При гистологическом исследовании микропрепаратов у больных с доброкачественной опухолью толстой кишки в 15 случаях ткань опухоли была представлена тубуловорсинчатой аденомой и в 10 случаях гиперпластическим полипом.
Объектом исследования служила венозная кровь, полученная путем пункции периферической вены за 30 минут до оперативного пособия. Для выявления основных субпопуляций Т-лимфоцитов применяли панель антител DuraClone IM T-Cell (CD45RA-FITC, CD197-PE, CD28-ECD, CD279-PC5.5, CD27-PC7, CD4-APC, CD8-Alexa-Fluor 700, CD3-APC-Alexa-Fluor 750, CD57-Pacific Blue, CD45-Krome Orange, Beckman Coulter, India). Количественный состав субпопуляций цитотоксических Т-лимфоцитов определяли с помощью метода проточной цитофлуориметрии на анализаторе CytoFlex LX (Beckman Coulter,США). Для иммунофенотипирования 100 мкл цельной крови добавляли в пробирку с моноклональными антителами, перемешивали и инкубировали в течение 15 минут. Удаление эритроцитов из образцов проводили с использованием лизирующего раствора VersaLyse (Beckman Coulter, США) в течение 10 минут.
При проведении статистического анализа руководствовались принципами Международного комитета редакторов медицинских журналов (ICMJE) и рекомендациями «Статистический анализ и методы в публикуемой литературе» (SAMPL). Номинальные данные описывали с указанием абсолютных и относительных значений. Сравнение номинальных данных исследования проводили при помощи критерия χ2 Пирсона, позволяющего оценить значимость различий между фактическим количеством исходов или качественных характеристик выборки, попадающих в каждую категорию, и теоретическим количеством, которое можно ожидать в изучаемых группах при справедливости нулевой гипотезы. При минимальном значении ожидаемого явления менее 10,0 использовали χ2 Йейтса на непрерывность. Нормальность распределения количественных признаков при численности исследуемых групп менее 50 человек оценивали с помощью критерия Шапиро-Уилка. Учитывая распределение признаков, отличное от нормального во всех исследуемых группах, полученные данные представляли в виде медианы первого и третьего квартилей: Me [Q1; Q3]. Ранговый анализ вариаций по Краскелу-Уоллису (H) выполняли для сравнения трех независимых групп по одному количественному признаку. Затем, при наличии статистически значимых различий, проводили попарное сравнение с помощью критерия Манна-Уитни с учетом поправки Бонферрони (U). Учитывая дихотомичность целевой переменной, диагностическая модель была построена путем бинарной логистической регрессии. Статистическую обработку результатов исследования осуществляли с помощью пакета программ IBM SPSS Statistics Version 25.0 (International Business Machines Corporation, США).
Результаты исследований и их обсуждение. Установлено, что количество T-клеток (CD3+) в крови у больных с колоректальным раком снижается в 1,46 раза по сравнению с группой контроля (p<0,001) и в 1,40 раза – по отношению к пациентам с доброкачественной опухолью толстой кишки (p<0,002) (табл. 1). При сравнении показателей контрольной группы и больных с доброкачественной опухолью статистически значимых различий выявлено не было (U=293,5, p=0,71).
Также установлено, что у пациентов с КРР происходит снижение количества цитотоксических Т-лимфоцитов и их основных субпопуляций по сравнению с контролем: количество Tc-клеток (CD3+ CD8+) снижается в 1,85 раза (p<0,001), CD8+Naïve клеток - в 2,41 раза (p<0,001), CD8+EM лимфоцитов - в 2,01 раза (p<0,001), CD8+CM - в 1,70 раза (p=0,001), CD8+TEMRA лимфоцитов - в 1,52 раза (p=0,003), CD8+CD58+ клеток - в 1,82 раза (p<0,001) (табл. 1).
Кроме того, отмечается уменьшение количества субпопуляций цитотоксических Т-лимфоцитов у больных с колоректальным раком по сравнению с больными доброкачественной опухолью: CD3+CD8+ лимфоцитов - в 1,72 раза (p=0,003), CD8+Naive клеток - в 1,86 раза (p<0,001), CD8+EM - в 2,27 раза (p<0,001), CD8+CM - в 1,71 раза (p=0,006), CD8+CD57+ лимфоцитов - в 1,54 раза (p<0,001) (табл. 1). В отношении CD8+TEMRA статистически значимых данных не выявлено (U=373,0, p=0,027). При сравнении количественного состава исследуемых субпопуляций цитотоксических Т-лимфоцитов в крови у больных доброкачественной опухолью с группой контроля - статистически значимых различий выявлено не было (p>0,05). Для наглядной оценки полученные данные отражены на рисунке.
Основные субпопуляции цитотоксических Т-лимфоцитов в крови у больных с новообразованиями толстой кишки
|
Субпопуляции Т-лимфоцитов (клетки/μL крови) |
Группы исследуемых пациентов |
Тестовая статистика, df=2 |
||
|
Контрольная группа, n=25 |
Доброкачест-венная опухоль, n=25 |
Колоректальный рак, n=44 |
||
|
CD3+
|
1846,0 [1760,0;2039,1] |
1771,0 [1648,4;1985,0] |
1262,0 [1254,6; 1670,7] |
H=18,21 p<0,001 |
|
CD3+ CD8+ (Cytotoxic T-cell) |
837,0 [737,2; 843,0] |
778,0 [666,9; 838,0] |
451,5 [450,0; 611,0] |
H=19,95 р<0,001 |
|
CD8+CD45RA+CD62L+ (Naïve) |
70,0 [59,8; 76,7] |
54,0 [54,0; 72,2] |
29,0 [29,0; 47,0] |
H=18,65 p<0,001 |
|
CD8+CD45RA-CD62L+ (CM) |
101,0 [87,6; 105,5] |
101,0 [81,9; 106,1] |
59,5 [55,7; 70,6] |
H=13,97 p<0,001 |
|
CD8+CD45RA-CD62L- (EM) |
402,0 [378,0; 470,0] |
455,0 [391,2; 487,9] |
200,0 [200,0; 230,5] |
H=18,21 p<0,001 |
|
CD8+CD45RA+CD62L- (TEMRA) |
212,0 [198,1; 244,1] |
214,0 [182,8; 234,8] |
139,5 [136,6; 177,1] |
H=10,31 p=0,006 |
|
CD8+CD57+ |
153,0 [131,9; 156,8] |
129,0 [127,5; 159,2] |
84,0 [81,8; 106,6] |
H=21,80 p<0,001 |
Примечания: Н – критерий Краскела-Уоллиса, p – уровень значимости различий.
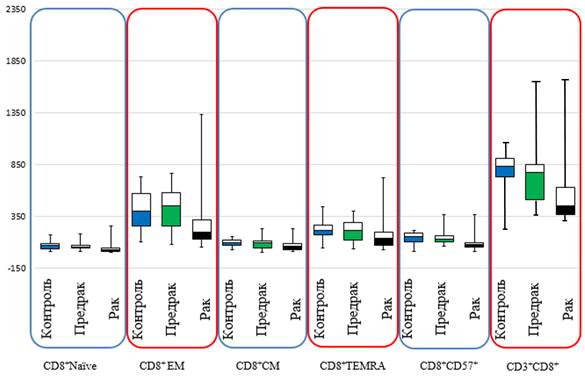
Основные субпопуляции цитотоксических Т-лимфоцитов в крови у больных с новообразованиями толстой кишки
У больных со злокачественными новообразованиями наблюдается нарушение адаптивного иммунного ответа, что выражается в снижении количества Т-клеток, уменьшении выработки цитокинов и хемокинов [11; 12].
Нами установлено, что у пациентов с колоректальным раком отмечается снижение количества общей популяции Т-клеток, а также цитотоксических Т-лимфоцитов (CD3+CD8+). Учитывая ключевую роль CD3+CD8+ клеток в противоопухолевом иммунном ответе, исследовали количественный состав их субпопуляций. Во всех субпопуляциях цитотоксических Т-лимфоцитов отмечено уменьшение общего количества клеток у пациентов с КРР в сравнении с группой контроля, а также пациентами с доброкачественной опухолью толстой кишки. Уменьшение количественного состава всех субпопуляций цитотоксических Т-лимфоцитов у пациентов с колоректальным раком свидетельствует о развитии иммуносупрессии, что способствует росту злокачественного новообразования. Аналогичные данные были получены в исследовании L. Zhang (2022) [13].
Ранее нами был изучен уровень иммунных контрольных точек (ИКТ): TIM-3, LAG-3, CTLA-4 и их лигандов в сыворотке и опухолевой ткани у пациентов с КРР [14; 15]. Данные исследования показали увеличение концентрации ИКТ у больных с колоректальным раком в образцах ткани и сыворотке крови в сравнении с группой контроля. Среди всех исследуемых ИКТ наибольшее увеличение уровня продемонстрировал белок TIM-3. Функция этого белка заключается в снижении иммунного ответа путем истощения CD8+T-лимфоцитов. Мы полагаем, что высокая концентрация TIM-3 способствует уменьшению количества цитотоксических Т-лимфоцитов и их основных субпопуляций, вследствие чего развивается локальная и системная иммуносупрессия. В подтверждение этой гипотезы нами выявлена сильная обратная корреляционная связь между концентрацией TIM-3 и количеством цитотоксических Т-лимфоцитов у больных с колоректальным раком.
Заключение. Результаты наших исследований показывают уменьшение общего количества Т-клеток (CD3+) в периферической крови у пациентов с колоректальным раком. Также отмечается снижение уровня основных субпопуляций цитотоксических Т-лимфоцитов: наивных (Naïve, CD8+CD45RA+CD62L+), центральной памяти (CM, CD8+CD45RA-CD62L+), эффекторной памяти (EM, CD8+CD45RA-CD62L-), терминально-дифференцированных клеток памяти (TEMRA, CD8+CD45RA+CD62L-) и «зрелых» форм Tc-клеток (CD8+CD57+).
Библиографическая ссылка
Четверяков А.В., Терешков П.П., Цепелев В.Л., Крюкова В.В. КОЛИЧЕСТВЕННЫЙ СОСТАВ СУБПОПУЛЯЦИЙ ЦИТОТОКСИЧЕСКИХ Т-ЛИМФОЦИТОВ У ПАЦИЕНТОВ С ОПУХОЛЬЮ ТОЛСТОЙ КИШКИ // Современные проблемы науки и образования. 2023. № 3. ;URL: https://science-education.ru/ru/article/view?id=32682 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32682



