Токсические гепатопатии представляют собой группу заболеваний с формированием морфологических и функциональных нарушений печени [1; 2], в которую входят алкогольная и лекарственная болезни печени, а также токсические поражения печени неалкогольной этиологии. В настоящее время во всем мире отмечено увеличение заболеваемости алкогольной болезнью печени (АБП), которая может проявляться в нескольких клинических вариантах (стадиях): алкогольная жировая дистрофия печени, алкогольный гепатит, алкогольный фиброз и склероз печени, алкогольный цирроз печени, и как конечная фаза этиопатогенетического поражения печени – острая печеночная недостаточность, в том числе осложненная печёночной комой [3]. Прогрессирование АБП сопровождается ростом летальности (без учета острых отравлений этанолом), наблюдаемой как среди населения России, так и других стран [3]. Отмечается рост распространенности декомпенсированного цирроза печени в РФ за 1990-2017 гг. с 129,8 до 238 человек на 100000 населения. Вклад же алкогольного цирроза в структуру смертности от цирроза в мире варьирует в различных странах от 42% до 63% [3; 4].
АБП развивается у 60-100% лиц, злоупотребляющих алкоголем, и у каждого больного, страдающего алкоголизмом. По данным Росстата, официальная общая заболеваемость алкоголизмом в России в 2017 году достигла 1304,6 тысячи человек [3]. Следует отметить, что годовой объём продажи алкоголя, по оценке Федеральной службы по регулированию алкогольного рынка, возрос с 6,03 до 6,34 литра чистого этанола на душу населения за период с 2019 по 2021 год, что эквивалентно этаноловой нагрузке 17,36 мл/сутки на каждого россиянина [5]. По данным Министерства здравоохранения РФ, гепатотоксичным принято считать количество этанола, равное 40-80 граммам чистого этилового спирта в сутки для мужчин[3].
Токсическое действие ацетальдегида (основного метаболита этанола) приводит к развитию некровоспалительной реакции различной степени выраженности и запускает механизм фиброгенеза в ткани печени [6]. По данным литературных источников, существует выраженная дозазависимость между этаноловой нагрузкой и вероятностью развития АБП, хотя режим приема и характера алкогольных напитков может быть различным. Алкогольный стеатоз можно обнаружить у 60% людей, которые потребляют более 60 г чистого этанола в день, а высокий риск развития цирроза наступает у лиц с ежедневным потреблением свыше 120 г этанола [7]. В метаанализе 2010 года были подтверждены тесные взаимосвязи доза-эффект между средним количеством потребляемого этанола и риском цирроза печени, а также выявлен пороговый эффект с повышенным риском смертности от цирроза печени среди мужчин и женщин, употребляющих 12-24 г этанола в день [8]. При оценке корреляции между морфологическими изменениями печени и количеством этанола, потребляемого пациентами на прецирротических стадиях развития АБП, установлено, что частота фиброза была в 2 раза выше в группе пациентов со средней нагрузкой этанолом более 80 г в сутки по сравнению с группой пациентов с суточной нагрузкой этанолом в дозе 40-80 г. Более того, в группе пациентов, потребляющих свыше 80 г этанола в сутки 10 лет, гистологически верифицированный фиброз печени имел большую выраженность (II-III стадии по шкале Metavir), тогда как у пациентов, потреблявших 40-80 г этанола в сутки менее 10 лет, выраженность фиброза ткани печени соответствовала I-II стадиям [9].
Фиброз печени долгое время считался необратимым процессом, возникающим при хроническом повреждении печени в результате замещения участков пораженной паренхимы соединительной тканью, богатой коллагеном. В последние годы получены данные об обратимости процессов фиброза печени при условии своевременного устранения этиологического фактора и проведения патогенетического лечения токсического поражения печени [8; 10]. Лечению токсического гепатита, фиброза печени и цирроза посвящено множество экспериментальных и клинических исследований [11]. Во многих из них дана оценка гепатотропных эффектов S-аденозил-L-метионина (адеметионин, sAMe), который, будучи физиологическим субстратом метионинового цикла, участвует в эндогенном синтезе глутатиона, являющегося основой антиоксидантной защиты гепатоцитов. Схема биологических реакций в организме человека с участием sAMe представлена на рисунке 1[12].
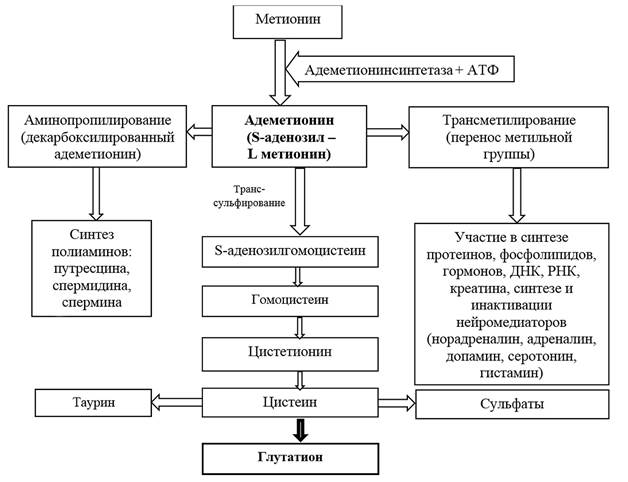
Рис. 1. Синтез глутатиона с участием адеметионина
За счёт выраженного детоксикационного, регенерирующего, антиоксидантного, антифиброзирующего и других эффектов, развивающихся при применении экзогенного sAMe, он нашёл место в терапии различных вариантов токсического поражения печени [13]. При лечении последних внимание исследователей также привлекают препараты дисульфида глутатиона, в частности инозина глицил-цистеинил-глутамат динатрия (ИГ). В ряде работ показаны его гепатопротекторный, противовирусный и иммуномодулирующий эффекты [14;15]. Установленная схема биологических реакций в организме человека с участием ИГ представлена на рисунке 2.
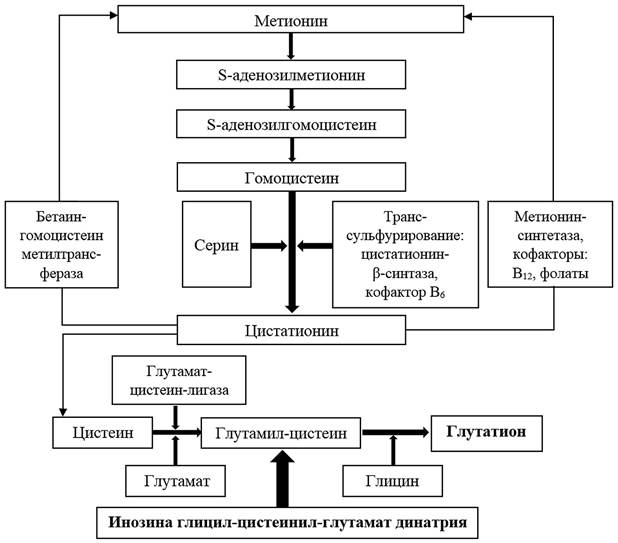
Рис. 2. Синтез глутатиона с участием инозина глицил-цистеинил-глутамата динатрия
Следует отметить, что sAMe и ИГ являются субстратами для синтеза глутатиона, имеют различные точки входа в реакции метионинового цикла и могут обладать различной биологической эффективностью.
Цель исследования – проведение сравнительной оценки эффективности применения инозина глицил-цистеинил-глутамата динатрия и адеметионина при лечении пациентов с регулярным употреблением этанола, имеющих АБП с изменением сонографических показателей жесткости печени, соответствующих наличию фиброза её паренхимы I-III стадии по Metavir.
Материалы и методы исследования
Исследование проводилось на базе ФГБВОУ ВО «Военно-медицинская академия имени С.М.Кирова» МО РФ, одобрено решением локального этического комитета (выписка из протокола № 247 от 22.11.2022 г.) и носило сравнительный характер в параллельных группах.
Для его выполнения были отобраны 90 пациентов мужского пола с АБП, средний возраст 41,5±9,94 [31,56; 51,44] года, у которых по результатам транзиентной эластографии имелись изменения жёсткости печени с пороговыми значениями модуля упругости Юнга в диапазонах F1-F3, что соответствует сонографическим признакам фиброза печени I, II и III стадии соответственно по шкале Metavir. По результатам оценки анкет – опросников CAGE (скрытое или явное пристрастие к алкоголю) и AUDIT (оценка характера употребления алкоголя) [3], упациентов установлен характер потребления этанола, достаточный для развития АБП. Из пациентов, отобранных в исследование, были сформированы девять групп по 10 пациентов в каждой, распределенных по выраженности сонографической жесткости печени (F1-F3) и схемам проводимого лечения (табл. 1).
Таблица 1
Распределение пациентов с АБП на группы по видам терапии
|
Пороговые значения модуля упругости Юнга (Е) при транзиентной эластографии, кПа |
(УДХК) n=30 |
(УДХК+ИГ) n=30 |
(УДХК+sAMe) n=30 |
|
F1 (5,9-7,2) |
Группа 1 n=10 |
Группа 2 n=10 |
Группа 3 n=10 |
|
F2 (7,3-9,5) |
Группа 4 n=10 |
Группа 5 n=10 |
Группа 6 n=10 |
|
F3 (9,6-12,5) |
Группа 7 n=10 |
Группа 8 n=10 |
Группа 9 n=10 |
Всем пациентам была назначена базовая терапия урсодезоксихолевой кислотой (УДХК) в суточной дозе 13 мг/кг, разделенной на 2–3 приема.
В группах пациентов с АБП, имеющих жесткость печени от F1 до F3 (группы 2, 5, 8), на фоне базовой терапии УДХК применяли препарат ИГ в виде раствора, который вводили внутримышечно (в/м) в суточной дозе 120 мг. Курс лечения составил 21 сутки.
Препарат sAMe, на фоне базовой терапии, применяли в группах 3, 6, 9 в суточной дозе 800 мг в/м на протяжении 21 суток. Сравнение и контроль проводили с группами 1, 4, 7 на фоне монотерапии АБП препаратом УДХК.
Всем пациентам выполнялось комплексное обследование в соответствии с клиническими рекомендациями по оказанию медицинской помощи при АБП от 2020 года [3]. В том числе для оценки выраженности цитолитического и холестатического синдромов выполняли биохимическое исследование крови на анализаторах Synchron CX 5 delta и Synchron CX 3 delta (Beckman Coulter, США). Транзиентная эластография печени выполнялась на аппарате Fibroscan 502 (Echosens, Франция). Оценка биохимических показателей крови и эластография печени выполнялись перед началом курса лечения и после его завершения. Статистическую обработку данных исследования проводили при помощи программ Microsoft office Excel 2019 и StatSoft Statistica 10.0.1011. Сравнение средних значений в группах выполняли по U-критерию Манна-Уитни. Различия в группах считали достоверными при p <0,05.
Результаты исследования и их обсуждение
По результатам оценки анкет – опросников «CAGE» и международного стандартизованного теста «AUDIT», у 59% пациентов выявлена высокая вероятность (8-15 баллов) потребления алкоголя, у 41% пациентов выявлены признаки высокого риска (от 16 баллов и более) развития алкогольной зависимости. Данные о суточной дозе употребляемого алкоголя (в пересчете на 100% этанол) и длительности употребления в группах пациентов с показателями жесткости печени в диапазонах F1-F3 представлены в таблице 2.
Таблица 2
Суточные дозы и длительность потребления этанола в группах пациентов с АБП
|
Длительность потребления алкоголя, лет |
Распределение пациентов в группах по диапазонам доз суточного потребления алкоголя в пересчёте на чистый этанол, г |
||||||||
|
Группы 1, 4, 7 (F1), n=30, %(абс.) |
Группы 2, 5, 8 (F2), n=30, %(абс.) |
Группы 3, 6, 9 (F3), n=30, %(абс.) |
|||||||
|
20,0-40,0 |
40,0-80,0 |
80,0-160,0 |
20,0-40,0 |
40,0-80,0 |
80,0-160,0 |
20,0-40,0 |
40,0-80,0 |
80,0-160,0 |
|
|
5-10 |
- |
77(23) |
- |
- |
27(8) |
- |
- |
- |
50(15) |
|
10-20 |
23(7) |
- |
- |
- |
73(22) |
- |
- |
50(15) |
- |
На основании полученных данных установлено, что формирование изменений сонографического показателя жёсткости печени в диапазоне F1 (5,9-7,2 кПа) наблюдалось при регулярном потреблении этанола от 5 до 10 лет в дозе 40,0-80,0 г/сутки (77% пациентов группы) или в дозе 20,0-40,0 г/сутки более 10 лет (23% пациентов группы).
Изменения показателя жёсткости печени в диапазоне значений F2 (7,3-9,5 кПа) были характерны для 27% пациентов, потреблявших этанол в дозе 40,0-80,0 г/сутки в течение 5-10 лет, и для 73% пациентов группы, имевших стаж этаноловой нагрузки 10-20 лет.
Показатели жёсткости печени в диапазоне значений F3 (9,6-12,5 кПа) формировались у 50%пациентов, включенных в группу при потреблении 40,0-80,0 г этанола в сутки в течение 10-20лет, а у остальных 50% пациентов группы фиброз формировался уже через 5-10 лет при потреблении 80,0-160,0 г этанола в сутки.
В общем анализе крови в группе пациентов с показателями жесткости печени в диапазоне (F3) выявлено умеренное повышение лабораторных показателей синдрома воспалительной реакции: лейкоцитоз о 9,3 х 109/л [11,4; 7,2], ускорение скорости оседания эритроцитов до 18,2 мм/ч [21,1; 15,3], повышение уровня С-реактивного белка (СРБ) до 10,6 мг/л [13,0; 8,2]. В группах пациентов с жесткостью печени в диапазонах (F1) и (F2) данные показатели не имели значимых отклонений от референтных значений. Показатели печёночного цитолиза и холестаза в биохимическом анализе крови (уровень активности аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ), гаммаглутаринтранспептидазы (ГГТП) и содержания общего билирубина) соответствовали стеатогепатиту с минимальной активностью во всех группах. Наибольшая их выраженность отмечалась в группах пациентов с показателями жесткости печени в диапазоне (F3). Показатели белкового обмена (общий белок, альбумин, глобулин и коагулограмма) во всех группах были без патологических отклонений.
Эффективность проводимой гепатопротекторной и антифибротической терапии оценивалась через 21 сутки. Динамика показателей цитолитического синдрома у пациентов с АБП на фоне применения УДХК до и после курса терапии ИГ и sAMe представлена на рисунках 3 и 4.
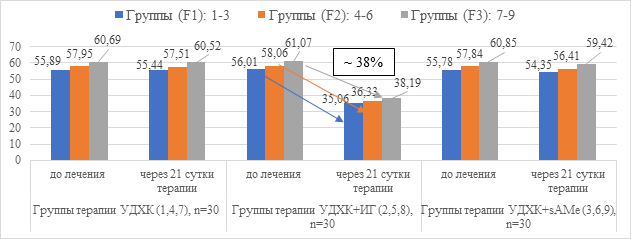
Рис. 3. Динамика показателя активности АСТ в сыворотке крови (Ед/л) в группах пациентов с АБП на фоне лечения
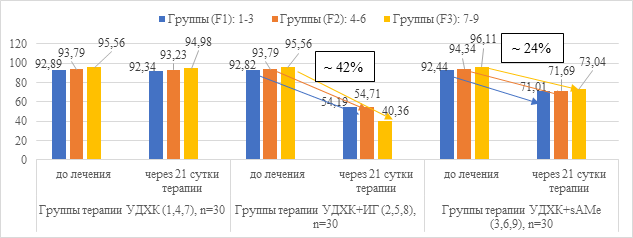
Рис. 4. Динамика показателя активности АЛТ в сыворотке крови (Ед/л) в группах пациентов с АБП на фоне лечения
После проведенного курса лечения АБП препаратами УДХК+ИГ в течение 21 суток, выявлено достоверное снижение биохимических показателей цитолиза (в среднем по группам F1-F3): АСТ на 38%, АЛТ на 42% от исходного уровня, тогда как в группах с применением препаратов УДХК+sAMe снижение АЛТ было на 24% (в 1,7 раза) менее выражено в сравнении с группами, получавшими УДХК+ИГ. Показатель АСТ в группах с применением препаратов УДХК+sAMe значимо не снижался. Динамика показателей холестатического синдрома в группах пациентов с АБП до и после курса терапии ИГ и sAMe на фоне применения УДХК представлена на рисунках 5, 6 и 7.
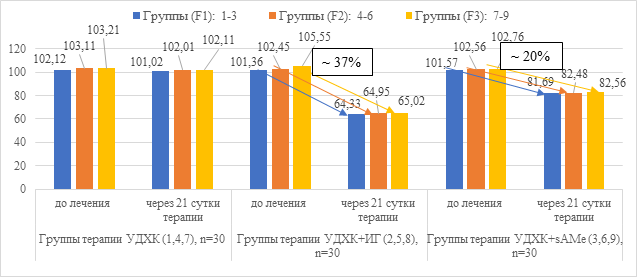
Рис. 5. Динамика показателя активности ЩФ в сыворотке крови (Ед/л) в группах пациентов с АБП на фоне лечения
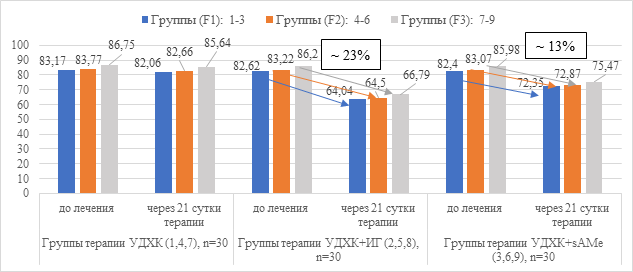
Рис. 6. Динамика показателя активности ГГТП в сыворотке крови (Ед/л) в группах пациентов с АБП на фоне лечения
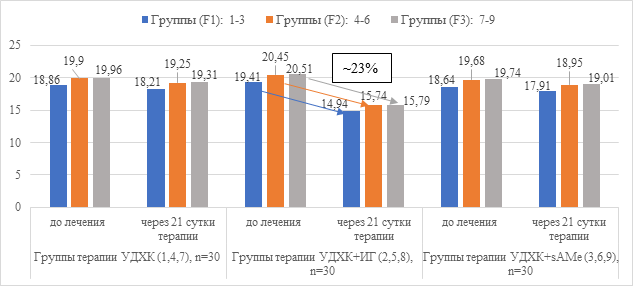
Рис. 7. Динамика показателя содержания общего билирубина в сыворотке крови (мкмоль/л) в группах пациентов с АБП на фоне лечения
После проведенного курса лечения препаратами УДХК+ИГ в течение 21 суток выявлено достоверное снижение показателей холестатического синдрома в сыворотке крови: содержание общего билирубина на 23%, активности ГГТП на 23%, щелочной фосфатазы 37% (в среднем по группам F1-F3) от исходного уровня, тогда как в группах с применением препаратов УДХК+sAMe показатели холестаза снижались от исходного уровня в 1,8 раза менее выраженно: ГГТП на 13% и щелочной фосфатазы на 20%. Средние значения содержания общего билирубина в сыворотки крови значимо не снижались.
В группах 2, 5, 8 на фоне терапии УДХК+ИГ, а также в группах 3, 6, 9 на фоне терапии УДХК+sAMe в течение 21 суток достигнута положительная динамика в виде улучшения общего самочувствия, разрешения лабораторных маркеров цитолитического и холестатического синдромов, нормализации воспалительных изменений в клиническом анализе крови и снижения содержания СРБ до нормальных значений в 100% случаев. В группах 1, 4, 7 с монотерапией УДХК значимой положительной динамики по данным показателям не отмечалось. Также отмечалась положительная клиническая динамика в виде улучшения общего самочувствия, купирования диспепсического синдрома в группах лечения УДХК+ИГ и УДХК+sAMe. Динамика результатов эластографии в группах пациентов с АБП на фоне лечения представлена на рисунке 8.
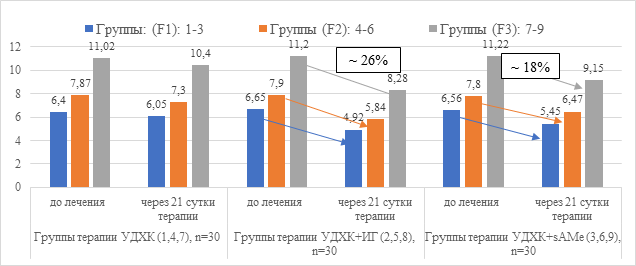
Рис. 8. Динамика показателя жесткости печени (кПа) в группах пациентов с АБП на фоне лечения
После завершения курса лечения в группах пациентов с терапией препаратами УДХК+ИГ выявлено достоверное снижение сонографического показателя жесткости печени на 26% от исходного уровня (в среднем по группам F1-F3), тогда как применение УДХК+sAMe приводило к менее выраженному (в 1,4 раза) снижению показателя жесткости печени только на 18% от исходного уровня. В группах пациентов, получавших препарат УДХК, показатели жесткости печени снижались всего на 6% от исходного уровня.
По результатам проведенного исследования можно сделать заключение, что при применении ИГ и sAMe на фоне приема УДХК в схемах терапии пациентов с АБП в стадии стеатогепатита с минимальной активностью и изменениями сонографических показателей жесткости печени, соответствующих наличию фиброза её паренхимы I-III стадии по Metavir, наблюдались гепатопротекторный и антифибротический эффекты, которые имели большую выраженность в группах лечения с применением ИГ, что, вероятно, обусловлено его более коротким циклом трансформации до восстановленного глутатиона в печени по сравнению с цепочкой метаболических реакций синтеза глутатиона из sAMe.
Заключение
Полученные результаты свидетельствуют о большей эффективности комплексных схем лечения при в/м введении препаратов ИГ и sAMe в суточных дозах 120 мг и 800 мг соответственно, на фоне приема УДХК в суточной дозе 13 мг/кг массы тела, по сравнению с монотерапией УДХК в течение 21 суток в терапии АБП и профилактике прогрессирования фиброза печени.
Библиографическая ссылка
Орлов Ю.В., Синячкин Д.А., Гайдук С.В., Кузьмич В.Г., Матвеев С.Ю. СРАВНИТЕЛЬНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ ИНОЗИНА ГЛИЦИЛ-ЦИСТЕИНИЛ-ГЛУТАМАТА ДИНАТРИЯ И АДЕМЕТИОНИНА В ПРОФИЛАКТИКЕ РАЗВИТИЯ ФИБРОЗА ПРИ АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ // Современные проблемы науки и образования. 2023. № 3. ;URL: https://science-education.ru/ru/article/view?id=32661 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32661



