Рак предстательной железы (РПЖ) – серьезная проблема общественного здравоохранения в мире [1].В 2018 году во всем мире зарегистрировано 1,3 миллиона новых случаев заболевания и 359 000 смертей [2]. РПЖ является вторым по распространенности, одним из самых наследуемых [3] видов рака и пятой по значимости причиной смерти от злокачественных новообразований (ЗНО) у мужчин.Это самый распространенный вид ЗНО у мужчин более чем в половине стран мира (105 из 185) и основная причина смерти от рака в 46 странах.Заболеваемость РПЖ увеличилась у мужчин в возрасте от 15 до 40 лет [4], с приростом до 2% в год с 1990 г. (р<0,01).В США местнораспространенная карцинома простаты у пациентов в возрасте до 50 лет встречается более чем в 6 раз чаще, чем у пробандов старше 50 лет. Общая 5-летняя выживаемость пациентов с РПЖ в возрасте от 40 до 80 лет составила от 95% до 100%, от 15 до 24 лет – 30%, а в диапазонах 20-29 лет и 25-34 года – 50% и 80% соответственно.
При изучении сведений из публикаций научной литературы об особенностях ранней диагностики РПЖ у мужчин молодого возраста (базы данных PubMed, CrossRef и Scopus за 1997-2021 гг.) получены данные о вероятной причинно-следственной связи ряда факторов, потенциально влияющих на развитие данного ЗНО.
Одним из ключевых факторов служит отягощенный наследственный анамнез. Редкие мутации, обусловленные репарацией ДНК, влияют на стадию РПЖ [5], риск выявления при скрининге [6], смертность от рака [7] и ответ на лечение [8; 9]. По данным многоцентрового исследования [10], доказано, что при наличии семейного РПЖ и рака молочной железы (РМЖ) риск развития ЗНО простаты увеличивается в 2-3 раза. Часто встречаются генетические изменения в генах BRCA2, CHEK2, ATM, HOXB13 и BRCA1 в 4,6% случаев при местном и в 11,8-16,2% при метастатическом РПЖ.
В исследовании, организованном с 2014 по 2020 г. группой авторов, во главе с Clements M.B. (2022), приняли участие 20323 мужчины с верифицированным РПЖ [10]. У 22% (n=4524) исследуемых отсутствовала отягощенная наследственность по этому заболеванию, у остальных пациентов подробная семейная информация была выявлена только в 29,2% случаев. При одном родственнике первой линии с РПЖ вероятность развития карциномы высокой степени злокачественности была определена величиной, превышающей нормальный порог в 1,77 раза (95% CI1,57-2,0, p <0,001). Влияние нескольких родственников первой линии родства с РПЖ на шанс развития карциномы было определено как соотношение 1,92 : 1,54. При изучении влияния родственников второй линии на развитие РПЖ положительный анамнез превышал риск развития патологии (95% CI 1,07-1,77; p = 0,011). Наличие родственника первой линии с РМЖ также было связано с развитием рака простаты (95% CI 1,01-1,67, p= 0,040). При поправке на семейный анамнез РПЖ связь между семейным анамнезом двух указанных опухолей оказалась клинически незначимой (95% CI, 0,96-1,60, p=0,093). Статистически значимой взаимосвязи между отягощенной наследственностью и уровнем простат-специфического антигена (ПСА) не установлено [10].
На сегодняшний день в мировой практике не описано общепринятой стратегии скрининга РПЖ. Для определения степени риска развития РПЖ на основе результатов скрининга ПСА, в рандомизированном исследовании PROBASE с 2014 по 2019 г. 46 642 мужчины в возрасте 45 лет распределены на 3 группы по уровню ПСА: низкого (<1,5 нг/мл), среднего (1,5-2,99 нг/мл) и высокого (≥3 нг/мл) риска [11]. При ПСА ≥3 нг/мл рекомендовалось проведение МРТ и биопсии предстательной железы. Половине мужчин (23 341) предложен скрининг ПСА, остальным (23 301) – пальцевое ректальное исследование (ПРИ), с отсроченным скринингом по достижении 50 лет. Из 21301 участника скрининга 1,5% (344) участников попали в группу высокого риска РПЖ. При повторном измерении ПСА высокий риск подтвержден у 186 мужчин (0,8%), из которых 120 (64,5%) выполнили биопсию простаты. В общей сложности выявлено 48 случаев РПЖ (общая распространенность 0,2%). По результатам исследования, анализ крови на ПСА у мужчин в молодом возрасте оказался не эффективен в плане раннего выявления РПЖ.
В мире проводится множество исследований по изучению новых биомаркеров РПЖ.Это не уменьшит потребность в инвазивных методах диагностики, но может быть использовано для ранней и точной диагностики, что упростит выбор подходящего лечения, снизит вероятность побочных эффектов, а также стоимость терапии [12].
Имеются данные отечественных и иностранных публикаций, авторами которых проанализирована информация об изменениях в структуре генов (BRCA1, BRCA2 [13; 14], Ki 67, BCL-2, P53 [15], b-catenin [16], E-cadherin [17], EGFR [18], RB1 [19], PTEN [20]) при РПЖ у мужчин старше 50 лет. Что касается обследования пациентов молодого возраста (40-50 лет) с подозрением на РПЖ, то такой информации в медицинской литературе крайне мало.
Распространенные методы диагностики РПЖ у населения, в т.ч. оценка уровня сывороточного ПСА, не всегда точны, а алгоритм их использования окончательно не сформирован. Целесообразна оптимизация ранней диагностики РПЖ у мужчин 40-50 лет, с учетом факторов риска развития заболевания, на основе учета морфологических особенностей клеточного и геномного состава, репродуктивных особенностей молодого человека. Эти вопросы имеют важное медико-социальное значение в связи с обследованием трудоспособной части населения репродуктивного возраста.
Цель исследования: определить комплекс молекулярно-генетических и гистологических маркеров для ранней диагностики РПЖ у мужчин молодого (до 50 лет) возраста.
Материалы и методы исследования. Изучена гистологическая структура микропрепаратов 10 пациентов в возрасте от 40 до 50 лет с верифицированным РПЖ, после радикального хирургического лечения в одной клинике (ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России) за 2016-2019 гг. Всем пациентам выполнены робот-ассистированные радикальные простатэктомии без осложнений ближайшего послеоперационного периода. Проведен ретроспективный анализ историй болезней пациентов для оценки их соматической патологии: у 20% пациентов выявлено наличие сопутствующих заболеваний (артериальная гипертензия, атеросклероз аорты, атриовентрикулярная блокада 2 ст., кардиостимулятор), остальные пациенты были соматически здоровы. Изучены предоперационные показатели уровня ПСА (3,5-9,86 нг/мл), критерии злокачественности (4 – ISUP-1, 4 – ISUP-2, 2 – ISUP-3), стадии опухоли (3-pT1cN0M0, 4-pT2aN0M0, 3-pT2cN0M0). Выполнено иммуногистохимическое (ИГХ) исследование и молекулярно-генетический анализ послеоперационного материала каждого пациента. Проведен анализ на наличие мутаций методом ИГХ в генах: Ki 67, P53, b-catenin, E-cadherin, BCL-2; и молекулярно-генетический анализ: BRCA1, BRCA2, EGFR, TP53, RB1, PTEN.
Исследование проведено в рамках совместной программы НИР «Возможности раннего выявления рака предстательной железы у мужчин молодого возраста» двух государственных медицинских университетов (ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России и ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России).
Результаты исследования и их обсуждение. Сопоставление параметров у пациентов исследуемой группы, с учетом распределения случаев опухоли по критериям гистологической классификации и международной клинической классификации TNM, приведено на рисунке.
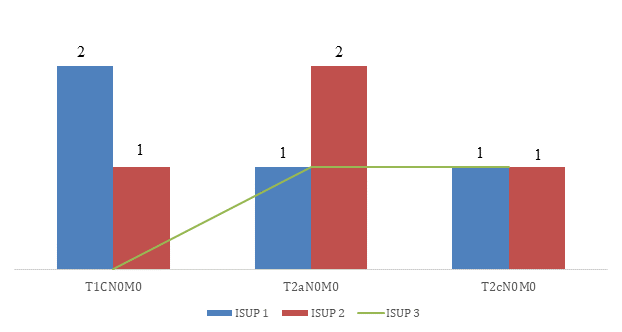
Сопоставление пациентов исследуемой группы по TNM и ISUP
При пересмотре микропрепаратов сторонним морфологом все критерии ISUP подтверждены: опухоль в верхушке железы отсутствовала в 1 препарате (10%), во всех образцах представлены обе доли железы, без периневральной лимфоваскулярной инвазии и поражения уретры. Положительный край хирургической резекции – в 1 случае (0,2 см).
Дополнительно, при проведении ИГХ специалистом-морфологом, установлено: Ki-67 выявлен во всех образцах по степени окрашивания от 1-5% (4 – 1%, 1 – 2%, 1 – 4%, 4 – 5%), b-catenin – 3 балла с 100% мембранным окрашиванием у всех пациентов, e-cadherin – от 1 до максимально 3 баллов с окрашиванием у всех пациентов от 50 до 100% (50% - 1 ISUP-1 T1cN0M0; 70% - 2 ISUP 1 – 1 T2cN0M0, 1 T2аN0M0, 1 ISUP 3 - T2cN0M0; 80% - 1 ISUP 2 – 1 T1cN0M0; 100% - 1 ISUP 1 - T1cN0M0, 3 ISUP 2 – 1 T2cN0M0, 2 T2аN0M0, 1 ISUP 3 – T2aN0M0). Мутации BRCA1, EGFR, TP-53, P-53 и BCL-2 не выявлены. Потери гетерозиготности по BRCA2 верифицированы в 1 случае pT2cN0M0 ISUP-2, по RB-1 – в 1 случае pT2aN0M0 ISUP-3, по PTEN – в образцах 2 пациентов pT2cN0M0 ISUP-1 и ISUP-2. У 20% пациентов с сопутствующей патологией (артериальная гипертензия, атеросклероз аорты, атриовентрикулярная блокада 2 ст., кардиостимулятор) мутации не обнаружены.
В ряде крупных исследований показано негативное прогностическое значение потери гетерозиготности RB1, TP53 и BRCA1/2 [21-23]. Потеря гетерозиготности гена PTEN встречается в 20% случаев в образцах РПЖ после радикальной простатэктомии и в 50% случаев опухолей, резистентных к кастрации [24]. Наличие аберрации PTEN ассоциировано с наличием неблагоприятного прогноза, в частности с увеличением риска биохимического рецидива. Определение статуса этого гена рекомендовано пациентам с локализованным и местнораспространенным РПЖ, для стратификации риска рецидива/прогноза и персонализации тактики наблюдения [25].
Наличие аберрации PTEN в образцах биопсии, имеющих группу градации I (Глисон 6=3+3), ассоциировано с прогрессированием карциномы и изменением паттерна Глисона в опухолевом материале после радикальной простатэктомии, вплоть до градации IV (Глисон 8=4+4; 3+5; 5+3).
Мутации BRCA2 встречаются в 3% случаев РПЖ, а при метастатическом заболевании – в 5% случаев [21]. Наличие мутаций в гене BRCA2 является показанием для применения PARP-ингибитора олапариба у пациентов с метастатическим кастрационно-резистентным РПЖ [26]. Наличие аберрации гена TP53 ассоциировано с наличием неблагоприятного прогноза [21; 23], а потеря гетерозиготности гена RB-1 встречается в ~15% случаев локализованной карциномы [27]. Также значительно чаще данная аберрация наблюдается при кастрационно-резистентном РПЖ и в опухолях с нейроэндокринной дифференцировкой [21], но это отдельная тема для изучения и обсуждения. В ряде исследований показано, что наличие аберрации RB1 ассоциировано с наличием неблагоприятного прогноза [21; 23]. В целом при ИГХ-исследованиях и молекулярно-генетическом анализе целесообразно использовать панель секвенирования, особенно у пациентов моложе 50 лет.
Прогнозирование генетического риска развития карциномы простаты является одной из ключевых задач по снижению смертности от рака предстательной железы посредством раннего выявления и профилактики [28]. Редкие патогенные мутации, особенно в генах, отвечающих за восстановление поврежденных участков ДНК (BRCA2), повышают риск развития РПЖ в 2-8,6 раза и приводят к развитию более агрессивной формы заболевания. Общие генетические варианты могут быть объединены в шкалу генетического риска (GRS). При высоком GRS (20-25% населения) риск развития карциномы простаты в 2-3 раза выше, чем при среднем. При очень высоком GRS (1-5% населения) вариант развития РПЖ возрастает в 6-8 раз. Сложно отделить генетическую предрасположенность от этнической принадлежности, социальных особенностей и состояния здоровья, чтобы понять причину развития онкопатологии.
Учитывая многофакторность развития рака предстательной железы, нельзя не принять во внимание снижение местной иммунной регуляции при воспалительных заболеваниях мочевыводящих путей. В ретроспективном исследовании [29] установлено, что пациенты с раком предстательной железы имели в анамнезе более частые эпизоды воспалений мочевыводящих путей. Коэффициенты риска: пиелонефрит - 2,3 (95% CI = 1,36-3,88), простатит - 2.04 (95% CI = 1,03-4,05), цистит - 4,02 (95% CI = 2,11-7,66).
Данные некоторых исследований [30] свидетельствуют о том, что генетическая предрасположенность к развитию РПЖ не является фактором, определяющим неблагоприятный исход заболевания. Здоровый образ жизни (нормальный вес, регулярная физической активность, отказ от курения и здоровое питание) позволил пациентам с высоким генетическим риском развития карциномы простаты уменьшить количество летальных исходов и развития распространенных форм заболевания. Среди мужчин из группы высокого риска РПЖ соблюдение здорового образа жизни привело к снижению количества летальных исходов (HR, 0.55; 95% CI, 0.36-0.86). При этом соблюдение здорового образа жизни не было связано со снижением общего риска развития этой агрессивной опухоли, что имеет важное значение для моделирования алгоритма ранней диагностики РПЖ.
За последние годы молекулярная характеристика опухоли постепенно интегрировалась в клиническое ведение пациентов с локализованным РПЖ, при котором наблюдается высокая геномная гетерогенность [31]. Последние достижения в персонализации лечения ведут к увеличению потребности в геномном профилировании: анализы экспрессии генов могут повлиять на принятие клинических решений относительно активного наблюдения или адъювантной терапии локализованной и метастатической форм рака простаты. Поэтому расширение и продолжение исследования, описанного в данной работе, чрезвычайно важно для клинической онкологии.
В клинической практике при лечении пациентов с РПЖ необходимо понимать актуальность наследственных (зародышевых) и приобретенных (соматических) мутаций [32], которые у определенных пациентов влияют на риск развития РПЖ и его течение. В поздних стадиях заболевания мутации в гомологичных генах репарации рекомбинации (например, BRCA1, BRCA2, ATM, CHEK2, PALB2) предполагают проведение химиотерапии препаратами платины и испытания ингибиторов фермента поли(АДФ-рибоза)-полимеразы (PARP).В свою очередь, микросателлитная нестабильность и дефицит репарации несоответствия, которые могут возникать при мутациях MLH1, MSH2, MSH6 и PMS2, предполагают потенциальную уязвимость к ингибиторам PD-1. Генетическое тестирование зародышевой линии имеет потенциально важное значение в лечении и оценке наследственного риска развития РПЖ. Направленное на опухоль соматическое секвенирование может помочь в принятии решений об индивидуальной тактике лечения пациента.
Вопросы диагностики и лечения мужчин молодого возраста (моложе 50 лет), больных РПЖ, имеют важное медико-социальное и экономическое значение. Проблемы несвоевременной диагностики у мужчин этой возрастной группы связаны с недостатком алгоритма диагностики РПЖ, основанного на результатах определения уровня ПСА. Более детальный анализ морфологических изменений в тканях простаты, пораженной опухолью, можно будет провести при сравнительной оценке полученных результатов с данными геномного секвенирования в когорте пациентов пожилого возраста (старше 65 лет), наиболее уязвимых для данной опухоли. Изучение совокупности факторов риска развития РПЖ у пациентов молодого, трудоспособного возраста позволит сформулировать диагностический подход, с учетом персональной молекулярно-генетической информации.
Выводы. Молекулярно-генетический анализ и изучение гистологических проб у пациентов с верифицированным РПЖ показал разнородные результаты. Опираясь на результаты пилотного исследования, авторы планируют увеличить выборку пациентов, сопоставить полученные данные молекулярно-генетического анализа и ИГХ с дальнейшей судьбой пациентов в возрасте до 50 лет: с показателями общей и раковоспецифической выживаемости, частотой обращаемости, динамикой ПСА и проч. Предполагается сравнить полученные результаты с данными исследования в группе контроля (пациенты с РПЖ в возрастной категории старше 65 лет).
Библиографическая ссылка
Старцев В.Ю., Кривоносов Д.И., Воробьев С.Л. ВОЗМОЖНОСТИ МОЛЕКУЛЯРНОЙ ДИАГНОСТИКИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ У МУЖЧИН МОЛОДОГО ВОЗРАСТА // Современные проблемы науки и образования. 2023. № 3. ;URL: https://science-education.ru/ru/article/view?id=32628 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32628



