Одну из наиболее социально и экономически значимых проблем современной медицины составляют ожоги в связи с тенденцией к увеличению частоты и тяжести термической травмы, многофакторностью ее патогенеза, сложностью, длительностью лечения и высоким процентом инвалидизации и смертности. Повреждение тканей при тяжелой термической травме приводит к увеличению образования активных форм кислорода (АФК), гипоксии и истощению антиоксидантной защиты, развитию системного воспалительного ответа, эндотелиальной дисфункции, полиорганной недостаточности [1, 2]. Вследствие роста АФК возникает окислительный стресс, а в случае преобладания восстановителей и антиоксидантов или блокировки электрон-транспортной цепи развивается восстановительный стресс. Избыточные восстановители реоксигенируются в митохондриях, что приводит к взрыву генерации АФК [3, 4]. Однако механизм усиления продукции О2− в дыхательной цепи митохондрий при термической травме практически не изучен. При этом оценка активности сукцинатдегидрогеназы (СДГ) наряду с определением каталитических свойств лактатдегидрогеназы (ЛДГ) в митохондриях печени при термической травме может служить одним из критериев степени выраженности гипоксии, так как СДГ в значительной мере определяет скорость потребления кислорода и образования АТФ в дыхательной цепи. Посредством повышения генерации АФК восстановительный стресс, как и окислительный, инициирует рост активности свободнорадикального окисления (СРО). Одной из характеристик окислительного стресса является повышенное образование и накопление продуктов перекисного окисления клеточных компонентов. Наибольшее внимание исследователей привлекают продукты перекисного окисления липидов (ПОЛ), поскольку они способны к продолжению цепи повреждения компонентов клетки. Таким образом, исследование структурно-функциональных особенностей митохондрий при ожоговой болезни позволит расширить представления о возникновении и развитии метаболических нарушений в гепатоцитах, приводящих к гипоксии и окислительному стрессу.
Целью исследования было изучение структурных особенностей и окислительно-энергетического статуса печени при экспериментальном ожоге.
Материал и методы исследования. Работа выполнена на 30 крысах-самцах линии Wistar массой 200–250 г в условиях термической травмы. Эксперимент проводили в строгом соответствии с этическими нормами и правилами лабораторной практики (GLP), Женевской конвенции по защите животных «International Guiding Principles for Biomedical Research Involving Animals» (Geneva, 1990), приказом МЗ РФ № 708н от 23.08.2010 «Об утверждении правил лабораторной практики» и с одобрения Локального этического комитета ФГБОУ ВО «ПИМУ» Минздрава России.
Животные содержались в стандартных условиях вивария: при естественном освещении, сбалансированном рационе питания и свободном питьевом режиме. Животные были рандомно разделены на 2 группы: 1-я – контрольная – интактные здоровые крысы (n=15); 2-я – опытная – крысы с комбинированной термической травмой (КТТ) (n=15). Экспериментальную комбинированную термическую травму моделировали под внутримышечным наркозом (Zoletil 100 (VIRBAC, France) (60 мг/кг) + Xyla VET (Pharmamagist Ltd., Hungary) (6 мг/кг) путем нанесения контактного ожога на площадь 20% поверхности тела и термоингаляционного воздействия горячим воздухом и продуктами горения [5]. Крыс выводили из эксперимента на 1-е, 7-е, 14-е сутки после КТТ декапитацией под наркозом (Zoletil 100 + Xyla VET) (рис. 1).
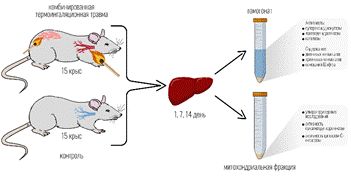
Рис. 1. Схема эксперимента
Митохондрии выделяли путем дифференциального центрифугирования из гомогената печени. Состав раствора для получения гомогената печени включал 0,25 М сахарозы, 1 мМ ЭДТА, 0,01 М трис-HCl-буфер (рН = 7,5) [6]. Электронно-микроскопическое исследование качества и структурного состава митохондрий проводили с помощью трансмиссионного электронного микроскопа HT7700 (Hitachi). Для этого полученную фракцию митохондрий погружали в 2,5% глутаровый альдегид с последующей дофиксацией четырехокисью осмия. После промывки буферным раствором, проводки по спиртам восходящей крепости и пропитки материал заключали в эпоксидную смолу. Приготовление срезов толщиной 100 нм осуществляли с помощью ультрамикротома Power Tome PC (RMC Products, США). Для контрастирования ультратонких срезов использовали уранилацетат и цитрат свинца.
Для оценки энергетического метаболизма и наличия признаков гипоксии при КТТ в гомогенате и митохондриях печени определяли каталитические свойства лактатдегидрогеназы в прямой реакции (ЛДГпр) и обратной реакции (ЛДГобр) [5], в митохондриях – удельную активность ферментов дыхательной цепи – СДГ и цитохром с-оксидазы [7]. В гомогенате и митохондриях печени оценивали интенсивность СРО по концентрации диеновых конъюгатов (ДК), триеновых конъюгатов (ТК) и оснований Шиффа (ОШ) [8], удельную активность антиоксидантных ферментов – каталазы [5] и супероксиддисмутазы (СОД) [9]. Для расчета удельной активности ферментов определяли содержание белка в гомогенате и митохондриальной фракции печени [10].
Для статистической обработки результатов использовали программу Statistica 6.0 (StatSoft Inc., USA). Результаты представлены в виде средней арифметической величины показателей и среднего квадратичного отклонения. Для оценки нормальности распределения полученных данных применяли критерий Шапиро–Уилка, для установления значимости различий – t-критерий Стьюдента, для выявления взаимосвязей между показателями – коэффициент корреляции (r) Пирсона.
Результаты исследования и их обсуждение. Проведенная оценка полученной фракции митохондрий показала, что образцы соответствовали требованиям к материалу для электронно-микроскопических фотографий высокого качества и информативности и главное – были пригодны для дальнейшей оценки метаболических изменений указанными выше методами. Органеллы хорошо идентифицировались, мембраны митохондрий из печени крыс контрольной группы были сохранны, матрикс – плотный, кристы преимущественно четкие (рис. 2 А,а). Выявлены отличия от контроля в структуре элементов митохондриальной фракции, выделенной из печени крыс после КТТ: через 7 суток после ожога в образцах обнаруживались как крупные, так и мелкие митохондрии, мембраны большей части органелл были сохранены, кристы частично просматривались, однако была отмечена выраженная дистрофия части митохондрий в полях зрения (рис. 2 Б,б). Через 14 суток после КТТ в образцах в большом количестве визуализировались митохондрии, охарактеризованные как «набухшие», с признаками значительных изменений внутренней структуры. В некоторых органеллах отмечались нарушение длины, формы крист, их разрывы и даже полное отсутствие крист, а также встречались отдельные полностью разрушенные органеллы (рис. 2 В,в). Часть митохондрий, напротив, имела плотный гранулярный матрикс, маскирующий кристы. Кроме того, на этом сроке эксперимента в образцах митохондрий из печени животных опытной группы, как в самих органеллах, так и на поверхности их мембран, были обнаружены уплотнения, предположительно – зерна гликогена, рибосомы [5].
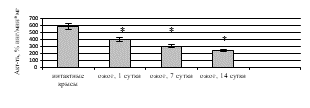
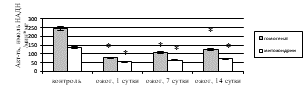
Исследование активности ферментов дыхательной цепи митохондрий выявило статистически значимое ингибирование СДГ (рис. 3а) и цитохром с-оксидазы (рис. 3б) после КТТ по сравнению с показателями здоровых крыс. Снижение удельной активности СДГ на 1-е (в 1,1 раза (p=0,016)), 7-е (в 2,6 раза (p=0,017)), 14-е сутки (в 10,2 раза (p=0,008)) после ожога и, соответственно, уменьшение активности цикла лимонной кислоты может быть вызвано активацией фумаратредуктазной реакции и, как следствие, увеличением АФК, ингибирующим СДГ [11]. Статистически значимое снижение удельной активности цитохром с-оксидазы в митохондриях печени крыс, получивших термический ожог, вероятно, обусловлено конформационными изменениями молекулы фермента под влиянием АФК, способных связываться с атомами металлов, входящих в его состав [12]. При этом уменьшение активности ферментов дыхательной цепи митохондрий при КТТ приводит к снижению в клетке аэробного и усилению анаэробного окисления. Кроме того, ингибирование СДГ и цитохром с-оксидазы может быть следствием нарушения работы электронного транспорта в мембране митохондрий и недостаточного производства АТФ, что вызывает уменьшение энергетического обеспечения клетки при ожоге.
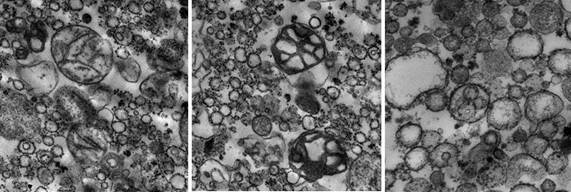
А Б В
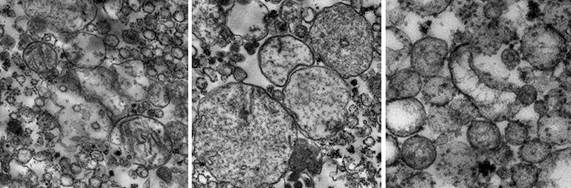
а б в
Рис. 2. Митохондрии печени крысы, сделанные с помощью трансмиссионного электронного микроскопа HT7700 (Hitachi): А,а) контрольная группа, увеличение x10000; Б,б) опытная группа, 7 суток после травмы, увеличение x10000; В,в) опытная группа, 14 суток после травмы, увеличение x20000, x30000 соответственно
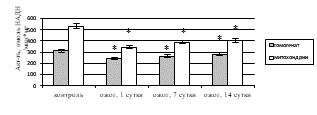
О снижении энергетического метаболизма в печени после КТТ свидетельствовало ингибирование удельной активности ЛДГ как в прямой (рис. 3в), так и в обратной реакциях (рис. 3г), вызывая накопление лактата – маркера тканевой гипоксии. При экспериментальном ожоге в гомогенате печени удельная активность ЛДГпр уменьшилась в 1-е сутки в 3,2 раза (р<0,001), на 7-е сутки – в 2,3 раза (р<0,001), на 14-е сутки – в 1,9 раза (р=0,010); для ЛДГобр отмечено снижение удельной активности на 1-е сутки в 1,3 раза (р=0,027), на 7-е сутки – в 1,2 раза (р=0,031), на 14-е сутки – в 1,1 раза (р=0,039). В митохондриальной фракции выявлено ингибирование ЛДГпр и ЛДГобр при КТТ на 1-е сутки – в 2,4 раза (р<0,001) и 1,5 раза (р=0,026), на 7-е сутки – в 2,1 раза (р<0,001) и 1,4 раза (р=0,034), на 14-е сутки – в 1,9 раза (р=0,007) и 1,3 раза (р=0,038) соответственно по сравнению с контролем.
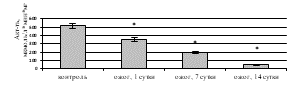
а б
в г
Рис. 3. Активность в митохондриях печени крыс в эксперименте с комбинированной термической травмой: а) сукцинатдегидрогеназы; б) цитохром с-оксидазы; в) ЛДГпр; г) ЛДГобр. * – различия между группами «опыт» и «контроль» значимы (p<0,05)
Накопление молочной кислоты при экспериментальном ожоге может быть обусловлено также ингибированием пируватдегидрогеназы и пируваткарбоксилазы и гипоксией индуцибельным фактором 1 (HIF-1), вызывающим активацию ЛДГобр [13]. Критическое снижение напряжения кислорода в ткани при термической травме наряду с ингибированием СДГ, цитохром с-оксидазы, ЛДГ приводит к активации анаэробного пути образования энергии в клетке.
Оценка концентрации первичных (ДК) и вторичных (ТК) продуктов ПОЛ в гомогенате и митохондриях печени выявила их наибольший рост на 7-е и 14-е сутки после КТТ, что вызвало интенсификацию СРО в печени крыс. На 1-е сутки после КТТ отмечено увеличение уровня ДК в гомогенате печени в 1,1 раза (р=0,041) и ТК – в митохондриях печени в 1,2 раза (р=0,035). При КТТ содержание ДК возросло в гомогенате на 7-е сутки в 1,6 раза (р=0,020) и на 14-е сутки – в 1,6 раза (р=0,005). Уровень ТК увеличился в гомогенате печени на 7-е сутки после КТТ в 1,7 раза (р=0,001), на 14-е сутки – в 2 раза (р=0,001), в митохондриях повысился на 7-е сутки после КТТ в 1,9 раза (р=0,007), на 14-е сутки – в 2,7 раза (р<0,001) по сравнению с контролем (табл. 1).
Содержание конечных продуктов перекисного окисления липидов (ОШ) в печени возросло на 7-е и 14-е сутки после экспериментального ожога. Так, в гомогенате концентрация ОШ увеличилась на 7-е сутки после поражения в 1,2 раза (р=0,034), на 14-е сутки – в 2,8 раза (р=0,001) по сравнению с контролем. В митохондриях печени как показателе интегрального состояния клеток и источнике АФК отмечен рост уровня ОШ на 7-е сутки после травмы в 1,6 раза (р=0,003) и 14-е сутки – в 2,8 раза (р<0,001) (табл. 1). Рост высокотоксичных первичных, вторичных и конечных продуктов ПОЛ при КТТ приводит к дестабилизации мембран и деградации клеток, что обусловлено способностью ДК, ТК и ОШ повреждать белки, липопротеиды и нуклеиновые кислоты.
Таблица 1
Интенсивность свободнорадикального окисления в печени крыс с комбинированной термической травмой
|
Условия эксперимента |
Фракция |
ДК, отн.ед.оп.пл. |
ТК, отн.ед.оп.пл. |
ОШ, отн.ед.оп.пл. |
|
Контроль |
гомогенат |
0,253±0,006 |
0,197±0,005 |
0,143±0,003 |
|
митохондрии |
0,163±0,004 |
0,086±0,003 |
0,071±0,002 |
|
|
Ожог, 1-е сутки |
гомогенат |
0,271±0,005* |
0,201±0,007 |
0,146±0,006 |
|
митохондрии |
0,172±0,010 |
0,102±0,008* |
0,073±0,011 |
|
|
Ожог, 7-е сутки |
гомогенат |
0,392±0,007* |
0,334±0,009* |
0,178±0,011* |
|
митохондрии |
0,346±0,005* |
0,159±0,002* |
0,114±0,006* |
|
|
Ожог, 14-е сутки |
гомогенат |
0,401±0,010* |
0,391±0,014* |
0,395±0,011* |
|
митохондрии |
0,263±0,009* |
0,234±0,017* |
0,195±0,018* |
* – различия между группами «опыт» и «контроль» значимы (p<0,05).
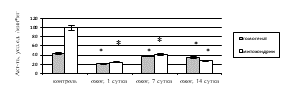
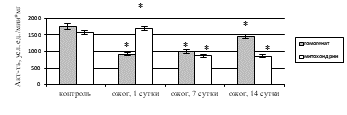
При исследовании ферментативного звена антиоксидантной системы (АОС) печени на фоне КТТ выявлено статистически значимое уменьшение удельной активности каталазы в гомогенате и митохондриях на 1-е, 7-е, 14-е сутки по сравнению с контролем (рис. 4а), что подтверждает данные литературы об ингибировании АОС при ожоге на фоне усиления процессов СРО липидов и белков [14], что может привести к повреждению ткани печени.
Активность СОД снизилась в гомогенате печени в 1,9 раза (р=0,014) на 1-е сутки после КТТ, в 1,7 раза (р=0,022) – на 7-е сутки, в 1,2 раза (р=0,036) – на 14-е сутки (рис. 4б). В митохондриях на фоне КТТ при росте удельной активности СОД в 1,1 раза (p=0,037) на 1-е сутки после экспериментального ожога отмечено уменьшение каталитических свойств фермента к 7-м и 14-м суткам в 1,8 раза (p=0,036 и p=0,041 соответственно). Следовательно, при КТТ в гомогенате и митохондриях печени, вероятно, имеет место субстратное ингибирование СОД вследствие активации СРО (рост концентрации ДК, ТК, ОШ), приводящей к повышению количество АФК, в частности супероксидного радикала.
а б
Рис. 4. Активность в печени крыс с комбинированной термической травмой:
а) каталазы; б) супероксиддисмутазы. * – различия между группами «опыт» и «контроль» значимы (p<0,05)
Проведенный корреляционный анализ выявил наличие взаимосвязей между показателями окислительного и энергетического метаболизма в печени крыс с КТТ. В гомогенате печени на 1-е сутки после КТТ отмечена отрицательная корреляция между ДК и ЛДГпр (r=–0,734, p=0,006), на 7-е сутки – между ДК и ЛДГпр (r=–0,782, p=0,001), ОШ и ЛДГпр (r=–0,805, p=0,001), на 14-е сутки – между ОШ и ЛДГпр (r=–0,755, p=0,005), позволяющая заключить, что активация СРО обусловлена снижением энергетического метаболизма, и отрицательная корреляция на 7-е сутки после КТТ между ДК и СОД (r=–0,793, p=0,001), ДК и каталазой (r=–0,825, p=0,001), на 14-е сутки после КТТ – между ДК и СОД (r=–0,736, p=0,004), ОШ и СОД (r=–0,778, p=0,001), свидетельствующая о развитии окислительного стресса. Анализ взаимосвязей биохимических показателей в митохондриях печени выявил положительную корреляцию между активностью СДГ и цитохром с-оксидазы на 1-е (r=0,738, p=0,019), 7 (r=0,664, p=0,038) сутки, но отрицательную корреляцию между ОШ и ЛДГпр на 7-е (r=–0,812, p=0,001) и 14-е (r=–0,794, p=0,001) сутки после КТТ.
Таким образом, при КТТ вследствие чрезмерной продукции АФК и негативного ответа (снижение активности) ферментативного звена АОС развивается окислительный стресс, проявляющийся в повышении СРО и приводящий к усилению деструктивных процессов, повреждению мембран клеток и развитию системных нарушений [15], являясь патогенетическим фактором ожоговой болезни. При гипоксии, вызванной КТТ, в клетке активируется анаэробный гликолиз, накапливается лактат, развиваются ацидоз и энергетическая недостаточность. Одну из ключевых ролей в развитии окислительного стресса при гипоксии можно отвести митохондриям, в которых при комбинированной термической травме развиваются структурно-функциональные нарушения (рис. 5).
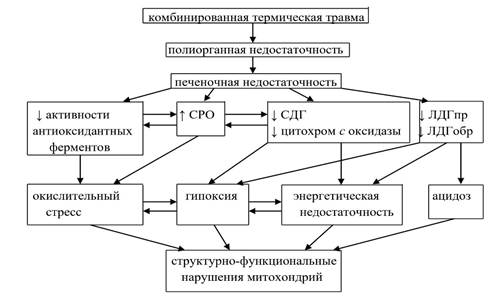
Рис. 5. Участие митохондрий в развитии метаболических нарушений гепатоцитов при комбинированной термической травме
Заключение. В ходе проведенного исследования доказано наличие при комбинированной термической травме в организме, во-первых, гипоксии и, во-вторых, окислительного стресса. Выявлены изменения в структуре элементов митохондриальной фракции, выделенной из печени крыс после КТТ, и угнетение энергетического обеспечения митохондрий при ожоге, проявляющееся уменьшением активности сукцинатдегидрогеназы и цитохром с-оксидазы, что свидетельствует о снижении в клетке аэробного и усилении анаэробного окисления. В проведенном исследовании показано, что определение активности антиоксидантных ферментов, а также сукцинатдегидрогеназы и цитохром с-оксидазы может быть использовано в качестве маркеров метаболических нарушений печени при гипоксии, обусловленной термической травмой.
Авторы выражают глубокую признательность руководителю лаборатории молекулярной эпидемиологии вирусных инфекций Нижегородского научно-исследовательского института эпидемиологии и микробиологии им. проф. И.Н. Блохиной доктору биологических наук, профессору Новиковой Надежде Алексеевне за предоставленный доступ к оборудованию и благодарность научному сотруднику Александру Юрьевичу Кашникову за проведенные исследования.
Авторы выражают благодарность Центру корреляционной микроскопии ФГБОУ ВО «ПИМУ» Минздрава России за подготовку научной иллюстрации.
Библиографическая ссылка
Соловьева А.Г., Кулакова К.В., Орлинская Н.Ю. ВЛИЯНИЕ ГИПОКСИИ НА НЕКОТОРЫЕ СТРУКТУРНО-БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ ПЕЧЕНИ ПОСЛЕ ЭКСПЕРИМЕНТАЛЬНОЙ ТЕРМИЧЕСКОЙ ТРАВМЫ // Современные проблемы науки и образования. 2023. № 3. ;URL: https://science-education.ru/ru/article/view?id=32626 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32626



