Авторы заявляют об отсутствии конфликта интересов.
Меланома кожи относится к одним из самых агрессивных видов рака кожи. Меланома кожи (МК) встречается наиболее часто, как правило, связана с воздействием УФ-излучения и повышенной мутационной нагрузкой опухоли (ТМВ), которые способствуют высокой иммуногенности. Около 5% пациентов с меланомой имеют метастатическое заболевание, которое генотипически напоминает меланому кожи, но без первичного очага, что позволяет предположить, что первичная опухоль могла спонтанно регрессировать [1]. Также меланому часто связывают с витилиго - проявлением аутоиммунной реакции против меланоцитов, что указывает на перекрестные иммунные реакции, нацеленные на меланому и нормальные меланоциты. Было продемонстрировано, что витилиго является благоприятным прогностическим признаком у пациентов, предполагая, что антимеланоцитарный иммунный ответ помогает контролировать рост меланомы. Отмечено также, что меланома может быть инфильтрирована реактивными лимфоцитами [2], при этом плотная инфильтрация периопухолевыми лимфоцитами связана с лучшим прогнозом, и классификация меланомы, основанная на распределении инфильтрирующих опухоль лимфоцитов (TIL) (активное, неактивное и отсутствующее), все еще используется сегодня [3]. Однако меланома очень быстро метастазирует, что указывает на то, что активная иммунная супрессия должна компенсировать ее иммуногенность. Механизм уклонения от иммунного ответа при прогрессировании заболевания может подчеркивать специфическую уязвимость меланомы к иммунотерапии, что объясняет ее уникальную реакцию на эти методы лечения.
Концепция блокады иммунных контрольных точек (ИКТ) для лечения рака была впервые предложена Джимом Эллисоном и его коллегами, показавшими, что антитела, блокирующие ко-ингибирующий рецептор Т-клеток CTLA-4, могут способствовать регрессу опухоли у мышей [4]. Затем были разработаны и испытаны на пациентах антитела, блокирующие CTLA-4 человека, при этом ипилимумаб стал первым препаратом, увеличивающим выживаемость при метастатической меланоме, что привело к его одобрению для лечения этого заболевания в 2011 году. PD-1 был признан еще одной ключевой контрольной точкой Т-клеток иммунитета [5]. Было обнаружено, что антитела, блокирующие PD-1 или PD-L1, усиливают контроль над опухолью у мышей [6] и функциональность CD8+ Т-клеток в модели хронической вирусной инфекции [7]. Результаты клинических испытаний антител, блокирующих PD-1, в рефрактерных солидных опухолях были подтверждены в исследованиях фазы 3, где было обнаружено, что ингибиторы PD-1 пембролизумаб и ниволумаб увеличивают выживаемость по сравнению с ипилимумабом или химиотерапией [8]. Затем эти препараты были одобрены для лечения метастатической меланомы в 2014 году.
В целом успех применения ИКТ при меланоме подтвердил терапевтическое воздействие активации иммунной системы для эффективного воздействия на это заболевание. Однако контроля заболевания удается достичь не у всех пациентов. Это указывает на необходимость поиска новых прогностических предикторов ответа. Хотя было обнаружено, что повышенная экспрессия PD-L1 в опухоли и TMB коррелируют с ответом на ИКТ при меланоме, эти биомаркеры не могут точно предсказать исход во всех случаях. Кроме того, обращают на себя внимание противоречивые данные относительно особенностей параметров клеточного иммунитета у пациентов с меланомой на фоне проводимой терапии ИКТ с различным ответом на неё.
Цель исследования: определить показатели системного клеточного иммунитета больных меланомой кожи для прогнозирования ответа на лечение препаратами ИКТ.
Материалы и методы исследования
В исследование включены данные о 30 пациентах с верифицированным диагнозом «генерализованная меланома кожи», получивших лечение в ФГБУ «НМИЦ онкологии» МЗ РФ с 2019 по 2021 г. Средний возраст больных составил 60 лет. Лечение пациентов проводили с применением анти – PD-1 терапии (пембролизумаб 200 мг в/в, цикл 21 день или ниволумаб 480 мг в/в, цикл 28 дней), до появления достоверных признаков прогрессирования процесса или непереносимой токсичности лечения. Больные были разделены на две группы: 1-я – пациенты с общим ответом (n=21), 2-я – пациенты с прогрессированием заболевания (n=9). Забор К3ЭДТА-крови для цитофлюориметрического исследования получали до начала лечения; после осуществления 4 и 8 курсов иммунотерапии.
Цитофлюориметрическое исследование осуществляли с использованием следующих наборов антител (Becton Dickinson, США):
CD3 FITC /CD15+56 PE /CD45 PerCP /CD4 PE-Cy7/CD19 APC/CD8 APC-Cy7.
CD45RA FITC/CD62L PE/CD3 PerCP/CD4 PE-Cy7/CD45RО APC/CD45 APC-Cy7.
CD4 FITC /CD127 PE /CD3 PerCP /CD25 APC-Cy7.
CD4 FITC /CD38 PE /CD3 PerCP /HLADR APC.
TCRαβ FITC/TCRγδ PE/ CD3 PerCP /CD8 PE-Cy7/CD45 APC-Cy7.
CD19 FITC/CD86 PE/ CD20 PerCP-Cy5.5/CD95 APC/CD25 APC-Cy7.
Оценка результатов фенотипирования клеток крови осуществляли на FacsCanto II (Becton Dickinson, США), при этом для анализа собирали не менее 50 000 клеток. Результаты выражали в процентах от общего количества лимфоцитов, в то время как T-regs – в процентах от CD3+CD4+ клеток.
Статистическую обработку полученных результатов проводили с использованием пакета Statistica 13,3 (StatSoft Inc., США). С использованием критерия Шапиро - Уилка определяли характер распределения показателей, которые в результате не соответствовали нормальному распределению, в связи с чем они представлены в виде медианы (Me) и интерквартильного размаха - 25 и 75 процентилей (Ме [LQ; UQ]). Уровень значимости отличий между выборками оценивали непараметрическим критерием Манна - Уитни, а результаты считались статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
На рисунках 1 и 2 представлены полученные результаты.
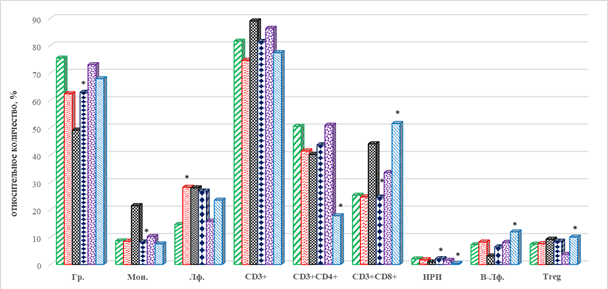
У пациентов первой группы, с положительным эффектом от терапии, после 4 курса в периферической крови больных отмечается статистически значимое увеличение количества моноцитов и лимфоцитов соответственно на 150% (р=0,027) и 92% (р=0,031) по сравнению с показателями до лечения. На этом фоне выявлено снижение на 35% (р=0,043) гранулоцитов. Обращает на себя внимание значимое увеличение на 74% (р=0,028) ЦТЛ (CD3+CD8+), которое на фоне тенденции к снижению содержания Т-лимфоцитов хелперов приводит к снижению ИРИ на 55% (р=0,035), что может указывать на сдвиг в популяциях клеток адаптивного иммунитета в сторону цитотоксических. Кроме того, выявлено снижение на 57% (р=0,029) количества В-лимфоцитов, а также тенденция к увеличению содержания Т-регуляторных лимфоцитов (рис. 1).
|
|
|
|
Рис. 1. Показатели клеточного иммунитета крови больных с меланомой в ходе иммунотерапии: группа 1 – ответ на терапию; группа 2 – прогрессия заболевания; * - значимо по сравнению со значением показателя у группы 1, р<0,05
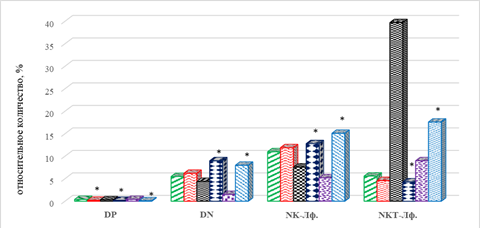
В рассматриваемые сроки выявлено резкое увеличение относительного количества одной из популяций клеток врожденного иммунитета – NKT-лимфоцитов, число которых превышало исходный уровень в 6 раз (р=0,005), в то время как другая популяция, NK-лимфоциты, характеризовалась иным направлением изменений: их количество оказалось ниже на 31% (р=0,048), что может говорить о перераспределении функциональных элементов клеточного звена врожденного иммунитета. При этом отмечается тенденция к снижению по сравнению с исходным уровнем числа DP, DN-клеток (рис. 2).
|
|
|
|
|
|
Рис. 2. Показатели клеточного иммунитета больных с меланомой в ходе иммунотерапии: группа 1 – ответ на терапию; группа 2 – прогрессия заболевания; * - значимо по сравнению со значением показателя у группы 1, р<0,05
После 8-го курса ИТ у пациентов первой группы содержание NKT-лимфоцитов остается выше исходных значений на 61%, р=0,038, однако это оказалось ниже соответствующего показателя после 4-го курса на 77%, р=0,031. На этом фоне количество NK-лимфоцитов продолжало уменьшаться: их число было ниже как уровня до, так и после 4 курсов ИТ, соответственно на 53%, р=0,037, и 32%, р=0,045 (рис. 2). Выявлено разнонаправленное изменение предшественников Т-лимфоцитов: если содержание DN-лимфоцитов снижалось относительно всех сравниваемых периодов (на 73% по сравнению с исходным уровнем и 66% - после 4 курсов ИТ), то количество DP-лимфоцитов превышало показатель после 4-х курсов терапии на 33%, р=0,047 (рис. 2).
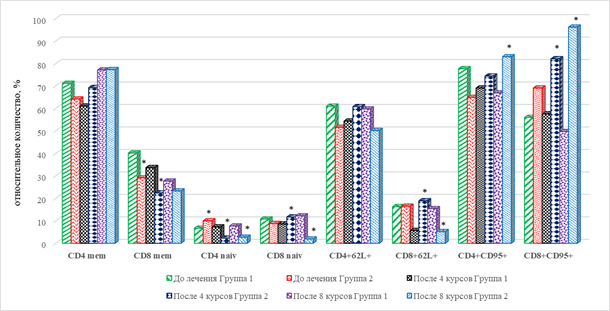
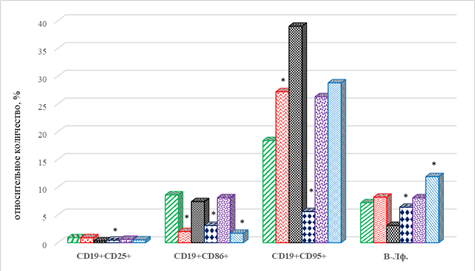
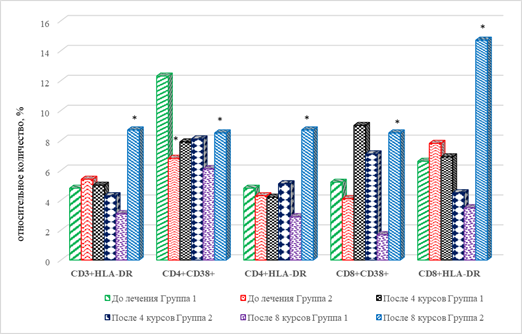
После завершения 4 курсов ИТ выявлено значимое снижение на 65% (р=0,034) количества CD8+ Т-клеток эффекторной памяти, снижение на 67% (р=0,033) CD19+CD25+ В-лимфоцитов и увеличение на 112% (р=0,027) В-клеток с фенотипом CD19+CD95+, по сравнению с их количеством до проведения лечения (рис. 2). В рассматриваемые сроки терапии отмечается значимое увеличение на 73% (р=0,036) цитотоксических Т-клеток с маркерами ранней активации CD8+CD38+, без изменения относительного содержания ЦТЛ с маркерами поздней активации CD8+CDHLA-DR+ по сравнению с исходными показателями. При этом обнаружено снижение на 36% (р=0,046) количества CD4+CD38+ (рис. 2).
После проведения 8 курсов иммунотерапии выявлен ряд особенностей рассматриваемых показателей субпопуляционного состава лимфоцитов периферической крови. В рассматриваемые сроки по сравнению с соответствующими показателями до начала терапии статистически значимым оказалось снижение на 31% CD8+ лимфоцитов центральной памяти, а также В-клеток фенотипа CD19+CD25+ на 67% (р=0,033). Показано увеличение на 43% (р=0,039) CD19+CD95+В-лимфоцитов (рис. 2), что может указывать на превалирование функционально зрелых типов данных ИКК.
Сравнение результатов с показателями после 4 курсов лечения выявило увеличение относительного количества наивных ЦТЛ в сочетании с увеличением CD8+ Т-клеток эффекторной памяти на 42% (р=0,041) и 170% (р=0,029) соответственно. При этом отмечен разнонаправленный характер изменения популяций В-лимфоцитов: увеличение на 100% CD19+CD25+ лимфоцитов (р=0,021) и снижение на 32% (р=0,045) клеток фенотипа CD19+CD95+ (рис. 1, 2). Сравнение отдельных популяций лимфоцитов с маркерами ранней и поздней активации после проведения 8 курсов лечения и их исходными значениями выявило выраженное и однонаправленное изменение этих показателей: число CD4+, CD8+ лимфоцитов с маркерами ранней и поздней активации были ниже на 50% (р=0,038), 40% (р=0,043) и 67% (р=0,041), 47% (р=0,037). Рассматриваемые показатели также оказались ниже и по сравнению с аналогичными значениями после 4 курсов ТИ (рис. 1).
Определение выбранных показателей у пациентов второй группы не выявило отличий после проведения 4 курсов терапии от аналогичных показателей до начала лечения в случае большинства показателей, за исключением количества DN-клеток, количество которых оказалось выше исходных значений на 45%, р=0,039 (рис. 2).
После 8 курсов терапии отмечаются изменения, которые, как правило, имеют одинаковую направленность по сравнению как с исходными, так и со значениями аналогичных показателей после 4-го курса ИТ. В периферической крови пациентов в случае прогрессирования заболевания выявлено снижение Т-лимфоцитов хелперно-индукторной популяции и, напротив, увеличение количества цитотоксических Т-лимфоцитов соответственно на 57% (р=0,033) и 59% (р=0,032), в 2,08 раза (р=0,029) и 2,09 раза (р=0,027). Указанные изменения находят отражение и в снижении ИРИ на 80% (р=0,034) и 83% (р=0,032) соответственно по сравнению с исходными значениями и после 4 курсов лечения (рис. 1). Кроме того, обнаружено увеличение количества В-лимфоцитов – данный показатель оказался выше на 45% (р=0,043) и 86% (р=0,039) как по сравнению с исходными, так и по сравнению со значениями после 4 курсов ИТ (рис. 1). Выявлено значимое увеличение на 32% (р=0,046) содержания в крови Тreg-лимфоцитов по сравнению с исходными значениями.
В рассматриваемые сроки после начала лечения у пациентов с прогрессированием заболевания обнаружен дисбаланс в образовании предшественников Т-лимфоцитов. Так, по сравнению с исходными значениями содержание DP-лимфоцитов было ниже на 50% (р=0,039), в то время как количество DN-клеток, напротив, оказалось выше на 29%, р=0,048 (рис. 2).
По сравнению с аналогичными показателями после 4 курсов указанное направление изменения содержания данных популяций клеток сохраняется. В рассматриваемые сроки наблюдения у больных меланомой в случае прогрессирования заболевания обнаруживается выраженное увеличение относительного количества клеток врожденного иммунитета с цитолитической активностью: резкое увеличение NKT-клеток – на 283% (р=0,023) по сравнению с исходными значениями и 309% (р=0,018) по сравнению с показателями после 4 курсов терапии (рис. 2). На этом фоне количество NK-лимфоцитов по завершении терапии значимо превышало на 27% (р=0,048) исходные значения. После проведения 4 курсов терапии выявлено увеличение на 33% (р=0,046) количества наивных CD8+ Т-лимфоцитов, что сопровождалось снижением числа наивных CD4+ Т-лимфоцитов на 77%, р=0,034, по сравнению с исходными значениями до лечения (рис. 1).
В рассматриваемые сроки наблюдения выявлен разнонаправленный характер изменения количества отдельных популяций В-лимфоцитов. Обнаружено увеличение по сравнению с исходными значениями на 55% (р=0,039) содержания CD19+CD86+ В-лимфоцитов и снижение на 50% (р=0,04) и 79% (р=0,035) соответственно количества CD19+CD25+ и CD19+CD95+ В-лимфоцитов (рис. 2).
Определение особенностей популяционного состава клеток периферической крови после 8-го курса ИТ по отношению к исходным данным, до начала лечения выявило снижение на 73% (р=0,039) и 78% (р=0,037) относительного количества наивных Т-лимфоцитов обеих основных популяций, соответственно CD4+ и CD8+ клеток. На этом фоне обнаружено увеличение количества клеток с повышенной готовностью к апоптозу – CD4+CD95+ и CD8+CD95+, соответственно на 28% (р=0,047) и 39% (р=0,045). Кроме того, выявлено снижение количества CD8+CD62L+ эффекторных клеток памяти на 68% (р=0,038) по сравнению с исходными значениями. Среди популяций В-лимфоцитов значимым оказалось снижение на 44% (р=0,043) клеток, несущих активационный маркер CD25+ (рис. 1).
Статистически значимыми оказались следующие отличия в популяционном составе клеток крови по сравнению с аналогичными значениями после 4-го курса терапии. Относительное число наивных CD8+ Т-лимфоцитов и CD8+ клеток эффекторной памяти было ниже на 84% (р=0,031) и 72% (р=0,038) соответственно. Кроме того, отмечен разнонаправленный характер изменений в некоторых субпопуляциях В-лимфоцитов: выявлено резкое увеличение на 414% (р=0,019) числа клеток с фенотипом CD19+CD95+ и, наоборот, снижение на 45% (р=0,042) количества CD19+CD86+ клеток (рис. 2).
После 4-го курса терапии статистически значимым по сравнению с исходными значениями оказалось только увеличение на 73% (р=0,038) числа ЦТЛ с маркерами ранней активации (CD8+CD38+) и уменьшение на 42% (р=0,042) данных клеток с маркерами поздней активации - CD8+HLA-DR+ (рис. 2).
По завершении лечения выявлено увеличение относительного количества Т-лимфоцитов, несущих маркер поздней активации (CD3+HLA-DR+) как по отношению к исходным значениям, так и по отношению к значениям показателя после 4 курсов ИТ, соответственно на 61% (р=0,043) и в 2 раза (р=0,037). Увеличение числа данной популяции, вероятно, обусловлено увеличением всех основных типов клеток – Т-лимфоцитов хелперов (CD4+HLA-DR+) и цитотоксических Т-лимфоцитов (CD8+HLA-DR+), соответственно в 2 раза (р=0,024) и 71% (р=0,033), 89% (р=0,031) и в 2,3 раза (р=0,011), что отражает повышение числа клеток адаптивного иммунитета с повышенной функциональной активностью (рис. 2). Обращает на себя внимание тот факт, что на фоне отмеченных изменений не наблюдается изменения числа клеток, несущих маркеры ранней активации, за исключением увеличения на 107% (р=0,035) количества CD8+CD38+ клеток.
Несомненно, особый интерес представляет выявление тех клеточных показателей периферической крови, которые потенциально могут обуславливать неблагоприятный ответ на лечение препаратами PD-1 ингибиторов, т.е. в случае прогрессирования заболевания (группа 2) по сравнению с аналогичными показателями при благоприятном ответе (группа1).
Выявлено, что до начала терапии у больных 2-й группы наблюдается увеличение количества лимфоцитов на 93% (р=0,029), что сопровождается увеличением наивных CD4+ Т-клеток и CD19+CD95+ В-лимфоцитов соответственно на 49% (р=0,037) и 48% (р=0,038). При этом число DP-лимфоцитов, CD8+ клеток центральной памяти, CD19+CD86+ В-лимфоцитов, а также CD4+CD38+ Т-клеток оказалось ниже соответственно на 50% (р=0,039), 28% (р=0,043), 77% (р=0,032) и 45% (р=0,035).
По завершении 4 курсов лечения у больных 2-й группы отмечено увеличение числа гранулоцитов на 28% (р=0,047), что сочеталось с уменьшением относительного количества моноцитов периферической крови на 62% (р=0,035), рис. 1. В эти сроки у пациентов с прогрессированием в дальнейшем заболевания обнаружено снижение цитотоксических CD8+ Т-лимфоцитов на 44% (р=0,039), что без изменения содержания Т-лимфоцитов хелперно-индукторной группы приводит к увеличению ИРИ на 131% (р=0,027). При этом выявлен разнонаправленный характер изменения количества предшественников Т-лимфоцитов у пациентов 2-й группы: снижение на 33% (р=0,045) числа DP-лимфоцитов и увеличение на 104% (р=0,031) – DN-лимфоцитов (рис. 2). Следует обратить внимание на увеличение количества В-лимфоцитов на 106% (р=0,029), причем если содержание субпопуляции CD19+CD25+ увеличивалось на 50% (р=0,04), то CD19+CD85+ и CD19+CD95+, напротив, в данные сроки оказались ниже на 58% (р=0,039) и 85% (р=0,035) соответственно у пациентов с дальнейшей прогрессией заболевания (рис. 2).
В рассматриваемые сроки наблюдения обнаруживается ряд дисбалансов в соотношении функционально значимых популяций лимфоцитов. Так, показано увеличение на 36% (р=0,046) количества наивных CD8+ Т-лимфоцитов, в то время как содержание наивных CD4+ Т-клеток, напротив, оказалось ниже на 68% (р=0,034). Кроме того, если содержание CD4+ клеток центральной и эффекторной памяти не претерпевало изменений, то обнаружено снижение на 33% (р=0,044) числа CD8+ клеток центральной, но резкое увеличение на в 2,3 раза (р=0,004) клеток CD8+ клеток эффекторной памяти. Кроме того, наблюдается увеличение на 42% (р=0,042) числа ЦТЛ, готовых к апоптозу (CD8+CD95+), что может указывать на определенную функциональную неполноценность эффекторных клеток адаптивного иммунитета (рис. 1).
Интересным, на наш взгляд, является также тот факт, что у пациентов с отсутствием положительного эффекта от ИТ к завершению наблюдения в периферической крови наблюдается накопление NK-лимфоцитов, которых было больше на 68% (р=0,037), и более выраженное снижение на 89% (р=0,033) количества NKT-лимфоцитов (рис. 2).
В завершение проведения ИТ, после 8-го курса, у больных 2-й группы отмечается тенденция к снижению на 27% (р=0,051) содержания в крови моноцитов (рис. 1). В это время обнаруживается дисбаланс в количестве основных популяций клеток адаптивного иммунитета: снижение на 65% (р=0,034) числа CD4+ Т-лимфоцитов хелперов и увеличение на 53% (р=0,036) CD8+ цитотоксических Т-лимфоцитов, в результате чего ИРИ оказывается снижен на 77% (р=0,033). Обращает на себя внимание выраженное увеличение на 170% (р=0,028) в периферической крови иммуносупрессивных Treg-лимфоцитов (рис. 1).
У больных 2-й группы после 8-го курса ИТ выявлено увеличение относительного количества В-клеток на 47% (р=0,043), а В-лимфоцитов с фенотипом CD19+CD86+ было ниже на 79% (р=0,031).
К данному сроку наблюдения у больных с последующей прогрессией заболевания обнаружен дисбаланс в процессах образования Т-лимфоцитов, что проявляется в разнонаправленном характере изменения количества предшественников данных клеток. Так, если относительное содержание DP-лимфоцитов было ниже на 75% (р=0,035), то количество DN-клеток, напротив, превышало в 4,3 раза (р=0,0015). Отмеченные изменения сопровождаются снижением содержания наивных Т-лимфоцитов обеих основных популяций адаптивного иммунитета – на 65% (р=0,039) и 84% (р=0,037) соответственно CD4+ и CD8+ клеток. Кроме того, обнаружено снижение у пациентов 2-й группы на 66% (р=0,041) CD8+ клеток эффекторной памяти. При этом количество клеток, готовых к апоптозу, обеих популяций оказалось выше у больных 2-й группы, соответственно на 24% (р=0,047) и 94% (р=0,025) для CD4+CD95+ и CD8+CD95+ клеток (рис. 1).
В периферической крови пациентов с прогрессией заболевания после 8-го курса ИТ наблюдается увеличение эффекторных клеток обеих популяций лимфоцитов с маркерами ранней и поздней активации: на 39% (р=0,041), 200% (р=0,0014), 400% (р=0,0004) и 320% (р=0,0008) соответственно CD4+CD38+, CD4+HLA-DR+, CD8+CD38+ и CD8+HLA-DR+ клеток, что может указывать на выраженную активацию адаптивного клеточного иммунитета (рис. 2).
Отмеченные изменения в содержании отдельных популяций клеток адаптивного иммунитета сочетаются с выраженным увеличением в крови эффекторных клеток врожденного иммунитета. Обнаружено увеличение относительного содержания NK- и NKT-лимфоцитов в 1,9 раза (р=0,017) и 96% (р=0,023) соответственно (рис. 2).
Применение препаратов, направленных на различные контрольные точки иммунитета, имеет своей целью деблокирование отдельных механизмов ингибирования активности соответствующих звеньев врожденного и адаптивного иммунитета у онкологических больных. Накопленный в настоящее время практический опыт использования данного вида терапии указывает на различную её эффективность при различных видах рака. Несомненно, важным вопросом является выявление закономерностей реагирования клеточного звена иммунной системы, на которое и направлено терапевтического воздействие, что может лежать в основе различной эффективности лечения пациентов.
В проведенном исследовании показано, что после 8-го курса, при ответе на терапию, происходит увеличение числа гранулоцитов и В-лимфоцитов за счет клеток с активационным рецептором CD25+. Обнаруживается снижение Тreg-клеток, сочетающееся дисбалансом предшественников Т-лимфоцитов: увеличение DP- и снижение DN-лимфоцитов. Несмотря на снижение содержания CD4+, CD8+ лимфоцитов с маркерами ранней и поздней активации, обнаруживается увеличение наивных CD8+ клеток и CD8+ эффекторных клеток памяти. На этом фоне выявлено снижение количества клеток врожденного иммунитета - NK- и NKT-лимфоцитов.
У больных с меланомой в случае дальнейшего прогрессирования заболевания после 8 курса ИТ отмечается снижение количества CD4+ Т-лимфоцитов, а также дисбаланс в предшественниках Т-лимфоцитов – снижение содержания в периферической крови DP-лимфоцитов и увеличение DN-лимфоцитов. Обращает на себя внимание увеличение содержания CD8+ ЦТЛ с превалированием клеток, имеющих маркеры поздней активации (CD8+HLA-DR+). Коме того, прогрессирование заболевания сопровождается увеличением относительного количества эффекторных клеток врожденного иммунитета, прежде всего NKT-лимфоцитов, как по отношению к исходным значениям, так и по сравнению с значениями после 4 курсов терапии. Наблюдается увеличение числа В-лимфоцитов, в том числе за счет популяции CD19+CD95+ клеток, которые, вероятно, могут обуславливать превалирование иммуносупрессивного статуса в организме совместно с Тreg-лимфоцитами, количество которых также увеличивалось.
Полученные результаты согласуются с данными литературы, согласно которым худшие показатели общей выживаемости связаны с низким содержанием Т-хелперов в крови больных меланомой кожи, получавших ипилимумаб [9].
Известно, что особая роль в развитии злокачественных заболеваний отводится Treg-субпопуляции Т-хелперов. Несмотря на то что их предиктивная роль при проведении терапии анти-PD1-препаратами показана в ряде исследований [10], функциональная нагрузка этих клеток не однозначна. Так, если при глиобластоме увеличение количества данных клеток до лечения увеличивало риск смерти, то при использовании ипилимумаба у пациентов с меланомой кожи, наоборот, обнаруживалось увеличение содержания этих клеток относительно доноров у пациентов с наибольшей продолжительностью жизни.
Полученные в нашем исследовании результаты согласуются с данными других исследователей, согласно которым при меланоме наблюдалось более частое прогрессирование и худшие показателей общей выживаемости при увеличении содержания NKT-клеток в крови [11].
Несмотря на то что В-лимфоциты не относят к основным факторам противоопухолевого иммунного ответа, их увеличение может стать одним из показателей прогноза эффективности лечения, однако это взаимодействие может являться нелинейным [12].
По мнению исследователей, большую значимость могут иметь B-регуляторные лимфоциты, увеличение количества которых приводило к ухудшению показателей выживаемости больных раком желудка, получавших химиотерапию по схеме XELOX [13].
В настоящее время на основе комплексного исследования клеточных и гуморальных факторов врожденного и адаптивного иммунитета могут быть выделены несколько вариантов иммунного реагирования пациентов на злокачественную опухоль. При изучении местнораспространенной и метастатической меланомы кожи был выделен такой вариант, как гиперактивация иммунного ответа, что сопровождается как избыточной активностью факторов врожденного иммунитета, так и высокой активностью CD4+- и CD8+-лимфоцитов [14]. Причём, как правило, содержание CD38+-лимфоцитов значительно превышает уровень CD8+-клеток. Важно, что показана наиболее неблагоприятная прогностическая значимость именно варианта гиперактивации ИС.
Таким образом, прогрессирование заболевания и отсутствие эффекта от ИТ сопровождается целым рядом особенностей изменения популяционного и субпопуляционного состава клеток врожденного и адаптивного иммунитета, что вносит определенный вклад в ответе организма по проводимое лечение.
Заключение
Прогрессирование меланомы кожи на фоне иммунотерапии характеризуется снижением количества CD4+ Т-лимфоцитов, увеличением содержания Тreg- и DN-клеток, а также CD8+ лимфоцитов с маркером поздней активации (CD8+HLA-DR+), повышением процента NKT-лимфоцитов, увеличением числа В-лимфоцитов за счет субпопуляции клеток, готовых к апоптозу (CD19+CD95+). Ответ на иммунотерапию при МК связан со стимуляцией цитотоксических Т-лимфоцитов (CD8+), обеспечивающих иммунологическую память при угнетении врожденной цитотоксичности (NKT-лимфоцитов), а также с угнетением иммуносупрессивных субпопуляций Т-клеток (Тreg, DN) и активацией В-лимфоцитов, т.е. со стимуляцией адаптивного иммунитета.
В качестве вероятных прогностически значимых показателей ответа на терапию ингибиторами PD-1 у больных МК могут быть уровни CD3+, CD4+, CD4+m, CD8+m, превышающие 78%, 50%, 66% и 30% соответственно, а также CD8+CD95+, CD19+CD86+, CD19+CD95+ клетки, количество которых ниже 60%, 12% и 21% соответственно.
Библиографическая ссылка
Сагакянц А.Б., Теплякова М.А., Владимирова Л.Ю., Бондаренко Е.С., Златник Е.Ю., Новикова И.А., Дженкова Е.А. ПАРАМЕТРЫ СИСТЕМНОГО КЛЕТОЧНОГО ИММУНИТЕТА У ПАЦИЕНТОВ С МЕЛАНОМОЙ КОЖИ НА ФОНЕ ПРОВОДИМОЙ ИММУНОТЕРАПИИ С РАЗЛИЧНОЙ ЕЕ ЭФФЕКТИВНОСТЬЮ // Современные проблемы науки и образования. 2023. № 3. ;URL: https://science-education.ru/ru/article/view?id=32598 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32598