В последние десятилетия убедительно доказано, что одним из важных патогенетических звеньев самых разнообразных патологических процессов является апоптоз, или запрограммированная гибель клеток [1, 2]. По мере накопления сведений об апоптозе расширялись возможности его идентификации. Поначалу апоптоз определялся на основании морфологических изменений клеток, а именно: разрывов мембраны, пикноза ядра и конденсации хроматина. В дальнейшем морфологические признаки апоптоза дополнились более тонкими – биохимическими, к которым относилась фрагментация ДНК и разделение ее между нуклеосомами. Но даже эти тонкие биохимические критерии свидетельствуют о поздних стадиях апоптоза. Идентифицировать клетки на начальных стадиях апоптоза до недавнего времени не было возможности. Новые перспективы открылись с обнаружением закономерностей локализации фосфатидилсерина. Это отрицательно заряженный фосфолипид, обычно расположенный на внутренней поверхности клеточных мембран. На ранних стадиях апоптоза мембрана клетки еще не изменена, но нарушается физиологическая асимметрия мембранных фосфолипидов. Это приводит к дислокации фосфатидилсерина на внешнюю сторону клеточной оболочки, что способствует распознаванию апоптотических клеток макрофагами и элиминации их. Обнаружение фосфатидилсерина при помощи красителя аннексин V приводит к идентификации апоптотических клеток на ранней стали апоптоза.
Апоптоз играет важную роль в развитии хронической обструктивной болезни легких (ХОБЛ), наряду с ферментативным дисбалансом, персистирующим воспалением, эндотелиальной дисфункцией, оксидативным стрессом и генетической предрасположенностью. Хроническая гипоксия, дисбаланс про- и антиоксидантов инициируют и стимулируют апоптоз альвеолярных эпителиоцитов, эндотелиоцитов, фибробластов. Итогом сложного сигнального каскада апоптотических реакций является элиминация погибших клеток, что способствует поддержанию функциональной пластичности легких [3, 4].
Есть данные о выраженности апоптоза при острых и хронических коронарогенных заболеваниях. Апоптоз может становиться стартом в развитии ишемии миокарда, постишемического ремоделирования сердца и коронарного атеросклероза [5].
Несмотря на интерес исследователей к апоптозу, имеются единичные работы об изучении апоптотических процессов у коморбидных пациентов [6]. Между тем коморбидность является объектом пристального внимания исследователей, так как удельный вес больных с наличием одновременно нескольких заболеваний высок. Одной из основных причин этого является старение населения, ведь с возрастом закономерно накапливаются хронические заболевания, снижается функционирование физиологических систем организма и истощаются компенсаторные резервы [7].
Поскольку при ХОБЛ имеет место перманентная гипоксия, а некротическим процессам при ИБС: ИМ предшествует апоптоз, представляет интерес изучение апоптоза у коморбидных больных ИМ на фоне ХОБЛ.
Цель исследования – изучить апоптоз на основе определения удельного веса циркулирующих мононуклеаров у больных ИБС: инфарктом миокарда на фоне хронической обструктивной болезни легких.
Материалы и методы исследования
Основную группу составили 195 больных ИБС: ИМ на фоне ХОБЛ (ИМ+ХОБЛ), получавших стационарное лечение в Региональном сосудистом центре ГБУЗ АО АМОКБ (г. Астрахань) в 2016–2019 гг. В качестве группы сравнения выступили 130 больных ИМ без ХОБЛ, находившихся на лечении в том же отделении.
Диагноз ИМ и лечение пациентов осуществлялись в соответствии с Клиническими рекомендациями. Во всех случаях диагностирован ИМ I типа, у всех пациентов отмечалась острая стадия ИМ. Все больные ИБС: ИМ были среднего возраста (59,21±7,12 лет), преобладали лица мужского пола (89/41). Всем пациентам было выполнено коронарографическое обследование.
У всех больных ИМ на фоне ХОБЛ диагноз легочной патологии был установлен ранее в соответствии с Клиническими рекомендациями «GOLD». Во всех случаях течение ХОБЛ на момент обследования было стабильным. Продолжительность течения ХОБЛ составила 6 [4; 8] лет. На момент исследования доля курящих лиц составила 88,2 %. Индекс курения составил 35,85 [20; 50] пачка/лет. В данной группе было 189 мужчин и 6 женщин. Больные были сопоставимы по возрасту.
Все пациенты получали идентичную терапию по поводу ИМ, включавшую антиангинальные препараты, антикоагулянты, дезагреганты, β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, статины.
В группу контроля вошли 110 соматически здоровых лиц, сопоставимых по полу и возрасту.
Проведение данного исследования одобрено Региональным независимым этическим комитетом (от 18.01.2016, протокол № 12). Все обследованные подтвердили свое добровольное участие в исследовании документированным согласием.
Иммунологические исследования проводили на проточном цитофлуориметре «Navios» (Beckman Coulter, USA). Для выделения апоптотических клеток использовали набор ANNEXIN V-FITC/7 AAD (Beckman Coulter, USA). Выделение мононуклеаров периферической крови проводили на градиенте плотности «Фикол-гипак» с помощью центрифугирования (Pharmacia Fine Chemicals, Швеция). Статистическую обработку данных проводили с помощью программы SPSS 26.0. Во всех случаях имело место непараметрическое распределение количественных параметров, в связи с чем значения представлены в виде медианы (Ме) и интерквартильного размаха (Q1; Q3). Сопоставление количественных признаков в четырех группах наблюдения осуществлялось методом Краскела – Уоллиса.
Результаты исследования и их обсуждение
Данные, полученные в группах наблюдения, представлены в табл. 1.
Таблица 1
Содержание циркулирующих аннексин V мононуклеаров (%) в обследованных группах
|
Показатели |
Контроль (n = 110) |
Больные ИМ без ХОБЛ (n = 130) |
Больные ИМ+ХОБЛ (n = 195) |
|
Интактные клетки (аннексин V-/7AAD-), % |
97,8 [96,3–98,4] |
94,4 [93,0–95,6] p1 < 0,001 |
91,2 [84,6–94,5] p1 < 0,001 p2 < 0,001 |
|
Клетки с признаками апоптоза, % |
1,6 [1,2–2,5] |
5,0 [3,1–6,0] p1 < 0,001 |
7,5 [4,4–13,2] p1 < 0,001 p2 < 0,001 |
|
Ранняя стадия апоптоза (аннексин V+/7AAD-) |
1,5 [0,9–2,2] |
4,4 [3,0–5,4] p1 < 0,001 |
7,2 [4,0–11,8] p1 < 0,001 p2 < 0,001 |
|
Поздняя стадия апоптоза (аннексин V+/7AAD+) |
0,1 [0–0,4] |
0,4 [0,1–0,7] p1 < 0,001 |
0,7 [0,3–1,6] p1 < 0,001 p2 < 0,001 |
|
Погибшие клетки (аннексин V-/7AAD+), % |
0,5 [0,3–1,0] |
0,7 [0,3–1,1] p1 = 0,739 |
1,1 [0,6–1,6] p1 < 0,001 p2 < 0,001 |
Примечание. р – уровень статистической значимости; р1 – с группой соматически здоровых лиц; р2 – с больными ИМ без ХОБЛ.
Наиболее низкое содержание интактных клеток наблюдалось в группе больных ИБС: ИМ+ХОБЛ – 91,2 [84,6–94,5] %. Это было статистически значимо ниже (p < 0,001) по сравнению с таковым как в группе контроля, так и в группе больных ИБС: ИМ без ХОБЛ.
Количество клеток в раннем апоптозе у больных ИБС: ИМ без ХОБЛ составило 4,4 [3,0–5,4] %, что было статистически значимо выше, чем в контрольной группе (p < 0,001). Максимальная выраженность раннего апоптоза отмечалась у коморбидных пациентов – количество клеток в раннем апоптозе у них составило 7,2 [4,0–11,8] %, что было статистически значимо (p < 0,001) выше по сравнению с лицами контрольной группы и больными ИБС: ИМ без ХОБЛ.
Количество клеток в позднем апоптозе у больных ИМ без ХОБЛ составило 0,4 [0,1–0,7] %, что было статистически значимо выше (p < 0,001) по сравнению со значениями в группе контроля, где количество клеток в позднем апоптозе составило 0,1 [0–0,4] %, были значительно выше (p < 0,001). Наибольшее количество клеток в позднем апоптозе наблюдалось у коморбидных пациентов – оно составило 0,7 [0,3–1,6] %, превышая значения в контрольной группе (p < 0,001) и у больных ИБС: ИМ без ХОБЛ (p < 0,001).
Количество некротических клеток у лиц контрольной группы составило 0,5 [0,3–1,0] %. У больных ИБС: ИМ без ХОБЛ медиана количества некротических клеток составила 0,4 [0,1–0,7] %, что статистически значимо превышало данный показатель в группе контроля (p < 0,001). У больных ИБС: ИМ на фоне ХОБЛ отмечалось наибольшее количество некротических клеток – 1,1 [0,6–1,6] %, оно статистически значимо (p < 0,001) превышало данный показатель во всех остальных группах.
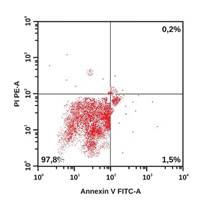
В качестве примера на рисунке приведены гистограммы, демонстрирующие особенности распределения апоптотических и жизнеспособных клеток у пациентов из групп наблюдения. Наглядно видно, что у больного с ИБС: ИМ без ХОБЛ удельный вес интактных клеток ниже, а клеток в раннем и позднем апоптозе – выше по сравнению с участником из группы контроля. У коморбидных больных ИБС: ИМ+ХОБЛ регистрируется наиболее низкий удельный вес интактных клеток и самый высокий удельный вес клеток в раннем и позднем апоптозе, а также некротизированных клеток.
|
|
|
|
Распределение апоптотических и жизнеспособных клеток в режиме DotPlot (двумерная гистограмма). По оси абсцисс – интенсивность флуоресценции аннексина V-FITC. По оси ординат – интенсивность флуоресценции 7 AAD. А – здоровый обследованный, Б – больной ИБС: ИМ без ХОБЛ, В – больной ИБС: ИМ+ХОБЛ
Для уточнения влияния на интенсивность апоптоза объема некротизированного миокарда больные с ИБС: ИМ были разделены на группы в зависимости от наличия зубца Q на ЭКГ (табл. 2).
Таблица 2
Содержание циркулирующих аннексин V мононуклеаров (%) у больных ИБС: ИМ без ХОБЛ и ИБС: ИМ+ХОБЛ с различной глубиной поражения миокарда
|
Показатели |
ИМ без ХОБЛ |
ИМ+ХОБЛ |
||
|
Не Q-ИМ (n = 29) |
Q-ИМ (n = 101) |
Не Q-ИМ (n = 49) |
Q-ИМ (n = 146) |
|
|
Интактные клетки (аннексин V-/7AAD-), % |
96,4 [95,7–97,1] p1 = 1,0 |
93,9 [92,6–95,1] p1 < 0,001 p2 < 0,001 |
93,8 [90,3–95,3] p1 < 0,001 p3 < 0,001 |
90,2 [84,1–94,1] p1 < 0,001 p2 = 0,024 p3 < 0,001 |
|
Клетки с признаками апоптоза, % |
2,9 [2,2–3,1] p1 = 0,66 |
5,2 [4,2–7,0] p1 < 0,001 p2 < 0,001 |
6,4 [3,2–9,9] p1 < 0,001 p3 < 0,001 |
8,8 [5,1–14,1] p1 < 0,001 p2 = 0,032 p3 < 0,001 |
|
Ранняя стадия апоптоза (аннексин V+/7AAD-) |
2,5 [2,0–3,0] p1 = 0,396 |
4,8 [3,7–5,7] p1 < 0,001 p2 < 0,001 |
6,1 [3,0–8,7] p1 < 0,001 p3 < 0,001 |
7,9 [4,2–12,2] p1 < 0,001 p2 = 0,093 p3 < 0,001 |
|
Поздняя стадия апоптоза (аннексин V+/7AAD+) |
0,2 [0–0,4] p1 = 1,0 |
0,5 [0,2–0,8] p1 < 0,001 p2 = 0,006 |
0,4 [0,2–0,5] p1 = 0,02 p3 = 0,145 |
1,0 [0,4–1,8] p1 < 0,001 p2 = 0,001 p3 = 0,002 |
|
Погибшие клетки (аннексин V-/7AAD+), % |
1,0 [0,8–1,4] p1 = 0,97 |
1,2 [0,9–1,8] p1 = 1,0 p2 = 1,0 |
1,5 [0,8–1,9] p1 = 0,053 p3 = 1,0 |
2,3 [1,4–3,6] p1 < 0,001 p2 = 0,843 p3 < 0,001 |
Примечание: р1 – уровень статистической значимости с группой соматически здоровых лиц;
р2 – уровень статистической значимости различий с больными не Q-ИМ в данной группе; р3 – уровень статистической значимости различий с соответствующей подгруппой больных ИМ без ХОБЛ.
Как следует из данных, представленных в табл. 2, уровень апоптоза циркулирующих мононуклеаров в нашем исследовании зависел от глубины поражения миокарда. Это проявилось уменьшением количества интактных клеток и увеличением клеток как на ранней, так и на поздней стадии апоптоза в подгруппах пациентов с зубцом Q на ЭКГ. Различий в содержании некротических клеток обнаружено не было.
Таким образом, было установлено, что повышенный апоптоз циркулирующих мононуклеаров отмечался как у больных с ИБС: ИМ без ХОБЛ, так и в группе коморбидных пациентов. Это проявлялось уменьшением количества интактных клеток, с одновременным увеличением апоптотических (как на стадии раннего, так и на стадии позднего апоптоза) и некротических клеток. Максимальная выраженность апоптотических процессов наблюдалась у больных ИБС: ИМ+ХОБЛ. При этом в обеих наблюдаемых группах интенсивность апоптоза была большей при Q-ИМ.
Полученные нами данные совпадают с результатами других исследований. Так, А.В. Наумовым (2021) был сделан вывод об интенсификации апоптоза у больных с кардиореспираторной коморбидностью и установлена зависимость содержания циркулирующих аннексин V мононуклеаров от глубины поражения миокарда и наличия осложнений ИМ [6].
В исследовании Е.В. Константиновой (2015) у больных с острым коронарным синдромом (ОКС) определялась интенсификация спонтанного апоптоза мононуклеарных клеток периферической крови [8]. Данные, полученные в группе больных ОКС, были сопоставимы с результатами в группе больных с атеротромботическим инсультом, что, по мнению авторов, подтверждает сходство механизмов реализации ишемического повреждения миокарда и головного мозга.
В работе Л.В. Васиной (2008) установлено достоверное увеличение в крови больных аннексин V+ -мононуклеаров, что свидетельствует об интенсификации у больных с ОКС противовоспалительных механизмов с целью повышения устойчивости клеточных мембран циркулирующих мононуклеаров к лизису [9].
А.И. Глухов с соавт. (2020) указывает, что именно апоптоз является основной формой гибели клеток миокарда на ранних стадиях ИМ. Активация апоптоза обусловлена воспалением, дисбалансом электролитов, гипоксией и ишемией [10]. Поддержание апоптотических процессов на высоком уровне не только снижает в дальнейшем сократительную способность миокарда, но и приводит к заместительному фиброзированию левого желудочка с его ремоделированием [11].
Л.Н. Хусаинова выявила интенсификацию клеточного апоптоза у больных с ОКС. Это способствует активации системы цитокинов с выработкой провоспалительных медиаторов и увеличению тромбогенного потенциала эндотелиоцитов [12].
Заключение
В нашем исследовании выявлен повышенный апоптоз циркулирующих мононуклеаров во всех группах наблюдения, кроме контрольной. Данный факт проявлялся уменьшением содержания здоровых и увеличением апоптотических (как на стадии раннего, так и на стадии позднего апоптоза) и некротических клеток. Наиболее демонстративными были изменения клеточных элементов на ранней стадии апоптоза, что открывает широкие возможности для своевременного выявления данного процесса. Максимальная выраженность апоптотических процессов наблюдалась у больных ИБС: ИМ+ХОБЛ. В обеих группах наблюдения интенсивность апоптоза была большей при Q-ИМ. Определение выраженности апоптоза у больных ИБС: ИМ+ХОБЛ важно с точки зрения патогенетического подхода к пониманию кардиореспираторной коморбидности.
Библиографическая ссылка
Прокофьева Т.В., Полунина О.С., Севостьянова И.В., Полунина Е.А. УДЕЛЬНЫЙ ВЕС ЦИРКУЛИРУЮЩИХ МОНОНУКЛЕАРОВ В РАННЕМ АПОПТОЗЕ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА (ИНФАРКТ МИОКАРДА) НА ФОНЕ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ // Современные проблемы науки и образования. 2023. № 3. ;URL: https://science-education.ru/ru/article/view?id=32578 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32578




 А
А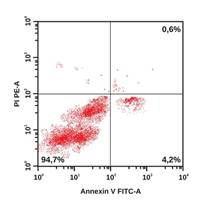 Б
Б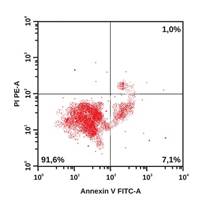 В
В