Первичные злокачественные опухоли печени занимают лидирующие позиции по распространенности и смертности в структуре онкологических заболеваний [1]. Наиболее распространенным типом первичного рака печени является гепатоцеллюлярная карцинома (ГЦК). Данная патология характеризуется высокой частотой рецидивов и метастазирования, низким коэффициентом полного выздоровления, который обусловлен поздним проявлением симптомов, высокой резистентностью к химио- и таргетной терапии [2]. Несмотря на прогресс в применении различных вариантов хирургических и консервативных методов лечения ГЦК, прогноз остается неблагоприятным, особенно на поздних стадиях заболевания. Как было установлено, лучшим вариантом химиотерапии для запущенных форм первичного рака печени является сорафениб, представляющий собой мультикиназный ингибитор, тем не менее даже применение этого препарата не способно продлить медиану времени до прогрессирования более чем на 3 месяца [3].
Таким образом, существует необходимость в проведении различных доклинических исследований для разработки новых терапевтических стратегий, улучшения диагностики и лечения опухолей печени. Наиболее часто используемыми для доклинических исследований тест-системами in vivo являются модели ксенографтов рака печени, созданные путем инъекции или имплантации человеческого опухолевого материала иммунодефицитным животным [4; 5].
Из литературных источников известны модель подкожной инъекции клеточных линий опухоли печени и модель подкожной трансплантации ГЦК в правый или левый бок иммунодефицитным мышам. Данные способы создания ксенографта имеют преимущество, которое состоит в удобстве мониторинга динамики роста опухолевого узла. Однако, согласно ряду исследований, подкожные гетеротопические модели не несут в себе тождественного отражения поведения опухоли печени, так как помещены в чужеродное микроокружение, кроме того, при подкожной имплантации клеток ГЦК редко возникают спонтанные метастазы, это является существенным недостатком указанной модели, что необходимо учитывать в случаях, когда объектом научного исследования является механизм метастазирования и связанные с ним возможные терапевтические мишени [6; 7].
Для преодоления этого недостатка были разработаны ортотопические модели, создание которых предполагает имплантацию или инъекцию опухолевого материала в соответствующий анатомический сайт. Существующие модели, основанные на инъекции опухолевых клеток ГЦК, а также на трансплантации фрагмента опухоли рака печени при помощи подшивания либо погружения опухолевого фрагмента в печени иммунодефицитных мышей, широко используются как в экспериментальных, так и доклинических исследованиях [8-10]. Но, несмотря на достаточно большое количество работ, выполненных с использованием данных моделей, нами не были найдены публикации, освещающие преимущества и недостатки различных методов создания ортотопических моделей рака печени.
В связи с этим целью нашей работы стало выполнение сравнительной оценки методов создания ортотопической модели первичного рака печени.
Материалы и методы исследования
Животные и их содержание
В ходе эксперимента использовали самцов мышей линии Balb/c Nude в возрасте 10-12 недель, средний вес которых составлял 27 г. Животные были получены из собственного разведения вивария Испытательного лабораторного центра ФГБУ «НМИЦ онкологии» Минздрава России. Мышей содержали в индивидуальных вентилируемых клетках, корм и вода были предоставлены без ограничений. Все манипуляции, проведенные в рамках исследования, были выполнены согласно этическим принципам, установленным Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETSN 123, Страсбург, 18 марта 1986 г). Протокол исследования был одобрен локальным биоэтическим комитетом ФГБУ «НМИЦ онкологии» Минздрава России.
Культура клеток
Клетки рака печени человека HepG2 культивировали согласно стандартной методике на флаконе Т75 в культуральной питательной среде DMEM (Gibco, Thermo Fisher Scientific), содержащей 10% телячьей сыворотки (Gibco, Thermo Fisher Scientific), 1% пенициллина и стрептомицина, вСО2 -инкубаторе (Thermo Fisher Scientific, 8000W) с влажной атмосферой при 37 ℃, 5% CO2.
Техника создания ортотопической модели ГЦК путем введения клеточной линии HepG2 в левую долю печени
Хирургические манипуляции проводили в стерильных условиях. По достижении необходимой глубины наркоза производили иссечение кожи и брюшной стенки по белой линии живота размером от 30 мм и обнажали левую долю печени. Опухолевую культуру клеток линии HepG2 в количестве 3 млн клеток в 50 мкл питательной среды DMEM без сыворотки и антибиотиков вводили стерильным, одноразовым инсулиновым шприцом в левую долю печени. По достижении гемостаза печень возвращали в брюшную полость согласно ее анатомическому положению. Брюшную стенку и кожу ушивали непрерывным хирургическим швом.
Техника создания ортотопической модели ГЦК путем трансплантации фрагмента опухоли в левую долю печени
Эксперимент проводили в стерильных условиях. Предварительно двум мышам вводили культуру клеток линии HepG2 в количестве 5 млн клеток в 200 мкл питательной среды DMEM без сыворотки и антибиотиков подкожно в правый бок. По достижении подкожными опухолями диаметра 1-1,5 см, животных эвтанизировали, опухолевые узлы извлекали и делили на маленькие фрагменты для последующей трансплантации в печень. По достижении необходимой глубины наркоза животным-реципиентам выполняли лапаротомию, с последующим смещением в каудальном направлении желудка и двенадцатиперстной кишки, для лучшего доступа к левой доле печени, в которой производили надрез. Стерильным анатомическим пинцетом произвели трансплантацию опухолевого фрагмента размером 1 мм3 в заданный сайт. Операционную рану ушивали непрерывным хирургическим швом.
Анестезия
Все хирургические вмешательства в данном эксперименте проводили с использованием внутримышечной инъекционной анестезии таких ветеринарных препаратов, как «Ксила» в дозе 20 мг/кг, «Золелил-100» в дозе 50 мг/кг.
Оценка роста опухолевых узлов
Измерение линейных размеров опухолевых узлов осуществляли в ходе диагностической лапаротомии при помощи штангенциркуля на 14-е сутки после проведения манипуляций. Определение объема опухолевого узла производили по формуле:
V=LW2/2,
где L, W, – линейные размеры опухоли.
Статистические данные
Полученные данные анализировали при помощи пакета программ Statistica 10.0. Данные представлены в виде среднего ± ошибка среднего.
Результаты исследования и их обсуждение
Моделирование рака печени осуществляли двумя способами: при помощи инъекции клеточной линии HepG2 в левую долю печени и трансплантации опухолевого фрагмента в левую долю печени (рисунок). В соответствии со способом трансплантации опухолевого материала животные были разделены на две группы, по 8 голов в каждой.
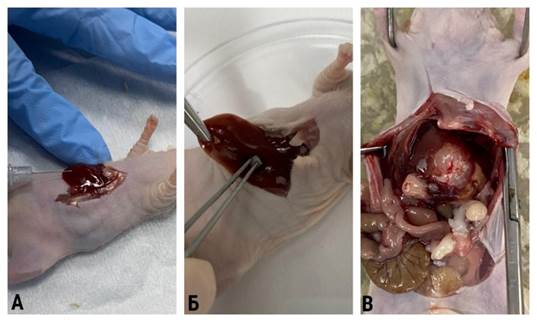
Способы создания ортотопической модели ГЦК. А - введение клеточной линии HepG2 в левую долю печени; Б – трансплантация опухолевого фрагмента в левую долю печени; В – образовавшийся на 14-й день после трансплантации опухолевый узел в левой доле печени
При применении инъекционного способа создания модели в процессе диагностической лапаротомии у 4 из 8 мышей были обнаружены опухолевые новообразования в печени, при этом только у 1 животного новообразование было сформировано в виде узла округлой формы в тканях левой доли печени. У остальных 3 животных ксенографты рака печени сформировались в различных анатомических зонах в виде вытянутых образований с неровными краями, что затрудняет измерение и сопоставление динамики роста по стандартным формулам. Можно предположить, что полученный неудовлетворительный результат связан с вытеканием клеточной суспензии через прокол, образовавшийся в результате инъекции, что приводит к формированию новообразований со сложными для измерения формами. Кроме того, клеточная суспензия, попадая в брюшную полость, способна образовывать опухолевые узлы в других органах и тканях животного. Также стоит отметить, что опухолевые клетки могут распределяться по всему объему доли печени, тем самым создавая вариабельность анатомического расположения опухолевого узла.
Инъекционный способ является достаточно распространенным методом создания ортотопической модели рака печени, в частности, он описан в работах по изучению влияния микроокружения на туморогенность клеточных линий [11], изучению иммунологических противоопухолевых препаратов [12] и новых химиотерапевтических агентов [13]. При этом формирование множественных опухолевых узлов или опухолей сложных форм при применении инъекционного способа было отмечено и описано в работе китайских исследователей, что, однако, авторы интерпретируют не как методологические особенности, а как характеристику, соответствующую той или иной клеточной линии [13]. В частности, авторы указали, что опухоли, полученные путем инъекции клеточной линии Hep3B, не ограничивались ростом только в инъецированных долях печени, но были обнаружены и в других долях (27%), а при имплантации клеток SK-HEP-1 и DLD-1 50% и 40% мышей имели более одного опухолевого узла в печени соответственно [13]. Также авторы отмечают наличие метастазов в брюшной полости в 31% случаев при использовании SK-HEP-1, что, однако, по нашему мнению, вероятно, может быть следствием непреднамеренного попадания клеточной суспензии в брюшную полость сразу после выполнения процедуры, а не результатом реализации механизма метастазирования из сформированного первичного опухолевого узла.
При создании ортотопической модели ГЦК путем трансплантации фрагмента опухоли в левую долю печени нами были получены следующие результаты. Проведение на 14-е сутки диагностической лапаротомии продемонстрировало 100% приживаемость трансплантируемого фрагмента в заданном сайте. Техника создания данной модели подверглась доработке с нашей стороны. Это было необходимо, так как при погружении фрагмента в созданный надрез ток крови не способствовал его фиксации, как указанно в некоторых источниках [10], а, наоборот, приводил к изменению местоположения трансплантируемого опухолевого фрагмента. Для предотвращения этого недостатка нами была предложена модификация способа трансплантации опухолевого фрагмента, заключающаяся в наложении гемостатической губки «Тахокомб», которая не только останавливала кровотечение, созданное в результате надреза в левые доли печени, но и гарантировала нахождение фрагмента опухоли в заданном сайте.
Результаты, отражающие все интересующие нас параметры, соответственно каждому из рассмотренных нами методов представлены в таблице.
Характеристика методов создания ортотопической модели ГЦК
|
Способ создания |
Инъекция клеточной линии HepG2 в левую долю печени |
Трансплантация опухолевого фрагмента в левую долю печени |
|
Количество животных в группе |
8 |
8 |
|
Количество прижившихся ксенографтов |
4/8 |
8/8 |
|
Расположение опухоли (кол-во животных с указанным расположением опухоли/общее кол-во животных) |
Ткани левой доли печени (1/8), Над левой долей печени (2/8) Между долями печени (1/8) Нет опухоли (4/8) |
Ткани левой доли печени (8/8) |
|
Средний объем ортотопических ксенографтов на 14-е сутки, мм3 |
118 ± 13,8 |
170,44±15,04 |
|
Выживаемость |
100% |
100% |
Стоит отметить, что метод трансплантации фрагмента опухоли для создания ортотопической модели рака печени в литературе встречается не так часто, как инъекционный метод, что, вероятно, связано с необходимостью выполнения дополнительного этапа создания подкожного опухолевого узла, фрагменты которого затем используют для трансплантации непосредственно в печень. Этот метод создания ортотопической модели рака печени применяли в работе по изучению неоваскулогенеза гепатоцеллюлярной карциномы, при этом авторы акцентируют внимание на характер развития опухолевых сосудов в динамике, оценивая их диаметр и плотность [14]. Авторы показали увеличение объема опухоли, объема и плотности опухолевых сосудов на 1-4-й неделе, при этом, несмотря на постоянное увеличение количества новых сосудов, скорость роста опухоли опережала скорость роста сосудов [14]. Продемонстрированные данные могут иметь ключевое значение при интерпретации результатов оценки эффективности противоопухолевых препаратов, механизм действия которых направлен на подавление ангиогенеза, при этом важно отметить, что выполнить подобного рода работу, используя инъекционный метод, по нашему мнению, было бы затруднительно в связи с тенденцией к формированию опухолевых образований сложных геометрических форм или множественных опухолевых узлов вследствие неравномерного распределения жидкой клеточной суспензии в тканях печени.
Заключение
Согласно литературным источникам, на сегодняшний день разработано большое количество методов создания ортотопической модели ГЦК, однако каждый из них имеет определенный ряд недостатков. В рамках нашего исследования подверглись сравнению 2 способа создания ортотопической модели рака печени - инъекционный и имплантационный. Согласно нашим данным, наиболее эффективным методом создания ортотопической модели ГЦК оказался имплантационный, который продемонстрировал 100% приживления трансплантируемого материала в заданный сайт, простоту выполнения манипуляции, хорошую выживаемость. Ортотопические модели, полученные при помощи имплантации фрагмента опухоли в печень лабораторным мышам, рекомендованы к использованию как для экспериментальных работ в области фундаментальной науки, так и для доклинических исследований новых препаратов для лечения ГЦК.
Библиографическая ссылка
Кечерюкова Т.М., Гурова С.В., Гончарова А.С., Максимов А.Ю., Галина А.В., Романова М.В., Ходакова Д.В., Колесников Е.Н., Гусарева М.А., Зинькович М.С., Шалашная Е.В. СРАВНИТЕЛЬНАЯ ОЦЕНКА МЕТОДОВ СОЗДАНИЯ ОРТОТОПИЧЕСКОЙ МОДЕЛИ РАКА ПЕЧЕНИ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32565 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/spno.32565



