Работа выполнена по Государственному заданию в рамках бюджетной темы «Эпидемиологический мониторинг состояния здоровья населения и изучение молекулярно-генетических и молекулярно-биологических механизмов развития распространенных терапевтических заболеваний в Сибири для совершенствования подходов к их диагностике, профилактике и лечению» (FWNR-2022-0024).
Исследования нового коронавирусного заболевания (COVID-19) часто показывают нарушение функции печени с повышением уровня трансаминаз. В некоторых случаях повышение уровня печеночных ферментов было более чем в три раза и отражало повреждение печени независимо от ранее существовавших заболеваний печени [1]. Вскрытия умерших пациентов с COVID-19 с биохимическими признаками гепатита в большинстве случаев выявили макровезикулярный стеатоз, дольковое некровоспаление и легкое портальное воспаление [2]. Возможный гепатотропизм вируса SARS-CoV-2, системная воспалительная реакция, гипоксическая ишемия – реперфузионное повреждение и прямое лекарственное воздействие являются основными причинами нарушения функции печени и ее повреждения во время заболевания COVID-19 [3; 4].
С начала пандемии COVID-19 существовали опасения, что ранее существовавшая хроническая диффузная патология печени (ДПП) может предрасполагать к неблагоприятным исходам после заражения SARS-CoV-2, особенно из-за совпадающих факторов риска тяжелой формы COVID-19 и ДПП, например, пожилого возраста, ожирения и сахарного диабета 2 типа. Кроме того, прогрессирующее заболевание печени связано с нарушением иммунной регуляции и коагулопатией, что может способствовать более тяжелому течению COVID-19 [5; 6]. Глобальное бремя ДПП огромно: циррозом печени страдают более 122 миллионов человек во всем мире, из которых 10 миллионов имеют декомпенсированное заболевание [7]. Поэтому первостепенное значение имеет понимание естественной истории COVID-19 у пациентов с ДПП различной этиологии и по всему спектру тяжести заболевания печени.
Влияние повреждения печени и основного заболевания печени на гепатотропизм SARS-CoV-2 остается неясным, и пока ни в одном исследовании специально не изучались гистологические изменения в печени, обнаруженные у пациентов с COVID-19 и ранее существовавшей ДПП. Однако ранние исследования в эпоху, предшествовавшую COVID-19, обнаружили более чем 30-кратное увеличение экспрессии ACE2 в печени пациентов с циррозом, вызванным вирусом гепатита С, по сравнению со здоровыми индивидуумами [8]. Кроме того, экспрессия мРНК ACE2 и TMPRSS2 в печени была повышена у неинфицированных пациентов с ожирением и неалкогольным стеатогепатитом [9]. Аналогичным образом, модели повреждения печени у грызунов с перевязкой желчных протоков были связаны с повышенной экспрессией и активностью ACE2 в печени параллельно с маркерами гипоксии [8-10]. Повреждение печени и воспаление могут усиливать гепатотропизм SARS-CoV-2 путем модуляции экспрессии вирусных рецепторов, при этом ACE2 идентифицируется как индуцируемый интерфероном ген в респираторном эпителии человека [11; 12]. В то время как тканеспецифические факторы, контролирующие инфекцию SARS-CoV-2, изучены недостаточно, растет признание роли дополнительных вспомогательных рецепторов в проникновении вируса. Было показано, что фагоцитарный рецептор липопротеинов высокой плотности B типа 1 (SR-B1) помогает облегчить ACE2-зависимое присоединение коронавируса in vitro [13], что напоминает инфекцию вирусом гепатита C [14]. Кроме того, лечение, нацеленное на SR-B1, уменьшало опосредованную липопротеинами активацию инфекции SARS-CoV-2 [13]. Таким образом, развитие коронавирусной инфекции на фоне диффузной патологии печени различного генеза может привести к ее прогрессированию.
Степень фиброза печени, темпы его прогрессирования следует считать ключевой рубрикой при верификации диагноза диффузной патологии печени, поскольку она определяет прогноз заболевания [15], независимо от этиологии процесса (действие алкоголя, вирусные гепатиты, аутоиммунные, метаболические, холестатические, лекарственные заболевания печени, более редкие наследственные патологии печени) [16]. В эпоху пандемии коронавирусной инфекции триггерами развития и прогрессирования фиброза печени могут быть гипоксия, возникновение цитокинового шторма, воздействие лекарственных препаратов, а таже непосредственное влияние SARS-CoV-2 на клетки гепатоцитов [1]. Углубленная протеомная оценка ткани печени пациентов с COVID-19 и сигнатуры печеночных белков указывали на повышенную регуляцию профибротических путей, нарушение регуляции окисления жирных кислот и окислительного фосфорилирования, а также на маркеры иммунной активации, что ассоциировано с фиброгенезом [17]. Оценка стадии фиброза печени принципиально важна для мониторинга прогрессирования хронического заболевания печени, оптимального времени начала лечения и оценки ответа на терапию [15; 16].
Цель исследования – изучить факторы, ассоциированные с фиброзом печени, в том числе с его прогрессированием, у пациентов, перенесших COVID-19.
Материалы и методы исследования
Обследован 431 пациент, перенесший COVID-19 (в сроки от 2 до 14 месяцев после перенесенного заболевания), обратившийся в поликлиническое отделение НИИ ТПМ – филиала ИЦиГ СО РАН в 2020-2021 гг. в связи с необходимостью проведения непрямой эластометрии печени. Диагноз COVID-19 предполагался верифицированным при наличии положительного результата лабораторного исследования на РНК SARS-CoV-2 (с применением методов амплификации нуклеиновых кислот) или антигена SARS-CoV- 2 (с применением иммунохроматографического анализа) вне зависимости от клинических проявлений [18] и/или антитела класса IgA, IgM и/или IgG у пациентов с клинически подтвержденной инфекцией COVID-19 [19]. Средний возраст обследуемых составил 52,38± 13,3 года, среди них оказалось 212 (49,2%) мужчин и 219 (50,8%) женщин.
При проведении непрямой эластометрии печени с помощью аппарата FibroScan® 502 (Echosens, Франция) для установления степени фиброза печени (в кПа) с разграничением стадии фиброза по шкале METAVIR от F0 до F4 [20] у 242 пациентов (56,1%) установлена нулевая степени фиброза (F0), у 81 больного (18,8%) – F1, в 45 случаях (10,4%) – F2, у 19 пациентов (4,4%) – F3, у 44 (10,2%) – F4. Для проведения анализа были исследованы две группы пациентов: с легким фиброзом (F0-1) – 323 человека (75%) и с выраженным фиброзом (F2-4) – 108 человек (25%). В группе пациентов с легким фиброзом мужчины составили 162 человека (50,2%), женщины 161 (49,8%), а в группе с выраженным фиброзом – 50 (46,3%) и 58 (53,7%) соответственно.
У пациентов проанализированы данные ранее проведенных обследований (в том числе биохимических с акцентом на печеночные пробы, липидный профиль), госпитализаций (в том числе в связи с коронавирусной инфекцией с данными о ее тяжести, проведенной терапии), учитывалась информация в случае верифицированного диагноза диффузной патологии печени. Проведено анкетирование пациентов по стилю потребления алкоголя (стаж, частота потребления, предпочитаемые алкогольные напитки, разовая, недельная доза в пересчете на чистый этанол).
В 59 случаях (средний возраст 55,2±10,6 года) у пациентов ретроспективно имелась информация о ранее проведенной непрямой эластометрии (за 1-1,5 года до перенесенной коронавирусной инфекции) с данными по степени фиброза. При оценке по изменению степени фиброза печени в динамике эти пациенты были разделены на 2 группы: первая группа – без отрицательной динамики степени фиброза после перенесенного COVID-19 (24 человека) и вторая – с отрицательной динамикой (35 человек). В данных группах отдельно проанализированы факторы, ассоциированные с прогрессией фиброза печени.
Исследование выполнено с одобрения Комитета биомедицинской этики Научно-исследовательского института терапии и профилактической медицины - филиала Федерального государственного бюджетного научного учреждения «Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук» (протокол № 23 от 26.05.2020 г.) Все пациенты подписали информированное согласие на участие в исследовании.
Статистическая обработка данных выполнена с использованием программы IBMSPSSStatistics (версия 26.0). Определялся характер распределения количественных признаков методом Колмогорова – Смирнова. В случае нормального распределения вычислялось среднее значение (М) и стандартное отклонение (SD) (M±SD). При сравнении двух нормально распределенных выборок использовался t-тест Стъюдента. При отсутствии нормального распределения вычислялись медиана (Me), 25 и 75% процентили (25%; 75%), достоверность различия показателей оценивали с помощью непараметрических критериев (U-критерий Манна - Уитни, Краскела - Уоллиса). Биохимические параметры в группах пациентов с различной степенью фиброза по характеру распределения отличались, поэтому в таблицах для единообразия представления материала показаны и средние величины со стандартным отклонением (M ± SD), и медиана с процентильным распределением Me (25%; 75%). Для оценки статистической значимости различий относительных показателей использован критерий χ² Пирсона. Связи между признаками оценивались вычислением коэффициента линейной корреляции Пирсона, для интервальных и порядковых переменных, не подчиняющихся нормальному распределению, ранговым коэффициентом корреляции Спирмена. Оценка ассоциаций признаков оценивалась с помощью множественного логистического регрессионного анализа, который выполнялся с соблюдением следующих условий: зависимая переменная дихотомическая: наличие/отсутствие выраженного фиброза печени; независимость наблюдений; отсутствие мультиколлинеарности, т.е. ситуаций, когда независимые переменные сильно коррелируют между собой (r>0,9); линейная зависимость между каждой независимой переменной и логарифмом отношения шансов (log odds); независимость остатков. Результаты множественного логистического регрессионного анализа представлены как отношение шансов (ОШ) и 95% доверительный интервал для ОШ. Во всех процедурах статистического анализа критический уровень значимости нулевой гипотезы (p) принимался равным 0,05.
Результаты исследования и их обсуждение
В таблице 1 представлены клинико-инструментальные показатели, анамнестические данные у пациентов, перенесших COVID-19, с различной степенью фиброза печени. Группы пациентов, перенесших COVID-19, с начальным и выраженным фиброзом не различались по полу, в группе с выраженным фиброзом пациенты были старше (56,31± 12,1 года против 51,06 ± 13,4 года, p<0,0001), имели больший индекс массы тела (ИМТ) (31,1± 6,81 кг/м2 против 27,9 ± 5,15 кг/м2 при легком фиброзе, p<0,0001). Эластичность печени в группе продвинутого фиброза составила 17,48±15,34 кПа против 4,8±2,9 кПа при легком фиброзе (p<0,0001). Пациенты с различными степенями фиброза различались по стилю потребления алкоголя: в группе с выраженным фиброзом преобладала большая частота потребления алкогольных напитков (в 79,5% случаях от одного до нескольких раз в неделю против 5,8% в группе с легким фиброзом, p<0,0001), установлены более высокие разовые (p<0,001) и недельные дозы (p<0,0001) потребляемого алкоголя. По тяжести перенесенной коронавирусной инфекции, проводимой антибактериальной, противовирусной терапии группы пациентов с разной степенью фиброза статистически значимо не различались между собой. Следует заметить, что в группе с выраженным фиброзом реже проводилось лечение гормональными препаратами во время заболевания COVID-19 (p=0,042).
Таблица 1
Клинико-инструментальные показатели, анамнестические данные у пациентов, перенесших COVID-19, с различной степенью фиброза печени (M±SD), абсолютное число (%)
|
Показатели |
Группа реконвалесцентов COVID-19, с легким фиброзом (F0-1), n=323 |
Группа реконвалесцентов COVID-19, с выраженным фиброзом (F2-4), n=108 |
р |
|
Пол (мужчины/женщины) (%) |
162 (50,2%)/161 (49,8%) |
50 (46,3%)/58 (53,7%) |
0,487 |
|
Возраст (лет) |
51,06±13,4 |
56,31±12,1 |
0,0001 |
|
Индекс массы тела (кг/м2) |
27,9±5,15 |
31,1±6,81 |
0,0001 |
|
Эластичность печени (кПа) |
4,8±2,9 |
17,48±15,34 |
0,0001 |
|
Стаж потребления алкоголя (лет) |
11,8±4,7
|
12,8±3,7
|
0,273 |
|
Разовая доза этанола (г) |
87,7±86,9
|
148,4±101,7
|
0,001 |
|
Недельная доза этанола (г) |
175,7±322,3
|
577,9±758,4
|
0,0001 |
|
Частота потребления алкоголя: - 3-5 раз в год - 1 раз в месяц - 2-3 раза в месяц - 1-2 раза в неделю - каждый день |
32 (26,4%) 53 (43,8%) 29 (24,0%) 7 (5,8%) 0 |
0 3 (7,7%) 5 (12,8%) 26 (66,7%) 5 (12,8%) |
0,0001 |
|
Тяжесть течения COVID-19: бессимптомно/ ОРВИ / пневмония |
8 (2,5%) / 168 (52,2%) / 146 (45,3%) |
3 (2,9%) / 53 (50,5%) / 49 (46,7%) |
0,943 |
|
% поражения легких при COVID-19-ассоциированной пневмонии |
30,48±17,2
|
34,04±21,48
|
0,357 |
|
ИВЛ во время лечения COVID-19 |
4 (2,8%) |
2 (4,4%) |
0,572 |
|
Лечение антибиотиками во время течения COVID-19 |
161 (54%) |
54 (58,1%) |
0,494 |
|
Лечение гормональными препаратами во время течения COVID-19 |
10 (66,7%) |
8 (33,3%) |
0,042 |
|
Лечение противовирусными препаратами во время течения COVID-19 |
30 (96,8%) |
28 (93,3%) |
0,534 |
В таблице 2 представлена частота верифицированной диффузной патологии печени различного генеза в группах реконвалесцентов COVID-19 с разной степенью фиброза. У пациентов с выраженным фиброзом статистически значимо чаще диагностированы хронический вирусный гепатит С (ХВГС) (p<0,0001), сочетание хронических вирусных гепатитов В и С (ХВГ (В+С) (p=0,018), сочетание хронического вирусного гепатита С с жировой болезнью печени (ХВГС+ЖБП) (p<0,0001), ВИЧ-инфекция (p=0,014), проявления метаболического синдрома (НАЖБП (p=0,011), СД 2 типа (p<0,0001), повышенный ИМТ (p<0,0001)). В группе с выраженным фиброзом чаще проводилась противовирусная терапии по поводу ВГС в предшествующие годы (p<0,0001). В группе пациентов с фиброзом 2-4 степени оказалось больше больных с аутоиммунным гепатитом (АИГ) (p=0,011), первичным билиарным холангитом (p<0,001), но меньше пациентов с синдром Жильбера (p=0,034). У 17 пациентов (15,7%) данной группы диагностирован цирроз печени, класс А и В по Чайлд-Пью.
Таблица 2
Частота диффузной патологии печени разного генеза у пациентов, перенесших COVID-19, с различной степенью фиброза печени, абсолютное число (%)
|
Показатели |
Группа реконвалесцентов COVID-19, с легким фиброзом (F0-1), n=323 |
Группа реконвалесцентов COVID-19, с выраженным фиброзом (F2-4), n=108 |
р |
|
Хронический вирусный гепатит В |
18 (5,6%) |
8 (7,4%) |
0,488 |
|
Хронический вирусный гепатит С |
43 (13,3%) |
32 (29,6%) |
0,0001 |
|
ХВГ (В + С) |
2 (0,6%) |
4 (3,7%) |
0,018 |
|
ХВГС + ЖБП |
14 (4,4%) |
18 (16,9%) |
0,0001 |
|
ХВГВ + ЖБП HBV + FLD |
8 (2,5%) |
4 (3,8%) |
0,495 |
|
Противовирусная терапия ХВГС в анамнезе |
15 (4,6%) |
17 (15,7%) |
0,0001 |
|
НАЖБП |
146 (45,2%) |
64 (59,3%) |
0,011 |
|
Сахарный диабет 2 типа |
14 (4,3%) |
19 (17,6%) |
0,0001 |
|
Регулярное потребление алкоголя |
121 (37,5%) |
39 (36,1%) |
0,801 |
|
ВИЧ |
0 (0 %) |
2 (1,9%) |
0,014 |
|
Синдром Жильбера |
13 (4%) |
0 (0%) |
0,034 |
|
Гемохроматоз |
3 (0,9%) |
1 (0,9%) |
0,998 |
|
Аутоиммунный гепатит |
1 (0,3%) |
3 (2,8%) |
0,021 |
|
Лекарственный гепатит |
10 (3,1%) |
5 (4,6%) |
0,452 |
|
Первичный билиарный холангит |
0 (0 %) |
4 (3,7%) |
0,001 |
|
Цирроз печени |
0 (0 %) |
17 (15,7%) |
0,0001 |
Анализ корреляций степени фиброза печени с клинико-инструментальными, диагностическими показателями в общей группе реконвалесцентов COVID-19 выявил прямые статистически значимые ассоциации с возрастом пациентов (r=0,207, p<0,0001), проявлениями метаболического синдрома (повышенным индексом массы тела (r=0,243, p<0,0001), сахарным диабетом 2 типа (r=0,209, p<0,0001), неалкогольной жировой болезнью печени (r=0,144, p=0,003) (рис.). Среди показателей, отражающих стиль потребления алкоголя, установлены связи степени фиброза печени лишь с величиной разовой (r=0,282, p<0,0001) и недельной дозы потребляемого этанола (r=0,317, p<0,0001) и в виде тенденции – со стажем потребления алкогольных напитков (r=0,138, p=0,099). Следует отметить корреляции степени фиброза печени с наличием хронического вирусного гепатита С как отдельной патологии (r=0,223, p<0,0001), так и в сочетании с другими заболеваниями – ХВГ (В+С) (r=0,132, p=0,006), ХВГС+ЖБП (r=0,212, p<0,0001), ХВГС+ВИЧ (r=0,113, p=0,02), а также проведенной противовирусной терапией в анамнезе (r=0,194, p<0,0001). Среди других патологий статистически значимыми оказались ассоциации степени фиброза печени с наличием ВИЧ с проводимой противовирусной терапией (r=0,106, p=0,027), аутоиммунного гепатита (r=0,105, p=0,029), первичного билиарного холангита (r=0,169, p<0,0001). Закономерны выявленные корреляции степени фиброза печени с верифицированным циррозом печени (r=0,428, p<0,0001), варикозным расширением вен пищевода (r=0,162, p<0,001). Установлены обратные связи степени фиброза с наличием у пациентов синдрома Жильбера (r=-0,129, p=0,007), терапией гормональными средствами во время лечения COVID-19 (r=-0,384, p=0,016).
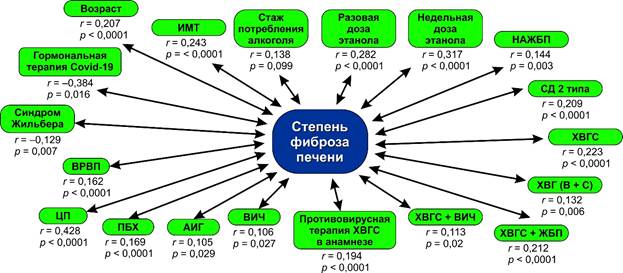
Корреляции степени фиброза печени с клинико-диагностическими показателями у реконвалесцентов COVID-19 (общая группа, n=431)
В группе с выраженным фиброзом (F2-4) выявлены ассоциации степени фиброза с полом - мужской пол прямо коррелировал со степенью фиброза (r=0,275, p=0,004). Только в группе с продвинутым фиброзом установлены связи степени фиброза со всеми показателями потребления алкоголя: регулярным потреблением алкоголя (r=0,262, p=0,006), стажем (r=0,392, p=0,018), частотой потребления (r=0,401, p=0,03), разовой (r=0,488, p=0,002), недельной дозой этанола (r=0,555, p<0,0001). Сила и высокая достоверность вышеописанных корреляций свидетельствует о высокой статистической значимости стиля потребления алкоголя для случаев с выраженным фиброзом реконвалесцентов COVID-19.
Далее мы провели бинарный логистический регрессионный анализ для ассоциации факторов риска с шансом наличия выраженного фиброза печени у реконвалесцентов COVID-19. В модель в качестве зависимой переменной включали наличие/отсутствие выраженного фиброза печени, а в качестве ковариат: возраст, пол, ИМТ, СД 2 типа, ХВГС + ЖБП, недельная доза этанола. Проведенный логистический регрессионный анализ выявил, что шанс наличия выраженного фиброза печени был прямо и независимо от других факторов ассоциирован с ИМТ, СД 2 типа, ХВГС + ЖБП, недельной дозой потребляемого алкоголя (табл. 3).
Таблица 3
Результаты логистического регрессионного анализа
|
Показатели |
ОШ |
95% доверительный интервал (ДИ) |
p |
|
|
нижняя граница |
верхняя граница |
|||
|
Возраст, год |
1,038 |
0,998 |
1,080 |
0,065 |
|
ИМТ, кг/м2 |
1,108 |
1,022 |
1,201 |
0,013 |
|
Пол, жен. vs муж. |
1,438 |
0,505 |
4,100 |
0,496 |
|
СД 2 типа, наличие vs отсутствие |
9,154 |
1,932 |
43,368 |
0,005 |
|
ХВГС + ЖБП, наличие vs отсутствие |
4,434 |
1,205 |
16,318 |
0,025 |
|
Недельная доза этанола, г |
1,002 |
1,001 |
1,003 |
0,0001 |
У пациентов, перенесших коронавирусную инфекцию, с разными степенями фиброза проанализированы биохимические показатели (табл. 4).
Таблица 4
Биохимические показатели у реконвалесцентов COVID-19 с разной степенью фиброза печени (M ± SD), Me (25%; 75%)
|
Показатели
|
Группа реконвалесцентов COVID-19, с легким фиброзом (F0-1), n=323 |
Группа реконвалесцентов COVID-19, с выраженным фиброзом (F2-4), n=108 |
p |
|
Глюкоза крови натощак, ммоль/л |
6,28 ± 1,4 6 [5,6; 6,65] |
7,75 ± 2,7 6,7 [5,7; 9] |
0,002 |
|
АЛТ, Ед/л |
24,7 ± 17,7 20 [14; 29,5] |
35,4 ± 14,5 30 [26; 44] |
0,0009 |
|
АСТ, Ед/л
|
23,35 ± 13,7 20 [17; 26] |
32,5 ± 7,8 28 [24; 41] |
0,0001 |
|
ГГТП, Ед/л
|
36,11 ± 28,5 26 [20; 42] |
48,1 ± 25,4 46 [39; 53] |
0,01 |
|
ЩФ, Ед/л
|
177,2 ± 51,6 167 [143; 199,5] |
204,1 ± 43,9 191 [176; 223] |
0,004 |
|
Общий билирубин, мкмоль/л |
12,71 ± 7,55 11,2 [8,45; 14,9] |
28,7 ± 11,4 24 [21; 32] |
0,00001 |
|
Прямой билирубин, мкмоль/л |
4,5 ± 1,3 4,1 [3,5; 4,9] |
8,1 ± 1,9 7,3 [6,5; 9,1] |
0,002 |
|
Общий белок, г/л
|
74,7 ± 8,66 74 [70; 78] |
65,1 ± 4,42 64 [60; 69] |
0,0005 |
|
Альбумин, г/л
|
43,4 ± 11,6 40,2 [39,5; 45,8] |
39,2 ± 10,4 37,7 [36,1; 40,7] |
0,048 |
|
Общий холестерин, мг/дл |
218,0 ± 99,3 206 [178,2; 240,2] |
208,6 ± 64,2 203 [164,5; 240,7] |
0,560 |
|
Холестерин ЛПВП, мг/дл |
53,1 ± 17 51,5 [41,1; 63,5] |
41,8 ± 13,7 36,5 [32,1; 46,9] |
0,0001 |
|
Триглицериды, мг/дл
|
140,4 ± 89,6 119,4 [82,8; 172,7] |
205,3 ± 153,8 157,6 [101,7; 264,2] |
0,007 |
|
Мочевая кислота, мг/дл
|
351,5 ± 90,4 348 [285,5; 412] |
389,8 ± 94,4 374 [325; 458] |
0,038 |
|
Креатинин, мкмоль/л
|
84,7 ± 15,9 83 [73; 94,5] |
83,3 ± 14,3 81 [75; 89] |
0,523 |
|
Мочевина, ммоль/л
|
5,54 ± 1,78 5,4 [4,35; 6,45] |
5,88 ± 1,52 5,9 [4,7; 6,9] |
0,199 |
|
Железо сыворотки, мкмоль/л |
16,7 ± 14,9 |
27,5 ± 11,2 |
0,003 |
В группе с выраженным фиброзом оказались статистически значимо выше, чем у пациентов с легким фиброзом, показатели, отражающие синдром цитолиза [21]: повышение активности трансаминаз (для АЛТ p=0,0009; для АСТ p<0,0001), гипербилирубинемия с повышением преимущественно прямой фракции (для общего билирубина p<0,00001; для прямого билирубина p=0,002), повышение в сыворотке концентрации железа (p=0,003). У пациентов с продвинутым фиброзом печени были повышены активности ферментов, отражающих синдром холестаза [21]: щелочной фосфатазы (p=0,004), гамма-глутамилтранспептидазы (p<0,01). Синдром печеночно-клеточной недостаточности со снижением синтетической, метаболизирующей функций печени [21] (уменьшение содержания в сыворотке крови общего белка (p=0,0005), альбуминов (p=0,048), холестерина ЛПВП (p<0,0001)) также выявлен в группе со степенью фиброза F2-4. Проявления метаболического синдрома среди пациентов с выраженным фиброзом ассоциированы с более высокими уровнями глюкозы натощак (p=0,002), триглицеридов (p=0,007), мочевой кислоты (p=0,038), чем у пациентов с легким фиброзом.
Известно, что на величину эластичности печени при исследовании методом непрямой эластометрии могут повлиять повышенные активности трансаминаз, ферментов, отражающих синдром холестаза, уровня билирубина, а также повышенные уровни тяжелых металлов (железо, медь) [15]. Установлены ассоциации между значениями эластичности печени (в кПа) и активностью АЛТ (r=0,161, p=0,009), АСТ (r=0,171, p=0,005), ГГТП (r=0,208, p<0,001), ЩФ (r=0,197, p<0,001), общего билирубина (r=0,242, p=0,0002), сывороточного железа (r=0,252, p<0,0001). Таким образом, измененные печеночные пробы могли повлиять на значения эластичности печени у реконвалесцентов COVID-19.
Отдельно были проанализированы пациенты, перенесшие COVID-19, у которых ретроспективно оказались доступны данные по степени фиброза печени до заболевания коронавирусной инфекцией в течение 1-1,5 лет. У этих пациентов удалось оценить динамику развития фиброза печени на фоне COVID-19. Из 59 человек у 24 пациентов не отмечено развития отрицательной динамики по степени фиброза печени (1 группа), в 35 случаях отмечено прогрессирование фиброза (2 группа). Клинико-инструментальные показатели, анамнестические данные по реконвалесцентам COVID-19, обследованным в динамике, представлены в таблице 5. Значения эластичности печени (в кПа) были достоверно выше во второй группе по сравнению с первой (p=0,009). Пациенты статистически значимо не различались по полу, возрасту, индексу массы тела, тяжести перенесенной коронавирусной инфекции, проведенной антибактериальной, противовирусной, гормональной терапии, большей части показателей, отражающих стиль потребления алкоголя. Вместе с тем в группе с отрицательной динамикой по степени фиброза преобладали лица с высокой частотой потребления алкоголя (более 1 раза в неделю), составившие 62,8% против 4,1% в группе без отрицательной динамики по фиброзу печени (p=0,003).
Таблица 5
Клинико-инструментальные показатели у пациентов, перенесших COVID-19, обследованных в динамике (M±SD), абсолютное число (%)
|
Показатели |
Группа реконвалесцентов COVID-19, без отрицательной динамики по степени фиброза печени, n=24 |
Группа реконвалесцентов COVID-19, с отрицательной динамикой по степени фиброза печени, n=35 |
р |
|
Пол (мужчины/женщины) (%) |
14 (58,3%)/10 (41,7%) |
17 (48,6%)/18 (51,4%) |
0,461 |
|
Возраст (лет) |
53,63±10,8 |
56,26±10,4 |
0,351 |
|
Индекс массы тела (кг/м2) |
27,9±4,8 |
29,6±6,4 |
0,311 |
|
Эластичность печени (кПа) |
6,62±4,2 |
11,98±9,0 |
0,009 |
|
Стаж потребления алкоголя (лет) |
12,9±3,6 |
12,3±5,6 |
0,742 |
|
Разовая доза этанола (г) |
116,1±136,2 |
130,9±112 |
0,740 |
|
Недельная доза этанола (г) |
321,5±754,3 |
494,5±776 |
0,540 |
|
Частота потребления алкоголя: - 3-5 раз в год - 1 раз в месяц - 2-3 раза в месяц - 1-2 раза в неделю - каждый день |
4 (16,7%) 7 (29,2%) 12 (50,0%) 1 (4,1%) 0 |
0 1 (2,9%) 12 (34,3%) 18 (51,4%) 4 (11,4%) |
0,003 |
|
Тяжесть течения COVID-19: бессимптомно/ ОРВИ / пневмония |
2 (8,3%) / 16 (66,7%) / 6 (25,0%) |
2 (5,9%) / 19 (55,9%) / 13 (38,2%) |
0,564 |
|
% поражения легких при COVID-19-ассоциированной пневмонии |
28,0±7,5
|
32,78±21,8
|
0,618 |
|
Лечение антибиотиками во время течения COVID-19 |
10 (45,5%) |
16 (48,5%) |
0,825 |
|
Лечение гормональными препаратами во время течения COVID-19 |
3 (25%) |
6 (37,5%) |
0,483 |
|
Лечение противовирусными препаратами во время течения COVID-19 |
7 (77,8%) |
10 (90,9%) |
0,413 |
В группе с отрицательной динамикой по степени фиброза коронавирусная инфекция статистически значимо чаще протекала на фоне хронических вирусных гепатитов – ХВГВ (p<0,05), ХВГС (p<0,05), их сочетания с жировой болезнью печени – ХВГВ + ЖБП (p<0,05), ХВГС + ЖБП (p=0,043), сахарного диабета 2 типа (p<0,05), аутоиммунного гепатита (p=0,021) (табл. 6).
Таблица 6
Частота диффузной патологии печени разного генеза у пациентов, перенесших COVID-19, обследованных в динамике, абсолютное число (%)
|
Показатели |
Группа реконвалесцентов COVID-19, без отрицательной динамики по степени фиброза печени, n=24 |
Группа реконвалесцентов COVID-19, с отрицательной динамикой по степени фиброза печени, n=35 |
р |
|
Хронический вирусный гепатит В |
0 (0%) |
5 (14,3%) |
0,05 |
|
Хронический вирусный гепатит С |
9 (37,5%) |
16 (45,7%) |
0,05 |
|
ХВГ (В + С) |
0 (0%) |
1 (2,9%) |
0,404 |
|
ХВГС + ЖБП |
2 (8,3%) |
13 (37,2%) |
0,043 |
|
ХВГВ + ЖБП |
0 (0%) |
5 (14,3%) |
0,05 |
|
Противовирусная терапия ХВГС в анамнезе |
7 (29,2%) |
7 (20%) |
0,416 |
|
НАЖБП |
13 (54,2%) |
18 (51,4%) |
0,836 |
|
Сахарный диабет 2 типа |
2 (8,3%) |
7 (20,0%) |
0,05 |
|
Регулярное потребление алкоголя |
12 (50%) |
17 (48,6%) |
0,914 |
|
Синдром Жильбера |
1 (4,2%) |
0 (0%) |
0,223 |
|
Гемохроматоз |
0 (0%) |
1 (2,9%) |
0,404 |
|
Аутоиммунный гепатит |
1 (0,3%) |
3 (2,8%) |
0,021 |
|
Лекарственный гепатит |
0 (0%) |
1 (2,9%) |
0,404 |
|
Первичный билиарный холангит |
0 (0%) |
1 (2,9%) |
0,404 |
|
Цирроз печени |
2 (8,3%) |
3 (8,6%) |
0,974 |
Данные проведенных исследований доказывают, что этиология заболевания печени, предшествующего коронавирусной инфекции, может повлиять на клинический исход при COVID-19 и прогрессирование фиброза печени. По данным Williamson E.J. et al., в общей популяции пожилой возраст, ожирение и сахарный диабет 2 типа являются факторами риска заболеваемости и смертности от COVID-19 [22]; однако в этом исследовании не была верифицирована НАЖБП и не оценивалось потребление алкоголя. Следует отметить, что сахарный диабет 2 типа рассматривается как независимый фактор риска развития фиброза печени [23]. В литературе существует множество несоответствий относительно влияния НАЖБП на течение COVID-19. Это может быть связано с трудностями в отделении эффекта НАЖБП от других метаболических сопутствующих заболеваний (в том числе от стеатоза, вызванного вирусом) или из-за различий в диагностических критериях. Последнее имеет особое значение в настоящее время, поскольку мировое сообщество гепатологов дискутирует о предлагаемых изменениях определения с «НАЖБП» на «жировую болезнь печени, связанную с метаболической дисфункцией (МАЖБП)» [24]. Ретроспективное исследование, включавшее 202 пациента с инфекцией SARS-CoV-2, выявило НАЖБП как фактор риска прогрессирования COVID-19, аномальных уровней печеночных ферментов, повышенной эластичности печени и более длительного времени выделения вируса [25]. Другое исследование с участием 327 пациентов показало взаимосвязь между НАЖБП и риском тяжелого течения COVID-19 у пациентов в возрасте до 60 лет [26]. Данные МРТ 287 пациентов, протестированных на SARS-CoV-2 (79 положительных, 208 отрицательных), показали, что у лиц с ожирением и сопутствующей жировой фракцией печени ≥10% в три раза повышен риск развития симптоматического лабораторно подтвержденного COVID-19 [27]. Однако в исследовании с включением 155 стационарных пациентов с COVID-19 наличие стеатоза (у 43%) не было независимо связано со смертностью [28]. Эти результаты были подтверждены на более крупной международной когорте из 745 пациентов с ДПП и циррозом печени из 29 стран, собранных с использованием реестров SECURE-Cirrhosis и COVID-Hep, в которых отношение шансов смерти для пациентов с НАЖБП составило 1,01 (95% ДИ 0,57–1,79) [29]. В этом же исследовании заболевание печени, связанное с алкоголем, оказалось единственной этиологией ДПП со значительным коэффициентом вероятности смерти и прогрессированием фиброза печени (1,79, 95% ДИ 1,03–3,13) [29]. Регистрационные данные для 70 пациентов с аутоиммунным гепатитом и инфекцией SARS-CoV-2 также показали эквивалентные результаты по исходам для пациентов с ДПП другой этиологии и с контрольной группой, несмотря на использование базовой иммуносупрессии в 86% случаев [30].
Выявленные ассоциации отрицательной динамики фиброза печени и наличия хронического вирусного гепатита В, возможно, обусловлены реактивацией вируса на фоне перенесенной инфекция SARS-CoV-2, что показано в ретроспективном исследовании Liu J. et al. [31]. Хотя, по данным Chen L. et al., Rentao Yu et al., коинфекция ВГВ не повлияла на течение и прогноз COVID-19 [32; 33]. ВГВ может вызывать «иммунное истощение», при котором стимулированные Т-клетки не дают такого сильного цитокинового ответа на инфекцию SARS-COV-2, что приводит к менее тяжелому течению заболевания [34]. Следует отметить, что в большей части исследований проводился анализ состояния пациентов в период пребывания в стационаре без последующего наблюдения в постковидный период, что значимо для выявления динамики по степени фиброза печени.
В настоящем исследовании установлены статистически значимые корреляции степени фиброза печени, его отрицательной динамики с хроническим вирусным гепатитом С, а также его сочетанием с ХВГВ, НАЖБП, ВИЧ. Рядом авторов показано влияние ХВГС на течение коронавирусной инфекции. По данным Cerbu B. et al., доля тяжелых случаев COVID-19 в группе пациентов с активным ХВГС была значительно выше по сравнению с неактивным (32,2 против 7,3%, p < 0.001). Также было показано, что продолжительность пребывания в больнице и отделении интенсивной терапии по поводу COVID-19 была статистически значимо выше у пациентов с активной инфекцией HCV [35]. Можно предположить, что вирус SARS-CoV-2 является триггером фиброгенеза у пациентов с хроническим вирусным гепатитом С, поскольку оба вируса имеют сходные патогенетические механизмы - нарушение взаимодействия иммунных клеток с инфицированными вирусами гепатоцитами: повреждение печеночной ткани в большей степени является результатом реализации иммунного ответа в очаге воспаления, а не цитопатического действия вируса [36].Среди факторов хозяина, влияющих на исход, прогрессирование фиброза, течение ХВГС, как и при COVID-19, имеют значение возраст на момент инфицирования, злоупотребление алкоголем, коинфицирование гепатотропными вирусами, нарушения липидного обмена и др. [37; 38].
В нашей работе не отмечено различий по величине эластичности печени у пациентов с циррозом при сравнении в динамике. Возможно, это связано с небольшим количеством пациентов и недостаточными сроками наблюдения. Влияние цирроза на течение COVID‑19 еще до конца не известно. Выявлено, что цирроз печени связан с повышенной смертностью у пациентов с острым респираторным дистресс-синдромом [39]. Известно, что уровень АСЕ2 повышается (97-кратное увеличение в паренхиме) при циррозе печени [40]. Поэтому пациенты с циррозом могут быть более уязвимы к инфекции SARS-CoV‑2.
Marjot T. et al. отметили утяжеление цирроза печени с нарастанием степени фиброза, класса декомпенсации по Чайлд-Пью, повышение риска смертности у пациентов, перенесших коронавирусную инфекцию [29]. Однако, по мнению Bajaj J.S. et al., после острого инфекционного периода инфекция SARS-CoV-2 не ускоряет прогрессирование цирроза печени при наблюдении за пациентами в течение 90 дней [41]. Вместе с тем авторы не исключают, что сроки постковидного периода недостаточны для окончательных выводов. Известно, что цирроз печени связан с увеличением исходной эндотоксемии и продукции цитокинов, что может привести к усиленной воспалительной реакции, фиброгенезу в условиях инфекции SARS-CoV-2. Этот аспект может быть особенно серьезным у пациентов с заболеванием печени, вызванным алкоголем [42], что потенциально объясняет повышенную смертность в этой группе [29]. Также было показано, что состав кишечной микробиоты играет роль в регулировании степени тяжести COVID-19, возможно, посредством модуляции иммунных реакций хозяина [43]. Учитывая, что цирроз характеризуется изменениями состава и функции кишечной микробиоты наряду с повышенной проницаемостью кишечника [44], возможно, что изменения в оси «кишечник – печень» могут способствовать тяжелому течению COVID-19, наблюдаемому в этой группе пациентов. Учитывая коагулопатию, связанную как с циррозом, так и с COVID-19, сосуществование этих состояний может привести к кумулятивному риску тромботических осложнений, тканевой гипоксии, являющейся фактором прогрессирования фиброза [45].
Хотя точное влияние COVID-19 на печень остается неясным, изменения печеночных проб часто отмечаются у пациентов, перенесших COVID-19, встречаясь примерно у 15-65% лиц, инфицированных SARS-CoV-2 [46-50]. Широкий диапазон этих зарегистрированных частот может быть объяснен различными определениями верхней границы нормы, разным перечнем анализируемых лабораторных показателей, географическими различиями в распространенности и нозологической форме основного диффузного заболевания печени [46]. Биохимические нарушения при COVID-19 обычно характеризуются умеренным (в 1-2 раза превышающим верхнюю границу нормы) повышением активностей сывороточных аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), о которых сообщается у 29-39% и 38-63% пациентов соответственно [46-50]. Отмечено, что гипоальбуминемия, неспецифический маркер тяжести заболевания, ассоциируется с худшими исходами COVID-19 [47], но тяжелое повреждение печени, повышение уровня билирубина в сыворотке крови и синтетическая дисфункция печени нечасты у пациентов, инфицированных SARS-CoV-2 [48-50]. По данным Singh S. et al., изменения печеночных проб регистрируются с одинаковой частотой, независимо от наличия ранее существовавшего заболевания печени [48]. Однако, по мнению Youssef M., Hundt M.A. et al., отклонения биохимических показателей отмечены чаще у реконвалесцентов COVID-19 с диффузной патологией печени различного генеза [49]. Многие исследователи считают, что в большинстве случаев воздействие на биохимические показатели, вероятно, является многофакторным с потенциальным вкладом иммуноопосредованной воспалительной реакции, вследствие лекарственных препаратов, повреждения печени, застойных явлений в печени и внепеченочного высвобождения трансаминаз, а также возможного прямого инфицирования гепатоцитов [49; 50]. Было высказано предположение, что прогностическая значимость повышенных уровней печеночных ферментов у реконвалесцентов COVID-19 может быть обусловлена более сильным ответом хозяина на SARS-CoV-2 и более агрессивной терапией у лиц с тяжелым диффузным заболеванием печени [47]. По данным Xiang F. et al., раннее повышение сывороточного индекса, отражающего степень фиброза – FIB-4, у пациентов, перенесших коронавирусную инфекцию, ассоциировано с неблагоприятными исходами [50].
Настоящее исследование имеет ряд ограничений: небольшое число пациентов, перенесших COVID-19, особенно с ретроспективными данными по степени фиброза; недостаточные сроки наблюдения в постковидном периоде для выводов по степени фиброза; необходимость подтверждения степени фиброза другими методами, в том числе сывороточными тестами. Тем не менее полученные результаты следует считать перспективными с точки зрения длительного проспективного наблюдения за этими пациентами и получения информации о динамике степени фиброза в отдаленном постковидном периоде.
Заключение
Таким образом, у реконвалесцентов COVID-19 наличие выраженного фиброза печени (F2-4) и его прогрессирование ассоциировано с высокой частотой потребления алкоголя – более 1 раза в неделю (p=0,003), наличием у пациентов хронических вирусных гепатитов В и С (p<0,05), в том числе в сочетании с жировой болезнью печени (p<0,043-0,05), сахарного диабета 2 типа (p<0,05), аутоиммунного гепатита (p=0,021).
Установлены корреляции выраженного фиброза у пациентов, перенесших коронавирусную инфекцию, со стилем потребления алкоголя: стажем (r=0,392, p=0,018), частотой потребления алкоголя (r=0,401, p=0,03), разовой (r=0,488, p=0,002) и недельной дозами этанола (r=0,555, p<0,0001). В группе с F2-4 реже проводилось лечение гормональными препаратами во время заболевания коронавирусной инфекцией (r=-0,384, p=0,016).
У пациентов, перенесших COVID-19, с выраженным фиброзом выявлены изменения в уровнях биохимических показателей, отражающих синдром цитолиза, холестаза, печеночно-клеточной недостаточности. Выявленные ассоциации значений эластичности печени с активностью АЛТ (r=0,161, p=0,009), АСТ (r=0,171, p=0,005), ГГТП (r=0,208, p<0,001), ЩФ (r=0,197, p<0,001), общего билирубина (r=0,242, p=0,0002), железа сыворотки крови (r=0,252, p<0,0001) косвенно свидетельствуют о возможном влиянии этих факторов на степень фиброза у пациентов, перенесших COVID-19.
Библиографическая ссылка
Кручинина М.В., Першина Н.Е., Щербакова Л.В., Логвиненко И.И., Кручинина Э.В. ФАКТОРЫ, АССОЦИИРОВАННЫЕ С ФИБРОЗОМ ПЕЧЕНИ, У ПАЦИЕНТОВ, ПЕРЕНЕСШИХ КОРОНАВИРУСНУЮ ИНФЕКЦИЮ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32549 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/spno.32549



