Примерно в 80% случаев острый панкреатит (ОП) протекает в легкой отечной форме, и пациенты могут быть выписаны всего через несколько дней [1, 2].Однако примерно у 20% пациентов развивается панкреонекроз, который характеризуется ранними или отсроченными системными и местными, включая гнойно-септические, осложнениями [3, 4].При тяжелом ОП смертность может достигать 50–80% наблюдений, что контрастирует с общей смертностью от 2% до 5% для всех форм ОП [5, 6].
При верификации холелитиаза и повышения аланинаминотрансферазы в течение первых 48 часов заболевания у пациентов с тяжелым течением ОП следует заподозрить билиарный панкреонекроз (БПН), при котором все чаще прибегают к интервенционным технологиям [7, 8]. Эндоскопические и минимально инвазивные процедуры постепенно завоевывают популярность и широкое распространение в лечении БПН, что дает хорошие результаты с точки зрения безопасности и снижения длительности госпитализации и летальности [9, 10].
Во многих отечественных и зарубежных клинических рекомендациях доказана обоснованность применения эндоскопической папиллосфинктеротомии (ЭПСТ) при клинических симптомах холангита [11, 12]. Несмотря на несколько исследований, роль и сроки ЭПСТ при БПН остаются предметом обсуждения [13, 14]. Существуют рекомендации выполнения ранней ЭПСТ (в течение 72 часов) у пациентов с БПН, у которых диагностированы обструкция желчевыводящих путей и/или холангит [13].Однако роль ЭПСТ у пациентов с АБП без симптомов холангита или конкрементов, закупоривающих желчный проток, является спорной [14, 15].
Также небольшое количество исследований посвящено роли ранней ЭПСТ в снижении частоты развития клинически значимых осложнений у больных БПН [1, 3, 7].
Цель исследования – определение влияния ранних эндоскопических вмешательств на частоту развития гнойно-септических осложнений у больных БПН.
Материал и методы исследования
В проспективное когортное исследование были включены 89 пациентов с билиарным панкреонекрозом, проходивших лечение в клинических базах кафедры анестезиологии и реаниматологии, трансфузиологии и скорой медицинской помощи Института НМФО ФГБОУ ВО ВолгГМУ Минздрава РФ с января 2019 г. по декабрь 2022 г.
До сбора базы данных были определены критерии включения/исключения. Критерии включения: билиарный панкреонекроз; выполнение эндоскопического вмешательства в первые сутки госпитализации. Критерии исключения: отсроченное эндоскопическое вмешательство, панкреатогенный шок при поступлении; летальный исход или перевод больного в другие лечебные учреждения в первую фазу панкреонекроза. Из исследования исключены 15 пациентов. У 8 больных были выполнены отсроченные эндоскопические вмешательства, у 3 – диагностирован панкреатогенный шок, 1 больной переведен в другое лечебное учреждение, летальный исход в первые 10 дней госпитализации зафиксирован у 3 пациентов. В итоге проанализированы результаты лечения 74 больных БПН, у которых выполнено раннее эндоскопическое вмешательство.
Больные разделены на две группы. В ЭТПВ-группу (n=38) включили пациентов, которым выполнены эндоскопические транспапиллярные вмешательства (ЭПСТ и/или стентирование ГПП), в ЛХС-группу (n=36) включены больные после лапароскопической холецистостомии. На выбор эндоскопической тактики по декомпрессии желче- и панкреатовыводящих путей влияли объективные и субъективные факторы: оснащенность лечебного учреждения, опыт врача-эндоскописта и приоритеты врача-хирурга.
Первичной конечной точкой считали развитие гнойно-септического осложнения (ГСО), которое определяли по результатам лабораторного, бактериологического и инструментального исследований.
Следует отметить, что данное исследование имеет свои ограничения. Во-первых, оно выполнено в одном регионе. Во-вторых, исследуемые не были распределены на группы с холангитом и/или обтурацией общего желчного протока и больных без этих осложнений. В-третьих, объем данной выборки относительно небольшой. Для подтверждения полученных результатов необходимо проведение многоцентрового большого рандомизированного исследования, где эти недостатки будут исключены.
Статистический анализ в связи с небольшим объемом выборки проводили с использованием непараметрических критериев, применяя пакет статистических программ IBM SPSS Statistics 26 (USA). По результатам проверки на нормальность распределения количественных показателей для описательной статистики вычисляли медиану (Мe) с межквартильным интервалом (IQR). При сравнении несвязанных групп использовали U-критерий Манна–Уитни (для количественных значений), точный критерий Фишера и отношение шансов (ОШ) с 95%-ным доверительным интервалом (95% ДИ) (для качественных переменных).
Для прогностического моделирования применяли логистический регрессионный анализ. Для оценки качества прогностической модели и определения чувствительности (Se) и специфичности (Sp) теста применяли ROC-анализ. По результатам показателя p менее 0,05 и при условии, что 95% ДИ не включал 1,0, различие групп считали статистически значимым.
На всех этапах исследования руководствовались этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации (2008 г.) и соглашением по Надлежащей клинической практике (ICH GCP). Все пациенты подписали информированное согласие на участие. Исследование было одобрено локальным этическим комитетом ФГБОУ ВО ВолгГМУ Минздрава России (протокол № 003-2019, экспертное заключение № 003/8).
Результаты исследования и их обсуждение
Для определения сопоставимости групп проведен сравнительный анализ клинических и демографических переменных у групп пациентов, у которых выполнены ранние (в первые 24 часа госпитализации) эндоскопическая папиллосфинктеротомия (ЭПСТ) и/или стентирование главного панкреатического протока либо лапароскопическая холецистостомия (ЛХС).
По большинству исследованных показателей группы сравнения были сопоставимы. Статистически значимого различия не выявлено по возрасту (p=0,744) и полу (p=1,000), индексу коморбидности Чарльсона (p=0,124) и характеру сопутствующей патологии (p=0,069–0,919), большинству лабораторных показателей (p=0,055–0,888) (табл. 1).
Таблица 1
Сравнительный анализ клинических и демографических переменных пациентов групп исследования
|
Показатель |
Число больных, n=74 |
p
|
|
|
ЭТПВ, n=38 |
ЛХС, n=36 |
||
|
Возраст, лет Me (IQR) |
54 (50;65) |
56 (52;66) |
0,744 |
|
Пол: |
|
|
|
|
Женщина, n (%) |
19(50,0) |
18 (50,0) |
1,000 |
|
Мужчина, n (%) |
19 (50,0) |
18 (50,0) |
|
|
ИМТ, кг/м2 Me (IQR) |
24,8 (22,6;25,9) |
25,3 (22,6;31,1) |
0,807 |
|
SOFA, у.е. Me (IQR) |
11 (8,5;12,5) |
11 (10;11) |
0,428 |
|
Коморбидный фон: |
|||
|
Индекс коморбидности Чарльсона, у.е. Me (IQR) |
3 (2;5) |
4 (3;6) |
0,124 |
|
ИБС, n (%) |
13 (34,2) |
18 (50,0) |
0,169 |
|
ПИКС, n (%) |
1 (2,6) |
3 (8,3) |
0,278 |
|
ФП, n (%) |
3 (7,9) |
4 (11,1) |
0,637 |
|
ГБ, n (%) |
22 (57,9) |
26 (72,2) |
0,197 |
|
СД, n (%) |
0 (0,0) |
3 (8,3) |
0,069 |
|
ХОБЛ, n (%) |
4 (10,5) |
3 (8,3) |
0,747 |
|
Ожирение, n (%) |
6 (15,8) |
6 (16,7) |
0,919 |
|
Лабораторные показатели: |
|||
|
Гемоглобин, г/л Me (IQR) |
140 (133,5;152) |
149 (140;152) |
0,888 |
|
Лейкоциты, ×109 Me (IQR) |
11,6 (7,5;14,9) |
15,8 (9,5;16,2) |
0,045* |
|
Тромбоциты, ×109 Me (IQR) |
180 (153;249) |
158 (149;205) |
0,090 |
|
Мочевина, ммоль/л Me (IQR) |
6 (5;8) |
5 (3,2;12) |
0,734 |
|
Креатинин, мкмоль/л Me (IQR) |
95 (86,5;96,5) |
72 (67;75) |
0,758 |
|
СРБ, мг/л Me (IQR) |
15,9 (15;16,5) |
21,9 (13,8;42,9) |
0,055 |
|
Билирубин, мкмоль/л Me (IQR) |
45 (24,5;51,5) |
43 (25;97) |
0,128 |
|
Койко-день, суток Me (IQR) |
24 (17;32) |
44 (24;55) |
0,003* |
|
Летальный исход, n (%) |
2 (5,3) |
10 (27,8) |
0,009* |
Примечание: * – статистически значимое различие групп; Me (IQR) – медиана с межквартильным интервалом; ЭТПВ – эндоскопическое транспапиллярное вмешательство; ЛХС – лапароскопическая холецистостомия; ИМТ – индекс массы тела; SOFA – тяжесть состояния пациента; ИБС – ишемическая болезнь сердца; ПИКС – постинфарктный инфаркт миокарда; ФП – постоянная форма фибрилляции предсердий; ГБ – гипертоническая болезнь; СД – сахарный диабет 2-го типа; ХОБЛ – хроническая обструктивная болезнь легких; СРБ – С-реактивный белок.
В ЛХС-группе были три пациента с сахарным диабетом 2-го типа, что могло негативно сказаться на риске развития ГСО у этих больных, но не могло исказить результаты во всей группе, так как по этому показателю различие групп было статистически недостоверно (p=0,069). И более высокий лейкоцитоз в ЛХС-группе не повлиял на значимое различие групп по тяжести состояния больных (по шкале SOFA, p=0,428).
Для устранения желчной и панкреатической гипертензии применяли лапароскопическую холецистостомию (ЛХС), эндоскопическую папиллосфинктеротомию и стентирование главного панкреатического протока (СГПП). Частота развития гнойно-септических осложнений (ГСО), включая сепсис, в зависимости от вида эндоскопического вмешательства показана на рисунке 1.
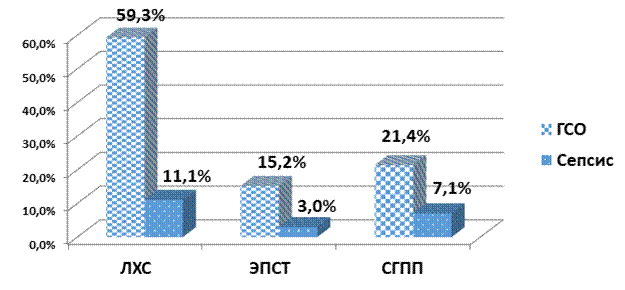
Рис. 1. Частота развития гнойно-септических осложнений (ГСО), включая сепсис, в зависимости от вида эндоскопического вмешательства (ЛХС – лапароскопическая холецистостомия, ЭПСТ – эндоскопическая папиллосфинктеротомия, СГПП – стентирование главного панкреатического протока)
Достоверно чаще ГСО были диагностированы у больных, у которых выполнялась ЛХС. По сравнению с группой пациентов, у которых была проведена ЭПСТ, гнойно-септические осложнения и сепсис после ЛХС наблюдались чаще в 8,1 раза (ОШ=8,1; 95% ДИ 2,37–28,07, p<0,001) и в 4,0 раза (ОШ=4,0; 95% ДИ 0,38–41,96, p=0,097) соответственно.
В 69,7% (23/33) наблюдений ЭПСТ дополнялась стентированием ГПП. У 5 (6,8%) больных было выполнено изолированное стентирование ГПП. После стентирования ГПП гнойно-септические осложнения и сепсис наблюдались реже, чем после ЛХС (в 5,3 раза (ОШ=5,3; 95% ДИ 1,61–17,69, p=0,005) и в 1,6 раза (ОШ=1,6; 95% ДИ 0,24–10,80, p=0,367) соответственно), но чаще, чем после ЭПСТ (в 1,5 раза (ОШ=1,5; 95% ДИ 0,41–5,75, p=0,483) и в 2,5 раза (ОШ=2,5; 95% ДИ 0,21–29,48, p=0,157) соответственно). Таким образом, авторы статьи обнаружили значимый профилактический эффект в отношении развития ГСО при дополнении ЭПСТ стентированием ГПП (табл. 2).
Таблица 2
Зависимость частоты развития гнойно-септических осложнений от эндоскопической тактики
|
Результат бинарного логистического анализа |
||||||||
|
Модель |
Сводка для модели |
|||||||
|
|
-2 Log |
R2a |
R2b |
|||||
|
|
84,298 |
0,171 |
0,233 |
|||||
|
|
Переменные в уравнении |
|||||||
|
|
B |
SD |
Вальд |
p |
Exp (B) |
95% ДИ |
||
|
ЛХС |
0,378 |
0,717 |
0,278 |
0,598 |
1,459 |
0,358–5,950 |
||
|
Стентирование ГПП |
0,009 |
0,768 |
0,001 |
0,991 |
1,009 |
0,224–4,542 |
||
|
ЭПСТ |
–1,968 |
0,579 |
11,569 |
0,001 |
0,140 |
0,045–0,434 |
||
|
Константа |
0,245 |
0,315 |
0,607 |
0,436 |
1,278 |
|
||
Примечание: R2a – R-квадрат Кокса и Снелла; R2b – R-квадрат Нэйджелкерка.
Наблюдаемые зависимости риска развития ГСО от характера ранних эндоскопических вмешательств (ЭПСТ, стентирование ГПП и ЛХС) можно описать уравнением:
p = 1 / (1 + e-z) * 100%, где z = 0,245 – ЭПСТ (p – вероятность развития ГСО, ЭПСТ – эндоскопическая папиллосфинктеротомия (да = 1, нет = 0).
Полученная регрессионная модель являлась статистически значимой (p<0,001). На основании значений коэффициента детерминации Найджелкерка модель определяла 23,3% дисперсии вероятности развития гнойно-септического осложнения. Исходя из значения регрессионного коэффициента, выполнение ЭПСТ в первые сутки госпитализации уменьшали шансы развития ГСО в 7,1 раза.
Применение ЛХС и стентирования ГПП не показало статистически значимого влияния на частоту развития ГСО и было исключено из модели. Специфичность и чувствительность модели составили 73,0% и 71,7% соответственно.
Для определения валидности полученной модели был выполнен ROC-анализ взаимосвязи между прогностической и реальной (в данной выборке) частотой развития ГСО (рис. 2).
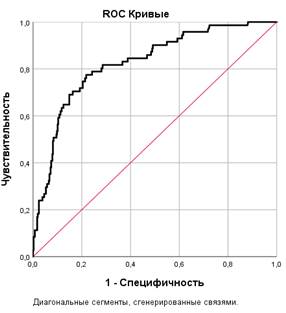
Рис. 2. ROC-кривая взаимосвязи расчетного и реального риска развития ГСО
Площадь под ROC-кривой, соответствующей взаимосвязи реального риска развития ОПП и расчетных показателей по представленной выше формуле, составила 0,825±0,02 (95% ДИ 0,773–0,877, p=0,000). Полученная модель была статистически значимой (p<0,001). Пороговое значение расчетного уровня риска развития ГСО в точке отсечения было равно 20,7%. При превышении этого порогового значения у пациентов прогнозировался высокий риск развития ГСО, и они нуждались, на наш взгляд, в более тщательном мониторинге и в комплексных методах профилактики развития ГСО, включая антибиотикопрофилактику. Чувствительность и специфичность метода составили 77,5% и 78,2% соответственно.
Также доказано, что раннее выполнение ЭПСТ у пациентов с БПН достоверно снижало как длительность госпитализации (с 44 (24;55) до 24 (17;32) суток, p=0,003), так и летальность (с 27,8% до 5,3% случаев, p=0,009).
Вопросы характера и сроков выполнения эндоскопических вмешательств у пациентов с БПН остаются актуальными до настоящего времени.
В нашем исследовании доказано, что раннее (до 24 часов госпитализации) выполнение ЭПСТ достоверно снижает риск развития ГСО (в 7,1 раза). При этом данный профилактический эффект выявлен как у пациентов с холангитом и/или с обтурацией камнями желчевыводящих протоков, так и без этих клинических симптомов. Но другие исследователи пришли к иным выводам. Так, N.J. Schepers (2020) утверждал, что у больных с БПН без холангита срочная ЭПСТ не снижала риск основных осложнений и смертность по сравнению с консервативной тактикой лечения [13]. Но при холелитиазе никогда нельзя исключать риск развития холангита, и поэтому лучше применять тактику профилактики этого потенциально фатального осложнения [14].
В ходе данного исследования показано, что применение ранней ЭПСТ более предпочтительно в плане профилактики ГСО, чем ЛХС, у которой, вероятно, меньший дренирующий эффект, что снижает риск развития холангита. Поэтому большинство исследователей рекомендуют прибегать именно к ЭПСТ при БПН [4, 12, 14].
Сроки проведения ЭПСТ также дискутируются [7]. Так, R. Pezzilli (2015) рекомендовал раннее выполнение ЭПСТ, а N.J. Schepers (2020) не обнаружили значимого различия между ранним и отсроченным применением этого метода дренирования [2, 13].
Также было доказано, что ранняя ЭПСТ достоверно снижала длительность госпитализации и смертность, что связано со снижением риска развития сепсис-ассоциированных осложнений, о чем сообщали и другие исследователи [8, 10, 13].
Вывод. Выполнение эндоскопической папиллосфинктеротомии в первые сутки госпитализации у пациентов с билиарным панкреонекрозом достоверно снижает риск развития гнойно-септических осложнений, длительность госпитализации и летальность.
Библиографическая ссылка
Экстрем А.В., Туровец М.И., Попов А.С., Казанцев Д.А., Веденин Ю.И., Мандриков В.В., Стрельцова А.М. РАННИЕ ЭНДОСКОПИЧЕСКИЕ ВМЕШАТЕЛЬСТВА И РИСК ИНФИЦИРОВАНИЯ У ПАЦИЕНТОВ С БИЛИАРНЫМ ПАНКРЕОНЕКРОЗОМ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32547 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/spno.32547



