За последнее десятилетие иммунотерапевтические стратегии, нацеленные на белки иммунных контрольных точек, такие как запрограммированная гибель-1 (PD-1)/лиганд запрограммированной гибели-1 (PD-L1), изменили парадигму лечения рака легкого [1]. В нескольких знаковых рандомизированных контролируемых исследованиях фазы III была рекомендована монотерапия ингибиторами контрольных точек (ИКТ) в качестве стандартной терапии второй линии для пациентов с распространенным немелкоклеточным раком легкого (НМРЛ) [2, 3]. По сравнению с традиционной химиотерапией лечение ИКТ привело к увеличению выживаемости у части пациентов с распространенным НМРЛ. Исторически 5-летняя общая выживаемость (ОВ) пациентов с раком легкого IV стадии составляет всего 6% [4]. Интересно, что результаты 5-летнего наблюдения в исследовании CA209-003 продемонстрировали 5-летнюю выживаемость в 16% случаев у ранее пролеченных пациентов с распространенным НМРЛ, получавших ниволумаб [5]. Пембролизумаб также улучшал ОВ как у пациентов с распространенным НМРЛ, ранее не получавших лечения 23,2% [6]. Примечательно, что среди пациентов с показателем PD-L1 (TPS) ≥ 50% примерно треть пациентов, ранее не получавших лечения, и четверть пациентов, ранее получавших лечение, добились улучшения долгосрочной выживаемости с показателями 5-летней выживаемости 29,6% и 25,0% соответственно [6]. В совокупности успешное введение ИКТ для лечения пациентов с метастатическим раком легкого произвело революцию в терапевтическом ландшафте пациентов с этим злокачественным заболеванием и привело к стойкому ответу и долгосрочной выживаемости у части пациентов.
Цель исследования: изучить особенности клеточных показателей периферической крови больных для прогнозирования ответа на лечение НМРЛ препаратами ИКТ.
Материалы и методы исследования. В исследование включены данные о 30 пациентах с верифицированным диагнозом «генерализованный НМРЛ», получивших лечение в ФГБУ «НМИЦ онкологии» МЗ РФ с 2019 по 2021 гг. Средний возраст больных составил 61 год. Лечение пациентов проводили с применением анти-PD-1 терапии (пембролизумаб 200 мг в/в, цикл 21 день, или ниволумаб 480 мг в/в, цикл 28 дней) до появления достоверных признаков прогрессирования процесса или непереносимой токсичности лечения. В зависимости от ответа на лечение больные были поделены на две группы: 1-я группа – общий ответ (n=23), 2-я группа – прогрессирование заболевания (n=7). Образцы К3ЭДТА-крови пациентов для определения клеточных параметров иммунитета получали до начала лечения; после проведения 4 курсов терапии и после проведения 8-го курса иммунотерапии.
В соответствии с инструкцией фирмы-производителя (Becton Dickinson, США) осуществляли окрашивание образцов крови. На каждого обследованного приходилось 7 пробирок со следующими наборами моноклональных антител:
CD3 FITC /CD15+56 PE /CD45 PerCP /CD4 PE-Cy7/CD19 APC/CD8 APC-Cy7.
CD45RA FITC/CD62L PE/CD3 PerCP/CD4 PE-Cy7/CD45RО APC/CD45 APC-Cy7.
CD4 FITC /CD127 PE /CD3 PerCP /CD25 APC-Cy7.
CD4 FITC /CD38 PE /CD3 PerCP /HLADR APC.
TCRαβ FITC/TCRγδ PE/ CD3 PerCP /CD8 PE-Cy7/CD45 APC-Cy7.
CD19 FITC/CD86 PE/ CD20 PerCP-Cy5.5/CD95 APC/CD25 APC-Cy7.
CD279 FITC/CD274 PerCP-Cy5.5/CD4 PE-Cy7/CD3 APC/CD45 APC-Cy7
Измерения проводились на проточном цитометре FacsCanto II (Becton Dickinson, США). В каждом образце для анализа данных накапливали не менее 50 000 клеток. Результаты определения указанных популяций и субпопуляций клеток выражали в процентах от общего количества лимфоцитов, T-regs – в процентах от CD3+CD4+ клеток.
Формирование первичной базы данных, содержащей количественные значения определяемых параметров, осуществляли с использованием пакета программ MS Office Excel 2016. Статистическую обработку полученных результатов проводили с использованием пакета STATISTICA 13,3 (StatSoft Inc., США), что предполагало расчет основных статистических характеристик выборок, определение характера распределения определяемых показателей с использованием критерия Шапиро–Уилка. В связи с тем, что полученные результаты не соответствовали нормальному распределению, они представлены в виде медианы (Me) и интерквартильного размаха – 25-го и 75-го процентилей (Ме [LQ; UQ]). Достоверность отличий между выборками оценивалась с использованием непараметрического критерия Манна–Уитни. Результаты будут считаться статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
Накопленный к настоящему времени практический опыт использования новых терапевтических подходов к лечению больных раком легкого, предполагающих использование ингибиторов контрольных точек, показывает, что далеко не у всех пациентов наблюдается ответ на терапию. Проведение иммунотерапии у 30 больных НМРЛ позволило получить у 23 пациентов (77%) ответ на лечение, что сопровождалось такими клиническими проявлениями, как стабилизация или полный ответ. В соответствии с рассматриваемыми механизмами действия препаратов данной группы можно заключить, что в наблюдаемый клинический эффект вносят изменения функциональной активности иммунокомпетентных клеток.
У больных первой группы с ответом на проводимую ИТ после 4-го курса в периферической крови не выявлено значимых изменений по сравнению с исходными значениями относительного количества большинства определяемых основных популяций ИКТ (рис. 1А, 1Б), за исключением увеличения на 29% (р=0,046) DP-лимфоцитов и снижения количества NKT лимфоцитов на 51% (р=0,025) по сравнению с значениями до начала терапии (рис. 1Б).
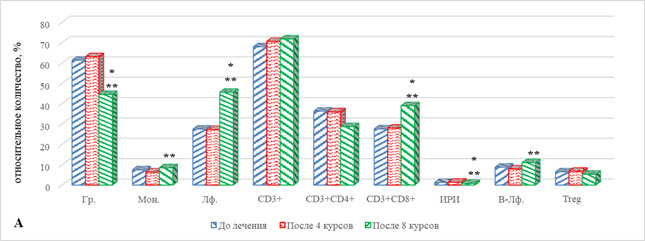
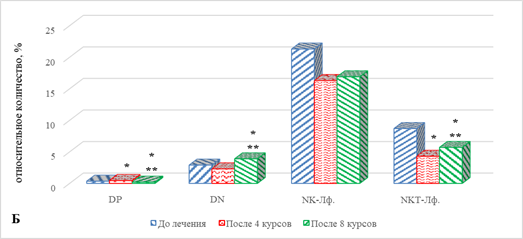
Рис. 1. Особенности параметров клеточного иммунитета больных с НМКРЛ в ходе проводимой иммунотерапии: группа 1 – ответ на терапию;
* – статистически значимо по сравнению со значением показателя до лечения;
** – статистически значимо по сравнению со значением показателя после 4-го курса ИТ
В результате проведенного исследования обнаружено статистически значимое увеличение на 49% (р=0,043) содержания наивных CD4+ Т-лимфоцитов (рис. 2А), сочетаемое с выраженным снижением ряда субпопуляций В-лимфоцитов: на 89% (р=0,033) CD19+CD25+ В-лимфоцитов и на 53% (р=0,027) CD19+CD95+ В-лимфоцитов, по сравнению с показателем до проведения терапии (рис. 2Б), что, вероятно, может указывать на определенные изменения в периферической крови В-лимфоцитов, находящихся на различных этапах дифференцировки и реализации функциональной активности, связанной с продукцией антиген-специфических антител на фоне проводимого лечения.
В рассматриваемые сроки терапии большая часть субпопуляций Т-лимфоцитов с маркерами ранней и поздней активации не претерпевала изменений, за исключением статистически значимого увеличения на 83% (р=0,038) количества цитотоксических Т-лимфоцитов с маркерами поздней активации CD8+CDHLA-DR+ по сравнению с исходными показателями (рис. 2В).
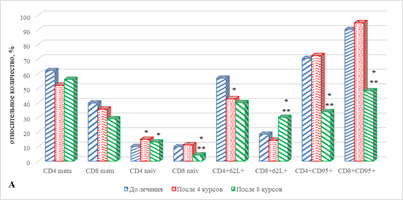
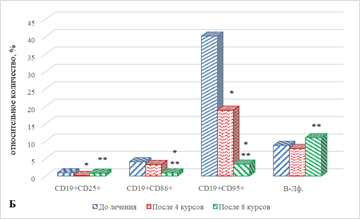
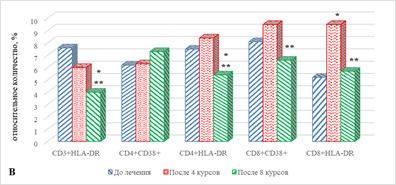
Рис. 2. Особенности параметров клеточного иммунитета больных с НМКРЛ в ходе проводимой иммунотерапии: группа 1 – ответ на терапию;
* – статистически значимо по сравнению со значением показателя до лечения;
** – статистически значимо по сравнению со значением показателя после 4-го курса ИТ
Определение выбранных показателей периферической крови после проведения 8 курсов терапии выявило ряд изменений в содержании основных популяций ИКК. По сравнению с исходными значениями, до начала проведения терапии, выявлено значимое увеличение общего количества лимфоцитов, главным образом за счет увеличения CD8+ цитотоксических лимфоцитов, данные показатели превышали исходные соответственно на 66% (р=0,034) и 41% (р=0,039). В условиях увеличения содержания ЦТЛ без изменения уровня Т-лимфоцитов хелперов наблюдается закономерное снижение ИРИ на 38% (р=0,047). Кроме того, отмечено снижение количества гранулоцитов на 28% (р=0,041) (рис. 1А). При этом наблюдаются увеличение на 29% (0,046) содержания DP-лимфоцитов, а также значимое снижение на 51% (р=0,025) NKT-клеток (рис. 1Б).
При сравнении полученных значений в рассматриваемые сроки наблюдения определяемых показателей с их уровнем после 4-го курса ИТ выявлено увеличение ряда основных популяций ИКК. В частности, в данные сроки наблюдения увеличивалось количество моноцитов, лимфоцитов, цитотоксических Т-лимфоцитов и В-лимфоцитов соответственно на 33% (р=0,04), 67% (р=0,035), 39% (р=0,041) и 39% (р=0,045). На этом фоне количество гранулоцитов и ИРИ оказалось ниже значений соответствующих показателей после 4 курсов ИТ соответственно на 29% (р=0,042) и 43% (р=0,041) (рис. 1А). Обращает на себя внимание разнонаправленный характер изменения содержания предшественников Т-лимфоцитов: если число DP-лимфоцитов оказалась ниже на 56% (р=0,034), то число DN-клеток, напротив, было выше на 70% (р=0,039), на фоне чего количество NKT-лимфоцитов также повышалось на 33%, р=0,045 (рис. 1Б).
Значимым оказалось увеличение на 31% (р=0,045) количества наивных CD4+ Т клеток, а также на 63% (р=0,027) CD8+ клеток эффекторной памяти. На фоне отмеченных изменений значимым является снижение целого ряда показателей: CD8+ наивных Т-лимфоцитов – на 57% (р=0,021), CD4+ клеток эффекторной памяти – на 29% (р=0,042), CD4+CD95+ и CD8+CD95+ лимфоцитов, соответственно на 52% (р=0,023) и 47% (р=0,047). Отмечено снижение относительного содержания ряда субпопуляций В-лимфоцитов: CD19+CD86+ клеток – на 78%, р=0,031, а CD19+CD95+В-лимфоцитов – на 91%, р=0,029 (рис. 2А, 2Б).
При сравнении полученных результатов с аналогичными показателями после проведения 4 курсов терапии обнаружено значимое увеличение относительного количества CD8+ Т-лимфоцитов эффекторной памяти и CD19+CD25+ клеток – соответственно на 110% (р=0,021) и в 7 раз (р=0,0001). Выявлено значимое снижение ряда других субпопуляций лимфоцитов: наивных CD8+ Т клеток – на 62%, р=0,021, CD4+CD95+ и CD8+CD95+ лимфоцитов – соответственно на 53% (р=0,021) и 49% (р=0,021) (рис. 2А). Кроме того, выявлено снижение CD19+CD86+ и CD19+CD95+ популяций В-лимфоцитов – соответственно на 73% (р=0,034) и на 82%, р=0,032 (рис. 2Б).
В случае определения отдельных популяций лимфоцитов с маркерами ранней и поздней активации после проведения 8 курсов терапии и их сравнения с аналогичными показателями до начала лечения значимым оказалось снижение на 47% (р=0,036) и 28% (р=0,047) соответственно CD3+ Т-лимфоцитов и CD4+ Т-лимфоцитов с маркерами поздней активации. При этом при сравнении полученных результатов со значениями показателей после 4 курсов лечения обнаружено снижение содержания CD3+, CD4+ и CD8+ клеток с маркерами поздней активации соответственно на 33% (р=0,045), 36% (р=0,044) и 40% (р=0,044), а также на 31% (0,042) CD8+CD38+ Т-лимфоцитов (рис. 2В).
Известно, что применение ингибиторов контрольных точек при лечении рака легкого не во всех случаях сопровождается положительным результатом. В нашем исследовании у 7 больных наблюдалось прогрессирование заболевания. В связи с этим определенный интерес представляет рассмотрение особенностей иммунологических показателей у пациентов данной группы.
В результате проведенного исследования выявлено, что у пациентов второй группы после проведения как 4, так и 8 курсов терапии не наблюдается значимых отличий от аналогичных показателей до начала лечения в случае большинства показателей, за исключением выраженного увеличения содержания Тreg, DP- и DN-лимфоцитов, количество которых оказалось выше относительно всех рассматриваемых сроков соответственно на 30% (р=0,046) и 42% (р=0,042), 80% (р=0,037) и 87% (р=0,031), 35% (р=0,045) и 70% (р=0,039) (рис. 3А, 3Б).
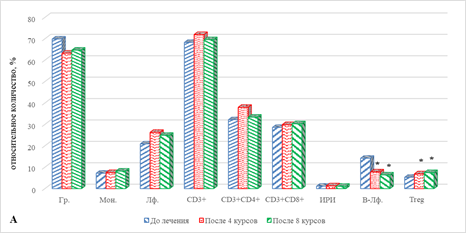
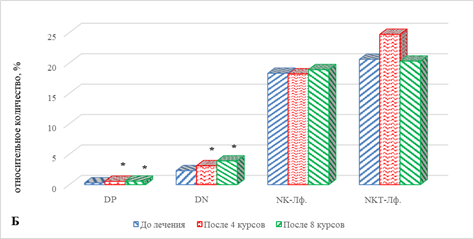
Рис. 3. Особенности параметров клеточного иммунитета больных раком легкого в ходе проводимой иммунотерапии: группа 2 – прогрессия
* – статистически значимо по сравнению со значением показателя до лечения;
** – статистически значимо по сравнению со значением показателя после 4-го курса ИТ
При этом выявлено снижение количества В-лимфоцитов как после 4, так и после 8 курсов ИТ, соответственно 45% (р=0,039) и 55% (р=0,034), по сравнению с исходными значениями (рис. 3А). Обращает на себя внимание отсутствие изменений в случае прогрессии заболевания на фоне проводимой терапии количества эффекторных клеток как врожденного, так и адаптивного иммунитета.
Проведение ИТ в случае отсутствия ожидаемого положительного ответа на него не сопровождается изменением относительного содержания в периферической крови пациентов большинства субпопуляций лимфоцитов. В нашем исследовании показано только увеличение по сравнению со значениями до начала лечения количества ряда В-лимфоцитов как после 4-го, так и после 8-го курса ИТ.
В частности, отмечено увеличение содержания CD19+CD86+ и CD19+CD95+ В-лимфоцитов соответственно на 72% (р=0,037) и 64% (р=0,039), 164% (р=0,028) и 133% (р=0,033) (рис. 4А, 4Б). Обращает также на себя внимание отсутствие изменений в содержании лимфоцитов с маркерами ранней и поздней активации (рис. 4В).
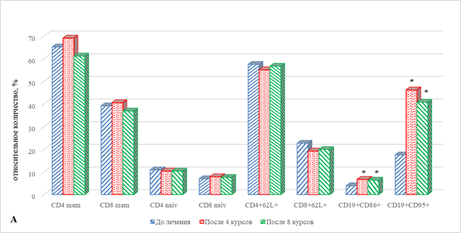
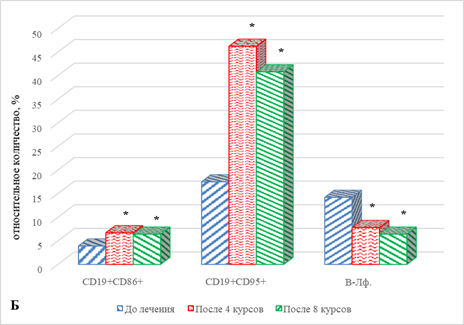
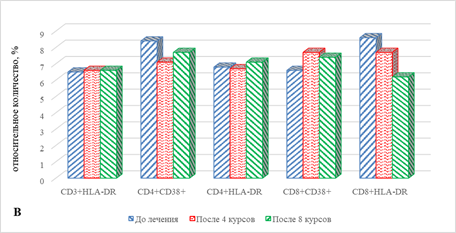
Рис. 4. Особенности параметров клеточного иммунитета больных раком легкого в ходе проводимой иммунотерапии: группа 2 – прогрессия;
* – статистически значимо по сравнению со значением показателя до лечения;
** – статистически значимо по сравнению со значением показателя после 4-го курса ИТ
Важным вопросом является определение тех особенностей в клеточных показателях периферической крови, которые сопутствуют неблагоприятному ответу с прогрессированием заболевания (группа 2), по сравнению с аналогичными показателями при благоприятном ответе (группа 1) на проведенное лечение с использованием PD-1 ингибиторов.
В результате проведенной работы обнаружено, что до начала ИТ у пациентов группы 2 наблюдается увеличение содержания В-лимфоцитов на 61% (р=0,031), что сопряжено с увеличением количества NKT-лимфоцитов на 137% (р=0,023), CD4+CD38+ и CD8+HLADR+ Т-лимфоцитов соответственно на 35% (р=0,042) и 65% (р=0,04). Однако на этом фоне выявлено снижение числа CD19+CD95+ В-клеток на 56% (р=0,028).
После проведения 4 курсов ИТ у пациентов 2-й группы статистически значимым оказалось увеличение на 35% (р=0,046) числа DN-лимфоцитов, что сочеталось с выраженным дальнейшим накоплением в крови NKT-клеток, относительное количество которых превышало значения в 1-й группе в 5 раз (р=0,009). В эти сроки у пациентов с прогрессированием заболевания обнаружено увеличение некоторых субпопуляций В-лимфоцитов на 103% (р=0,04) и 144% (р=0,027) соответственно CD19+CD86+ и CD19+CD95+ клеток. При этом отличий в количестве отдельных лимфоцитов, экспрессирующих маркеры ранней и поздней активации, в рассматриваемые сроки не выявлено.
После 8-го курса у больных 2-й группы по сравнению с группой 1 отмечаются увеличение количества в крови гранулоцитов на 45% (р=0,037), тенденция к снижению цитотоксических CD8+ Т-лимфоцитов, которая без изменения CD4+ клеток приводит к сдвигу ИРИ в сторону преобладания регуляторных Т-лимфоцитов. Это находит также отражение в увеличении на 42% (р=0,039) к данному сроку наблюдения относительного содержания Treg клеток. Кроме того, показано увеличение на 180% (р=0,021) и в 2,5 раза (р=0,0012) количества DP- и NKT-лимфоцитов соответственно. Также выявлено увеличение на 81% (р=0,033) наивных CD8+ клеток и на 41% (р=0,029) CD4+ клеток эффекторной памяти, что сопровождается снижением на 34% (р=0,032) CD8+ Т-лимфоцитов эффекторной памяти и на 65% (р=0,043) CD3+ клеток, экспрессирующих маркеры поздней активации.
Отмеченные особенности параметров периферической крови пациентов с прогрессией заболевания после проведения 8 курсов ИТ сочетаются со снижением общего числа лимфоцитов на 45% (р-0,035) и В-лимфоцитов на 42% (р=0,036) на фоне выраженного увеличения количества некоторых субпопуляций В-клеток: на 611% (р=0,001) и 1100% (р=0,0001) соответственно CD19+CD86+ и CD19+CD95+ В-лимфоцитов.
Особенности экспрессии маркеров PD-1/PD-L1 на лимфоцитах крови больных раком легкого на фоне проведения лечения с использованием ингибиторов контрольных точек
К настоящему времени показано, что одним из факторов, определяющих эффективность использования ингибиторов контрольных точек при лечении опухолей различной локализации, является уровень экспрессии на иммунокомпетентных клетках их мишеней, в связи с чем в нашем исследовании отдельной задачей было определение числа CD4+ и CD8+ клеток, имеющих на плазматической мембране CD279+/PD-1 и CD274+/PD-L1 молекулы. Определение данных показателей у ряда больных раком легкого осуществляли до начала терапии и после ее завершения.
У пациентов с РЛ без учета ответа на проводимое лечение количество лимфоцитов обеих популяций, экспрессирующих PD-1 после проведения лечения, оказалось ниже их исходного количества на 40% и 89%, составив соответственно 2,3 (0;7,7) против 3,8 (2,2; 5,7) для CD4+ клеток, 0,6 (0; 5,7) против 3,85 (2,68;8,4) для CD8+ клеток (рис. 5А). Статистически значимого отличия в этом случае, несмотря на достаточно выраженные отличия, получить не удалось, что может быть связано с небольшим числом обследованных в группах и большим разбросом определяемых показателей, отражающих индивидуальные особенности пациентов.
Статистически значимым оказалось изменение экспрессии на лимфоцитах PD-L1, количество CD4+ и CD8+ лимфоцитов с данными лигандами увеличивалось по завершении лечения на 100% (р=0,028) и в 20 раз (р=0,023).
При анализе полученных данных экспрессии PD-1, PD-L1 на лимфоцитах периферической крови пациентов с РЛ с учетом ответа на терапию были получены следующие результаты.
В группе больных с ответом на ИТ количество лимфоцитов обеих популяций, экспрессирующих PD-1, оказалось ниже исходных значений соответственно на 100% для CD4+ (р=0,063) и на 98% (р=0,044) для CD8+ клеток. При этом значимым оказалось увеличение по сравнению с исходными значениями количества в крови пациентов данной группы CD4+ и CD8+ лимфоцитов, экспрессирующих PD-L1, соответственно на 100% (р=0,024) и в 20 раз (р=0,028) (рис. 5Б).
У больных 2-й группы с прогрессией заболевания характер изменения определяемых показателей имел некоторые особенности (рис. 5В).
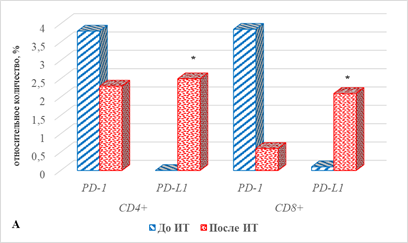
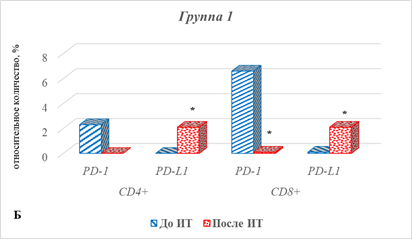
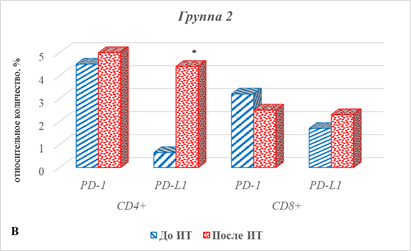
Рис. 5. Уровни Т-клеток, экспрессирующих PD-1/PD-L1 в ходе проведения ИТ, *– статистически значимо по сравнению со значением показателя до лечения
Статистически значимым в этом случае оказалось увеличение после ИТ экспрессии только PD-L1, наиболее выраженное в случае CD4+ лимфоцитов, – увеличение в 5,7 раза (р=0,0012).
Таким образом, проведенные исследования выявили некоторые особенности экспрессии молекул системы PD-1/PD-L1 на лимфоцитах периферической крови у обследованных больных раком легких. В нашем исследовании в случае различных эффектов от ИТ до начала ее проведения выявлено значимое увеличение на клетках обеих популяций (CD4+ и CD8+) только PD-L1, в то время как отличий в содержании PD-1 не выявлено. По завершении лечения у больных с различным клиническим эффектом значимых отличий в относительном содержании лимфоцитов с PD-1 и PD-L1 не выявлено, что может быть связано с небольшим объемом выборки и сильной индивидуальной вариацией определяемых показателей.
Тем не менее, несмотря на указанное отсутствие статистически значимых отличий, различия в экспрессии определяемых маркеров в зависимости от эффекта ИТ обнаружены. Так, до начала терапии больных раком легких у пациентов с прогрессией заболевания количество CD4+PD-L1+ и CD8+PD-L1+ лимфоцитов превышало соответствующие значения данных показателей у пациентов 1-й группы (с положительным эффектом от лечения). При этом содержание клеток, экспрессирующих PD-1, у больных 2-й группы было различным: если количество CD4+ лимфоцитов превышало на 96%, то CD8+, напротив, оказалось ниже на 52% по сравнению с аналогичными значениями в 1-й группе. После проведения ИТ отмечено резкое увеличение (в 24 раза) количества CD8+PD-1+ в крови больных с прогрессией заболевания. Кроме того, в данном варианте ответа на терапию (у пациентов 2-й группы) обнаружено увеличение содержания CD4+PD-1+, CD4+PD-L1+ лимфоцитов соответственно на 83% и 100%.
Полученные в нашем исследовании результаты не позволяют однозначно говорить о зависимости эффекта от лечения больных раком легкого от содержания в крови лимфоцитов с маркерами системы PD-1/PD-L1 и требуют дальнейшего исследования и анализа.
Обсуждение полученных результатов
В результате проведенного исследования обнаружено, что к моменту завершения наблюдения, после 8 курсов ИТ в случае положительного эффекта от терапии, отмечается увеличение в периферической крови содержания лимфоцитов, моноцитов, В-лимфоцитов за счет клеток, имеющих активационный рецептор CD25+. Увеличение количества цитотоксических CD8+ клеток сопровождается увеличением CD8+ клеток эффекторной памяти и снижением субпопуляции наивных цитотоксических лимфоцитов. Изменения количества Тreg лимфоцитов не выявлено, но обнаружен разнонаправленный характер изменения содержания в крови предшественников Т-лимфоцитов – снижения DP и увеличения DN лимфоцитов. Кроме того, обнаружено снижение количества CD4+ и CD8+ лимфоцитов с маркерами ранней и поздней активации, за исключением CD4+CD38+ клеток. На этом фоне не выявлено изменения содержания NK-лимфоцитов при снижении NKT-лимфоцитов.
Таким образом, у больных раком легкого в случае дальнейшего прогрессирования заболевания после 8-го курса ИТ, вероятно, отмечается формирование преимущественного иммуносупрессивного фенотипа, на что указывают увеличение Treg лимфоцитов и DN клеток, а также отсутствие изменений в эффекторных клетках врожденного и адаптивного иммунитета, изменения числа лимфоцитов с различными активационными маркерами. Особенностью иммунологических параметров крови у пациентов данной группы является снижение содержания В-лимфоцитов, которое, однако, сопровождается увеличением CD19+CD86+ и CD19+CD95+ субпопуляций.
Кроме того, при развитии ответа на лечение ИКТ происходит снижение уровня В-лимфоцитов, экспрессирующих CD95+, рассматриваемых в литературе как «истощенные» [7]. Современная литература расценивает CD95 не только как рецептор активационного апоптоза. Описаны различные механизмы усиления опухолевого роста через этот рецептор и его лиганд, в частности стимуляция им опухолевых стволовых клеток и эпителиально-мезенхимального перехода, что способствует выживанию и распространению опухоли в организме хозяина [8]. Есть и альтернативные данные, полученные на больных с опухолями головы и шеи и РЛ: авторы, хотя и придают некоторое значение CD8+CD95+ клеткам в разрушении опухоли, считают наиболее важным для этого содержащийся в их гранулах перфорин [9, 10]. Учитывая данные литературы об усилении экспрессии CD95L на эндотелии сосудов опухоли [8], можно полагать, что его возможности взаимодействовать с рецептором будут тем больше, чем выше количество экспрессирующих CD95 клеток. Следовательно, наблюдаемое нами двукратное снижение процента CD95+ В-лимфоцитов после лечения ИКТ в группе больных с положительным эффектом, по-видимому, отражает ослабление такого механизма избегания опухолью действия иммунной системы в результате проведенного лечения.
При сравнении ответа на лечение у различных больных в связи с их иммунным статусом нами также было выявлено более высокое количество активированных CD8+ клеток при развитии клинического эффекта. Однако отмеченное у этих же больных более низкое содержание центральных CD8+ клеток памяти говорит о возможном истощении системы цитотоксических Т-лимфоцитов при хронической стимуляции опухолевыми антигенами, о чем есть многочисленные сообщения в литературе [11, 12]. В последнее время стали появляться данные о воздействии микробиоты кишечника на дифференцировку лимфоцитов памяти, прежде всего, полученные при исследовании на локальном уровне [13]. Следует отметить, что вопрос о специфичности изученных нами Т-клеток памяти и наивных Т-лимфоцитов в отношении как опухолевых, так и микробных антигенов остается открытым, а в литературе приводятся единичные и неоднозначные сведения.
Таким образом, найденные нами различия иммунного статуса больных РЛ касаются не только Т-клеток, играющих ведущую роль в противоопухолевом иммунитете, но и моноцитов и В-лимфоцитов, роль которых известна, прежде всего, в антибактериальном иммунитете, но привлекающих внимание и в плане влияния на опухолевый рост [14, 15].
Заключение
Отмечен ряд статистически значимых отличий при различном клиническом эффекте иммунотерапии. Общий ответ сопровождается снижением уровня NKT-клеток после 4-го курса, а после 8-го курса дополнительно происходит повышение уровня CD8+ клеток, что можно расценить как положительную иммунологическую динамику. При этом выявлены волнообразное изменение уровня DP-клеток (повышение их уровня после 4-го и снижение после 8-го курса), повышение уровня DN- и снижение NK-клеток после 8-го курса.
Прогрессия заболевания на фоне проводимой иммунотерапии характеризуется повышением Tregs, DP- и DN-Т-клеток после 4-го курса; после 8-го курса такие изменения сохраняются. После окончания 4-го курса у больных с прогрессированием процент NKT клеток был выше во все сроки исследования.
Исследование Т-клеток памяти и «наивных» Т-лимфоцитов, проведенное в тех же группах, показало, что общий ответ сопровождается статистически значимым повышением процента CD4 naiv, развивающимся уже после 4-го курса и продолжающимся после 8-го курса; после 8-го курса выявлено снижение количества CD8+ naiv клеток. При этом направленность изменений содержания центральных клеток памяти противоположна: после 8-го курса отмечены снижение CD4+CD62L+ и повышение CD8+CD62L+ клеток. При прогрессии НМРЛ статистически значимых различий уровней этих субпопуляций не отмечено.
В целом у больных НМРЛ при лечении отмечено статистически значимое снижение содержания Т-клеток обеих основных субпопуляций, экспрессирующих PD-1 (CD279), и повышение содержания Т-клеток, экспрессирующих PD-L1 (CD274). Ответ на иммунотерапию сопровождался статистически значимым снижением процента PD-1 (CD4+CD279+ и CD8+CD279+) лимфоцитов наряду с возрастанием количества PD-L1 (CD4+CD274+ и CD8+CD274+). Напротив, при отсутствии эффекта уровни PD-1 (CD4+CD279+ и CD8+CD279+) не отличались от исходных, а PD-L1 (CD4+CD274+ и CD8+CD274+) статистически значимо повышались.
Таким образом, прогрессирование заболевания и отсутствие эффекта от ИТ сопровождаются целым рядом особенностей изменения популяционного и субпопуляционного состава клеток врожденного и адаптивного иммунитета, что вносит определенный вклад в ответ организма на проводимое лечение.
В качестве потенциально прогностически значимых показателей положительного ответа на ингибиторы PD-1 у больных НМРЛ можно рассматривать уровни DN, CD4+, CD8+ выше 29%, 31% и 41% соответственно, CD8+naiv, CD4+CD62L+, CD19+CD86+, NKT клеток ниже 62%, 63%, 73% и 51% соответственно.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Работа выполнена в рамках выполнения государственного задания по теме «Разработка прогностических и предиктивных алгоритмов на основе выявления новых иммунологических и молекулярно-генетических характеристик злокачественных опухолей и их микроокружения», рег. №121031100251-9.
Библиографическая ссылка
Сагакянц А.Б., Теплякова М.А., Владимирова Л.Ю., Бондаренко Е.С., Златник Е.Ю., Новикова И.А., Дженкова Е.А. ОСОБЕННОСТИ ПОПУЛЯЦИОННОГО СОСТАВА ИММУНОКОМПЕТЕНТНЫХ КЛЕТОК ПЕРИФЕРИЧЕСКОЙ КРОВИ У ПАЦИЕНТОВ С НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО НА ФОНЕ ПРОВОДИМОЙ ИММУНОТЕРАПИИ С РАЗЛИЧНОЙ ЕЕ ЭФФЕКТИВНОСТЬЮ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32545 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/spno.32545



