Ведущая роль эндотелиальной дисфункции в патофизиологии состояний, связанных с новой коронавирусной инфекцией (НКИ) COVID-19, подтверждена неоднократно клиническими [1], лабораторными [2], инструментальными исследованиями [3], результатами изучения секционного материала [4].
Вирус SARS-CoV-2, проникая в клетки-мишени через рецептор ангиотензин-превращающего фермента-2, который экспрессируется на поверхности эпителия альвеол, энтероцитов, сосудистого эндотелия, вызывает прямое клеточное повреждение и последующее высвобождение провоспалительных факторов из гибнущих клеток.
Одним из проявлений «атипичного» острого респираторного дистресс-синдрома бывает первично прогрессирующее усиление дисбаланса вентиляционно-перфузионных отношений. Эти изменения легочной перфузии носят «функциональный» характер, приводят к гиперперфузии плохо вентилируемых участков легочной ткани и являются следствием вазоплегии, воспалительной гиперемии, потери эффекта гипоксической вазоконстрикции [5].
Параллельно происходят структурные изменения, проявляющиеся неоангиогенезом в плохо вентилируемой легочной паренхиме. Дисбаланс вентиляции/перфузии также включает области легких с гипоперфузией на фоне вазоконстрикции [6] и микротромбообразования [5] в участках с нормальной или повышенной легочной вентиляцией, результатом чего становится перераспределение легочного кровотока в менее вентилируемые зоны. Результирующий итог вышеперечисленных событий – снижение вентиляционно-перфузионного показателя и нарастающая гипоксемия вследствие увеличения примеси неоксигенированной крови и объема мертвого пространства на фоне сохраненной легочной вентиляции [7].
В решении проблем вентиляционно-перфузионного несоответствия помогает патогенетическая терапия с использованием большого арсенала противовоспалительных средств, антитромботических препаратов, стандартных инфузионных сред, маневра прон-позиции [8]. Однако их применение ограничено противопоказаниями и потенциально опасными осложнениями [9]. Выбор же характера инфузионных сред в рамках поддержания гидробаланса и одновременной коррекции эндотелиальной дисфункции крайне важен, так как поврежденный эндотелий первым взаимодействует с парентеральным раствором.
Первый опыт применения сукцинат-содержащих сред показал их эффективность в отношении контроля над COVID-19-ассоциированным системным воспалением и коагулопатией [10]. Наша работа направлена на дальнейшее изучение потенциала инфузионной коррекции COVID-19-ассоциированной эндотелиопатии.
Цель исследования — оценить влияние использования 1,5%-ного раствора меглюмина натрия сукцината на степень выраженности COVID-19-ассоциированной эндотелиопатии у пациентов с тяжелой формой НКИ COVID-19.
Материал и методы исследования. Проанализированы данные 53 пациентов с тяжелой формой НКИ COVID-19, осложненной двусторонней полисегментарной пневмонией, госпитализированных в ФГБУ «СЗОНКЦ им. Л.Г. Соколова ФМБА России» (г.Санкт-Петербург) в период 2021–2022 гг. Лечение всех пациентов проводили в соответствии с актуальными «Временными методическими рекомендациями МЗ РФ по профилактике, диагностике и лечению новой коронавирусной инфекции COVID-19» [8].
Все пациенты при поступлении рандомно разделены на две группы методом конвертов. В группе исследования, представленной 27 пациентами, в комплекс терапии включен инфузионный препарат — 1,5%-ный раствор меглюмина натрия сукцината (реамберина) в суточной дозе 10 мл/кг курсом до 11 дней или в течение всего срока нахождения в отделении реанимации и интенсивной терапии (ОРИТ). Контрольная группа, состоящая из 26 пациентов, получала аналогичный объем инфузии за счет полиэлектролитных растворов, не содержавших метаболически активных субстратов.
Исследовали эндотелиоцитоз, уровень гомоцистеина, газовый состав артериальной и смешанной венозной крови, кислотно-основной баланс, вено-артериальную разницу парциального напряжения CO2, индекс анаэробного метаболизма, индекс экстракции О2. Оценка степени эндотелиальной деструкции проведена методом определения количества циркулирующих эндотелиальных клеток на проточном цитофлюориметре Cytomics FC500 (Beckman Coulter, США) с использованием меченных флюорохромами моноклональных антител к поверхностным маркерам клеток: CD45-PC5 (phycoerythrin + cyanine 5 – фикоэритрин + цианин 5; Beckman Coulter, США) как панлейкоцитарный маркер и CD146-PE (phycoerythrin – фикоэритрин; Becihan Coulter, США) в качестве метки для циркулирующих эндотелиальных клеток [10].
Взятие венозной крови проходило в 7 этапов: при поступлении в ОРИТ, через 2–4 ч после первого введения инфузионных сред, на 2-е, 3-и, 4-е, 5-е и 11-е сутки (через 2–4 ч после введения препарата). Первичные конечные точки: уровень биомаркеров эндотелиальной дисфункции (эндотелиемия и концентрация гомоцистеина), газового состава крови (парциальное напряжение О2 в венозной и артериальной крови, вено-артериальная разница парциального напряжения CO2), аэробного/анаэробного метаболизма (гликемия, лактат, индекс экстракции О2). Вторичными конечными точками были количество переводов на инвазивную искусственную вентиляцию легких и 28-дневная летальность.
Критерии включения:
– подтвержденный диагноз НКИ COVID-19;
– возраст 18 лет и старше;
– наличие подписанного информированного согласия пациента на участие в исследовании;
– характер изменений в легких по данным компьютерной томографии (3–4-й степени);
– 1–2-е сутки от момента госпитализации пациента в ОРИТ.
Критерии невключения:
– показания к инвазивной респираторной поддержке на момент скрининга;
– непереносимость меглюмина натрия сукцината (реамберина) в анамнезе;
– прием препаратов с антигипоксическим и антиоксидантным действием;
– беременность;
– хронические заболевания в стадии декомпенсации.
Критерии исключения:
– отзыв пациентом информированного согласия на участие в исследовании;
– аллергическая реакция на инфузионный препарат.
Статистическая обработка полученных данных выполнена в среде IBM SPSS v23. Данные, измеренные в номинативной шкале (признак есть/нет), сравнивали в режиме таблиц сопряженности при помощи точного критерия Фишера. Уровень значимости, при котором нулевую гипотезу отвергали, был р<0,05. Обработка проведена при помощи MANOVA в режиме с повторными измерениями. Использовали многомерный метод Пиллаи (V), одномерный F-критерий с поправкой Хайн–Фельдта. Сравнение между группами проводили с использованием критерия Манна–Уитни для количественных переменных, межэтапные сравнения – с помощью критерия Шидака. Если верхняя граница доверительного интервала была ниже 0,05, результат считали значимым.
Протокол исследования одобрен локальным этическим комитетом ФГБУ «СЗОНКЦ им. Л.Г. Соколова ФМБА России» (№ 5 от 22.04.2021 г.).
Результаты исследования и их обсуждение. Группы были сравнимы по половозрастному составу, объему поражения легких, тяжести состояния по шкале NEWS (от англ. National Early Warning Score – Национальная шкала раннего предупреждения). При этом в исследуемую группу в процессе рандомизации были более часто включены пациенты с ожирением (р=0,08) и часто связанной с ним артериальной гипертензией (70,6% пациентов в исследуемой группе и 56,3% в группе контроля). В контрольной же группе, напротив, отмечалось преобладание (на 13,2%) пациентов с хронической обструктивной болезнью легких в анамнезе.
Данные групп пациентов по исходному статусу
|
Критерий |
Контрольная группа (n=26) |
Исследуемая группа (n=27) |
Максимально значимые различия, р |
|
Возраст, годы, среднее значение ± стандартное отклонение |
66,8±9,4 |
60,3±12,7 |
0,110 |
|
Мужской пол, % |
62,5 |
70,6 |
0,721 |
|
Индекс массы тела >30 кг/м2, % |
25,0 |
58,8 |
0,080 |
|
Объем поражения легких по данным компьютерной томографии, баллы, медиана (25-й и 75-й квартили) |
3,00 (3,00; 3,00) |
3,00 (3,00; 3,00) |
0,194 |
|
Исходный балл по шкале NEWS, баллы, медиана (25-й и 75-й квартили) |
5,00 (5,00; 6,00) |
6,00 (5,00; 6,00) |
0,290 |
|
Гипертоническая болезнь, % |
56,3 |
70,6 |
1,000 |
|
Хроническая обструктивная болезнь легких, % |
25,0 |
11,8 |
0,732 |
|
Сахарный диабет 2-го типа, % |
25,0 |
29,4 |
0,481 |
|
Ишемическая болезнь сердца, % |
43,8 |
52,9 |
0,398 |
Примечание: NEWS (от англ. National Early Warning Score) – Национальная шкала раннего предупреждения.
На этапе поступления у пациентов обеих групп зарегистрирован повышенный уровень эндотелиоцитоза. Должная величина эндотелиемии составляет 5±1,67×105 [11]. При этом, несмотря на отсутствие статистически значимых различий, имелась тенденция к более высокому исходному уровню данного показателя именно в исследуемой группе (на 29,5% по сравнению с контролем). При этом, в дальнейшем, в контрольной группе на фоне применения стандартной инфузионной терапии изменения выше обозначенного маркера эндотелиопатии относительно исходного показателя были незначимы. В исследуемой группе зафиксирована достоверно значимая, стабильная и быстрая нормализация (р=0,031) изначально выраженного эндотелиоцитоза на всех этапах исследования. Уже с 4-го этапа контроля появляются значимые межгрупповые различия (р=0,017) – эндотелиемия в группе исследования ниже на 43,2% по сравнению с контрольной, а к 5-м суткам различие возросло – снижение составило 55,36% (р=0,030) (рис. 1).
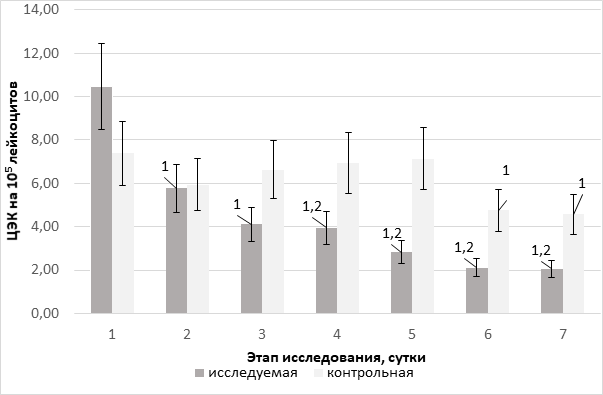
Рис. 1. Уровень эндотелиоцитоза на фоне терапии различными инфузионными средами (×105 лейкоцитов); ЦЭК – циркулирующие эндотелиальные клетки; 1 – достоверность различий относительно исходного показателя в группе (p <0,05); 2 – достоверность межгрупповых различий на этапе исследования (p<0,05)
В настоящее время, по мнению многих исследователей, уровень десквамированных эндотелиальных клеток, в отличие от косвенных маркеров эндотелиопатии, служит прямым и надежным показателем повреждения эндотелия, что все больше находит применение в научных работах [11]. В ряде исследований уже прослеживалась прямая корреляционная связь повышенного количества циркулирующих эндотелиальных клеток у вновь поступивших пациентов с НКИ с тяжестью заболевания, необходимостью госпитализации в ОРИТ и инвазивностью респираторной поддержки [12]. Так, более высокий уровень циркулирующих эндотелиальных клеток был характерен для тяжелых форм НКИ COVID-19, потребовавших госпитализации в ОРИТ и инвазивной вентиляционной терапии. Также на основании динамики уровня циркулирующих эндотелиальных клеток высказывались суждения о длительности активного периода заболевания [12].
Специфическим косвенным маркером эндотелиального повреждения для параллельного изучения нами был выбран уровень гомоцистеинемии. Зарегистрировано исходное повышение этого параметра в обеих группах (30,16±64,59 мкмоль/л в исследуемой против 26,29±62,52 мкмоль/л в группе контроля, р=0,35) при должной его величине у взрослых в пределах 5–15 мкмоль/л. Значимые межгрупповые отличия появляются с 4-х суток терапии, когда концентрация гомоцистеина стала в группе исследования на 12,8% (р=0,042), а на последнем этапе на 49,34% (р=0,014) меньше относительно контрольной группы.
Прогностическую ценность концентрации гомоцистеина в отношении раннего выявления у пациентов высокого риска тяжелых форм течения НКИ COVID-19, прогрессирования заболевания, неблагоприятных исходов уже отмечали как российские [13], так и зарубежные исследователи.
Для достоверности и значимости полученных данных о выраженности эндотелиальной дисфункции оценивали коэффициент корреляции Пирсона (r-Pearson) для динамики эндотелиоцитоза и гомоцистеинемии в обеих группах. Данная связь носила умеренно положительный характер в исследуемой группе (+0,62) и имела обратно пропорциональную слабую зависимость в группе стандартной инфузионной терапии (–0,12). Это, с одной стороны, демонстрирует потенциал сукцинат-содержащих инфузионных сред в коррекции выраженности эндотелиопатии и эндотелиальной деструкции, с другой – явные ограничения информативности уровня гомоцистеинемии как маркера эндотелиального повреждения на фоне стандартного лечения.
На фоне включения в инфузионную программу сукцинат-содержащего раствора, фактически начиная с первого введения и на всех последующих этапах, в исследовательской группе зафиксированы достоверно значимые более высокие уровни парциального напряжения О2 в артериальной крови с максимумом различий на последнем этапе (на 20,3% в сравнении с группой контроля, р=0,002) (рис. 2).
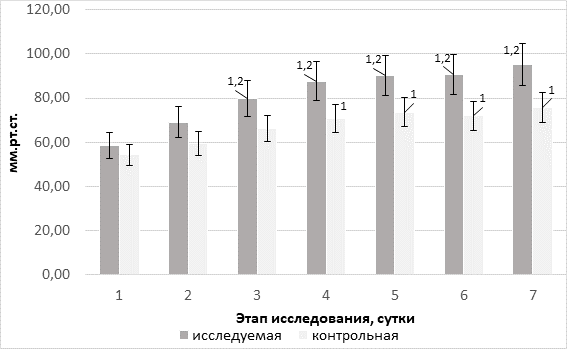
Рис. 2. Динамика уровня парциального напряжения О2 в артериальной крови в группах на фоне терапии различными инфузионными средами; 1 – достоверность различий относительно исходного показателя (p <0,05); 2 – межгрупповая достоверность различий (p<0,05)
Тяжелая гипоксемия в условиях ограниченного альвеолярного поражения (на ранних стадиях заболевания) стала «откровением» в клинико-инструментальной характеристике пациентов с НКИ COVID-19. Сохраненная или слегка сниженная растяжимость, низкая рекрутабельность легких не соответствовали типичной картине острого респираторного дистресс-синдрома. Дальнейшее изучение этого феномена показало вентиляционно-перфузионные нарушения, когда в условиях сохраненного объема газа в легких происходит увеличение легочного кровотока.
Точный механизм подобной гиперперфузии четко не определен. Тем не менее, картина такого стремительного нарастания гипоксемии в соответствии с усилением перфузии согласуется с зависимостью парциального напряжения СО2 и О2 в крови от вентиляционно-перфузионного сопряжения в номограмме H. Rahn и W.O. Fenn (1946).
На фоне коррекции исходно выраженной эндотелиопатии преимущественно в исследуемой группе мы отметили снижение влияния легочного шунтирования, то есть редукцию частичного сброса неоксигенированной венозной крови в артериальное русло. При этом к значимому повышению парциального напряжения О2 в артериальной крови в данном случае может приводить совсем не гипервентиляция, а оправданный выбор инфузионной терапии в пользу сбалансированного кристаллоидного раствора, содержащего субстратный антигипоксант. Вместе с тем, патофизиологическое обоснование выявленных значимых межгрупповых различий в динамике коррекции вентиляционно-перфузионных нарушений при НКИ COVID-19 требует дальнейшего изучения.
В условиях коррекции гипоксемии, особенно на фоне применения препаратов, обладающих антигипоксическим действием, нарастает аэробный метаболизм глюкозы, о чем могут косвенно свидетельствовать усиление ее утилизации, регресс лактатемии и увеличение аэробного образования СО2. Это подтверждают данные, представленные на рисунках 3–5. Такая картина согласуется с результатами авторов, изучавших применение субстратных антигипоксантов при критических состояниях, сопровождающихся гипоксемией и гипоксией [14].
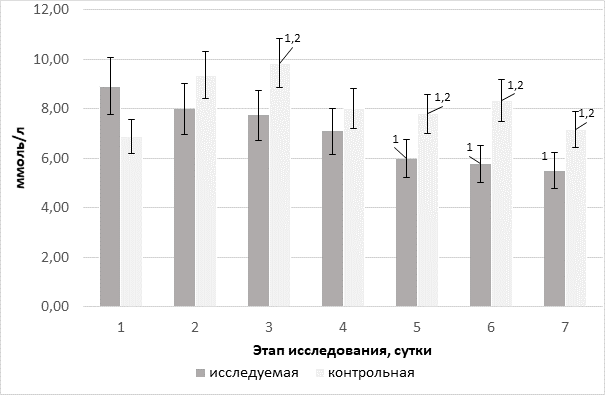
Рис. 3. Динамика уровня глюкозы венозной крови в группах на фоне терапии различными инфузионными средами (ммоль/л); 1 – достоверность различий относительно исходного показателя (p<0,05); 2 – межгрупповая достоверность различий (p<0,05)
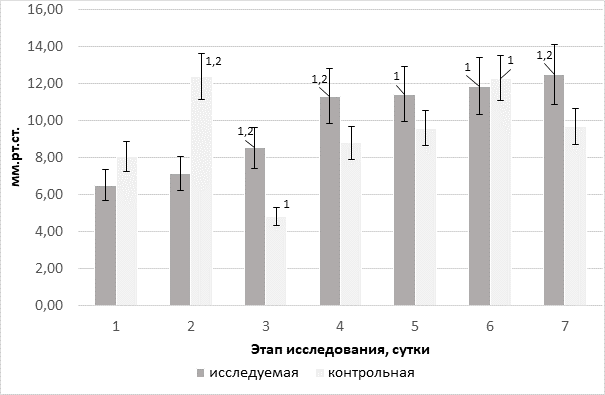
Рис. 4. Динамика уровня вено-артериальной разницы парциального давления CO2 в группах на фоне терапии различными инфузионными средами, мм рт. ст.
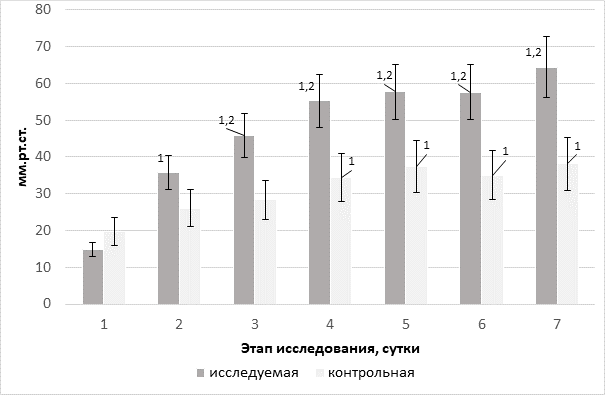
Рис. 5. Динамика артериовенозной разницы парциального давления О2 в группах на фоне терапии различными инфузионными средами, мм рт. ст.
Начиная с 4-х суток (5-го этапа) происходило значимое снижение гликемии в группе исследования, и тогда же зарегистрированы достоверные межгрупповые различия. Такая картина изменений гликемического профиля наряду с регрессией лактатемии может свидетельствовать об эффективной утилизации энергетического субстрата на фоне восстановления потребления О2, купирования тканевой дизоксии.
Как было изложено выше, динамика уровня лактата имеет схожий с гликемией характер в виде снижения параметра в обеих группах (рис. 3), но в исследуемой он носит более выраженный характер. Уже со 2-го дня наблюдения появляются достоверные межгрупповые различия с максимумом к последнему этапу исследования (41,1% в сравнении с группой контроля, p=0,002).
Динамика уровня парциального напряжения CО2 в венозной крови в группе исследования, в отличие от контрольной, на всех этапах носила преимущественно характер роста, с появлением значимого межгруппового различия на последнем отрезке событий (р=0,05).
Прирост вено-артериального разрыва парциального напряжения СО2 в крови пациентов контрольной группы на фоне начала инфузионной терапии может служить ранним чувствительным биомаркером неадекватности сердечного выброса и тканевой гипоперфузии, что неоднократно отмечалось в работах различных авторов [15]. В нашем исследовании мы трактуем дальнейшие изменения (рис. 4) как усиление тканевого аэробного метаболизма, преимущественно на фоне применения антигипоксанта – реамберина в исследуемой группе. Этот факт подтверждается соосным ростом потребности в О2, увеличением экстрагируемого О2 (рис. 5) на фоне усиления продукции СО2 и роста парциального напряжения СО2 в оттекающей от тканей крови. В связи с этим была выявлена высокая линейная корреляция между графиками динамики уровней вено-артериальной разницы парциального напряжения CO2 и индекса экстракции О2 (r=0,92).
Оценка 10-дневной летальности не показала значимой разницы между группами изучения (p=0,485), в отличие от показателя 28-дневного уровня неблагоприятных исходов, который составил 7,4% в исследуемой группе и 34,6% в группе контроля (p=0,0327). На фоне коррекции COVID-19-ассоциированной эндотелиопатии, способствующей купированию гипоксемии, в группе меглюмина натрия сукцината (реамберина) мы наблюдали снижение риска перевода на инвазивную респираторную поддержку в 1,9 раза по сравнению с контрольной группой (p=0,0327).
Заключение. COVID-19-опосредованная эндотелиопатия – причина нетипичной картины легочного поражения, когда на фоне нарушенных взаимоотношений вазоконстрикции/вазоплегии, микротромбообразования развивается выраженный дисбаланс вентиляционно-перфузионных отношений. Уровень циркулирующих эндотелиальных клеток при НКИ COVID-19, служа прямым и надежным показателем эндотелиопатии, в отличие от косвенных маркеров повреждения, имеет высокую прямую корреляционную связь с тяжестью и течением заболевания, необходимостью госпитализации в ОРИТ и инвазивностью респираторной поддержки. Введение в инфузионную стратегию сукцинат-содержащего раствора позволило достичь стойкой коррекции утраченных регуляторных механизмов эндотелия с последующим восстановлением физиологического вентиляционно-перфузионного баланса, купирования гипоксемии, активации процессов аэробного окисления и оптимизации процессов внутриклеточного аэробного метаболизма.
Вывод. Раннее включение в состав терапии тяжелых форм новой коронавирусной инфекции COVID-19 1,5%-ного раствора меглюмина натрия сукцината в сравнении со стандартной терапией приводит к существенной и стойкой коррекции исходно выраженной эндотелиальной дисфункции, дыхательной и тканевой гипоксии, снижению частоты перевода пациента на искусственную вентиляцию легких и 28-дневной летальности.
Библиографическая ссылка
Николаева О.В., Симутис И.С., Ратников В.А., Бояринов Г.А., Сапегин А.А., Гайковая Л.Б., Евтеева Д.А., Замятина К.Н. ПОТЕНЦИАЛ ИНФУЗИОННОЙ ТЕРАПИИ В КОРРЕКЦИИ COVID-19-АССОЦИИРОВАННОЙ ЭНДОТЕЛИОПАТИИ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32532 (дата обращения: 24.02.2026).
DOI: https://doi.org/10.17513/spno.32532



