Тромбоз синусов головного мозга (ТСГМ) отогенной этиологии – редкое, но опасное внутричерепное осложнение острого или хронического среднего отита, мастоидита у детей. Согласно литературным данным, его распространенность составляет до 2,7% и среди всех отогенных внутричерепных осложнений у детей по частоте развития занимает 3–4-ю позицию, достигая 12% [1, 2, 3]. Несвоевременная диагностика и оказание медицинской помощи детям с данной патологией имеют прямую корреляцию с высокими рисками развития неблагоприятных исходов, частота которых может составлять 5–10% [3]. ТСГМ отогенной этиологии имеют полимикробную этиологию, что необходимо учитывать при выборе эмпирической и этиотропной антибактериальной терапии (АБТ). По данным ряда авторов, при данной патологии высеваются Streptococcus spp., P.aeruginosa, P mirabilis, S.aureus, F.necrophorum, H.influentiae и др. [4, 5, 6]. Обязательным компонентом ведения таких пациентов является назначение антикоагулянтной терапии, своевременное использование которой позволяет снизить риск фатальных исходов и тяжелой инвалидизации [7]. Отношение к данной терапии, согласно литературным данным, у авторов неоднозначно, поскольку ее применение сопряжено с высокими рисками развития геморрагических осложнений [3, 6, 8].
Цель исследования: установить распространенность ТСГМ отогенной этиологии у детей, особенностей клинической картины, микробного пейзажа, тактики оказания медицинской помощи детям с данной патологией.
Материалы и методы исследования. Ретроспективный анализ 21 законченного случая пациентов с ТСГМ отогенной этиологии, госпитализированных в детское ЛОР-отделение ГБУЗ ТО «ОКБ № 2» г. Тюмени за период 2009–2021 гг. Всего под наблюдением находились 15 (71,4%) пациентов мужского и 6 (28,6%) женского пола в возрасте от 3 до 17 лет (средний возраст – 7,3±1,1 года).
Для включения пациентов в исследование была проведена оценка наличия острых или хронических воспалительных заболеваний среднего уха, сопровождающихся течением ТСГМ, подтвержденных с помощью компьютерной томографии (КТ) головы с внутривенным контрастированием, магнитно-резонансной томографии (МРТ). Были изучены клинические, лабораторные показатели, результаты микробиологического исследования материала из операционной раны, характер оказания медицинской помощи, в том числе объем медикаментозной терапии. Исследование выполнено в соответствии с принципами Хельсинкской декларации. Протокол исследования одобрен комитетом по этике при ФГБОУ ВО Тюменский ГМУ Минздрава России (протокол № 111). Полученные результаты были обработаны с помощью пакета прикладных программ Microsoft Office Excel 2011 для ОС Windows, а также статистического пакета STATISTICA 10.0 (Stat Soft Inc., США). Значения непрерывных величин представлены в виде M±m, где M – выборочное среднее арифметическое, m – стандартная ошибка среднего.
Результаты исследования и их обсуждение. ТСГМ был выявлен у 0,2% детей с патологией уха, пролеченных за изученный период в детском ЛОР-отделении, что составило 12,2% всех отогенных осложнений. При анализе клинико-лабораторных параметров обнаружено, что при поступлении средние показатели температуры тела составили 37,2±0,2°С, что не указывало на наличие у детей выраженного инфекционного процесса. Однако со стороны крови как универсальной внутренней среды отмечались изменения, характерные для воспалительного процесса и гиперкоагуляции. В общем анализе крови при поступлении средние показатели лейкоцитов находились на уровне 13,5±3,86х109/л (референтные значения – 5,0–14,5х109/л) с колебаниями от 61,6х109/л до 1,61х109/л. Показатели С-реактивного белка колебались от 20 мг/л до 113,3 мг/л (референтные значения – 0–10 мг/л). Уровень тромбоцитов составил 408,1±47,1х109/л (референтные значения – 180–320х109/л) с максимальными значениями 738,0х109/л, что свидетельствовало о течении инфекционного процесса. Средние показатели уровня фибриногена были выше нормальных показателей (4,93±0,5 г/л, при референтных значениях 1,8–4 г/л), что могло свидетельствовать как о наличии воспалительного процесса, так и о состоянии умеренной гиперкоагуляции. Значения активированного частичного тромбопластинового времени (АЧТВ) до назначения нефракционированного гепарина (НФГ) находились на нижней границе нормы с тенденцией к умеренной гиперкоагуляции – 23,37±7,19 сек (референтные значения – 26–40 сек). Всем детям для верификации диагноза ТСГМ с диагностической целью были проведены КТ и МРТ с контрастированием. Локализация ТСГМ представлена на рисунке 1.
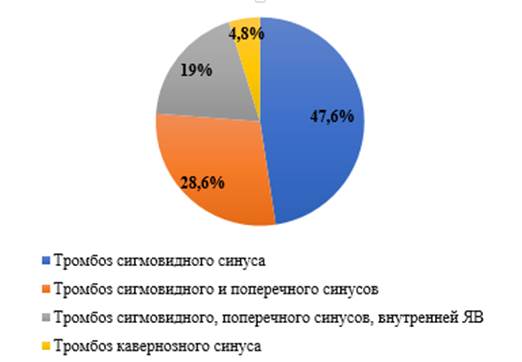
Рис. 1. Локализация тромбозов интракраниальных синусов отогенной этиологии у детей
Как видно из рисунка, чаще встречались поражения сигмовидного синуса, при этом в одном случае отогенный тромбоз сигмовидного синуса развился у ребенка с наследственным дефицитом VIII фактора (гемофилия А средней степени тяжести), получающего заместительную терапию. Были выявлены различные варианты дефектов прохождения контраста в сигмовидном синусе: от пристеночных от 0,5 см до нарушения прохождения контраста в проекции поперечного, сигмовидного синуса, луковицы яремной вены на протяжении до 4,2 см с сужением просвета тромботическими массами до 0,1–0,2 см.
При оказании медицинской помощи детям с ТСГМ был использован способ раннего оперативного вмешательства: расширенная антромастоидотомия, миринготомия или шунтирование, в 23,8% случаев выполнено вскрытие, дренирование сигмовидного, поперечного синуса до получения частичного кровотока с удалением септического тромба и последующей пластикой стенки синуса тахокомбом; в 4,8% случаев – удаление септического тромба из сигмовидного синуса и луковицы яремной вены.
У всех детей в ходе оперативного вмешательства был взят биологический материал из первичного очага (барабанная полость, сосцевидный отросток, сигмовидный синус) для микробиологического исследования. Анализ всех результатов микробиологического исследования материала из раны выявил, что рост получен в 54,3% случаев. Спектр выделенной микрофлоры при ТСГМ представлен на рисунке 2.
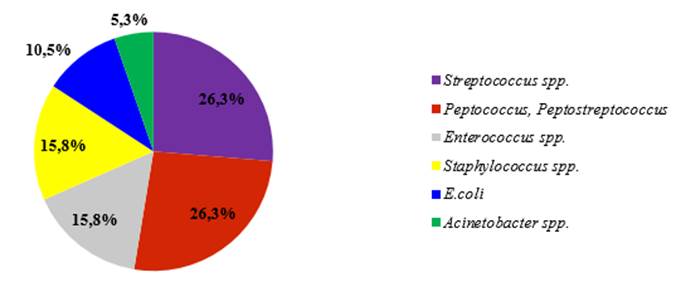
Рис. 2. Микробный пейзаж при тромбозе церебральных венозных синусов
Среди представителей Streptococcus spp. лидирующие позиции занимал пиогенный стрептококк. Анаэробная микрофлора была представлена Peptococcus spp. и Peptostreptococcus spp. Третью позицию занимали Enterococcus spp., относящиеся к условно-патогенной микрофлоре толстого кишечника. На четвертом месте в структуре выделенной микрофлоры расположилась E.coli, являющаяся представителем порядка Enterobacterales и относящаяся к нормальной микрофлоре кишечника. В единичных случаях высевалась Acinetobacter baumannii.
Анализ локальной антибиотикорезистентности выделенных микроорганизмов выявил, что штаммы Streptococcus spp. были чувствительны в 100% случаев только к резервному антибиотику – ванкомицину, к другим тестируемым антибиотикам чувствительность колебалась от 63,3 до 87,9%. Все штаммы E.coli не продуцировали ß-лактамазы расширенного спектра действия (БЛРС) и характеризовались хорошей чувствительностью к карбапенемам, амикацину, ципрофлоксацину. В отношении выделенных штаммов A. baumannii максимальную активность проявили только цефоперазон/сульбактам и карбапенемы. Штаммы Enterococcus spp. только в одном случае были устойчивы к ампициллину, к остальным титруемым антибиотикам (гентамицин, ванкомицин) чувствительность составляла 100%.
Так как отогенный ТСГМ является осложнением гнойного процесса, всем детям при поступлении с учетом предполагаемой микрофлоры назначалась эмпирическая АБТ препаратами, хорошо проникающими через гематоэнцефалический барьер (ГЭБ), в септических дозировках. Чаще использовались цефалоспорины III–IV поколений (цефотаксим, цефтриаксон, цефепим), при абсцедирующем процессе – в сочетании с метронидазолом, из карбапенемов назначался меропенем. Коррекцию АБТ проводили через 48–72 часа при отсутствии положительной динамики по результатам микробиологического исследования. При высеве метициллин-резистентных штаммов стафилококков либо ампициллин/гентамицин-резистентных штаммов энтерококков в терапию добавляли ванкомицин. Средняя продолжительность АБТ составила 20,3±1,6 дня с максимальными показателями 30 дней при наличии у ребенка ТСГМ в сочетании с абсцессом головного мозга, что согласуется с литературными данными [9, 10]. Параллельно с АБТ проводилась антикоагулянтная терапия НФГ. Контроль адекватности дозирования НФГ осуществляли с помощью мониторирования АЧТВ, доводя дозу препарата до состояния гипокоагуляции (60–85 секунд). Средние суточные дозы назначенного НФГ составили 187,9±19,6 ЕД/кг (с максимальными показателями 294,1 ЕД/кг в сутки). Ребенку, страдающему гемофилией А, антитромботическую терапию проводили низкомолекулярным гепарином (эноксапарином), который назначался off-label (оформление протокола решения врачебной комиссии, добровольного информированного согласия официальных представителей ребенка) на фоне усиления заместительной терапии VIII фактором (согласно официальной инструкции разрешен в педиатрической практике) [11]. В среднем на 7,6±0,3 сутки к терапии НФГ добавляли разрешенный у детей, согласно официальной инструкции, пероральный антикоагулянт – варфарин в стартовой дозе 0,1–0,2 мг/кг/сут с последующей коррекцией дозы для достижения целевого уровня международного нормализованного отношения (МНО) от 2,0 до 3,0 с постепенной отменой НФГ [11]. Терапия варфарином продолжалась в условиях стационара в течение 17,8±2,8 дня с последующим контролем КТ-картины. Ребенок с тромбозом сигмовидного синуса отогенной этиологии, возникшей на фоне гемофилии А, терапию пероральными антикоагулянтами не получал ввиду высоких рисков геморрагических осложнений. В среднем на 24±2,26 сутки пациенты были выписаны с выздоровлением без неврологического дефицита. На фоне антикоагулянтной терапии ни в одном случае не отмечались геморрагические осложнения. По результатам контрольной КТ полная реканализация церебральных синусов наступила в среднем через 3–6 месяцев.
ТСГМ – редкое, но тяжелое осложнение инфекционно-воспалительной патологии среднего уха у детей с показателями летальности до 10% [3]. Своевременная диагностика, полный объем оказания медицинской помощи, включая оперативные вмешательства и медикаментозную терапию, существенно снижают риски неблагоприятных исходов. Выбор адекватной АБТ при ТСГМ обычно затруднен в связи с поздним получением результатов микробиологического исследования, что требует знаний о возможных возбудителях данной патологии. При верификации диагноза отогенного ТСГМ до получения результатов микробиологического исследования назначают эмпирическую АБТ с учетом предполагаемого возбудителя. По данным ряда авторов, при данной патологии высеваются Streptococcus spp., P.aeruginosa, P.mirabilis, S.aureus, F.necrophorum, H.influentiae и др. [4, 5, 6]. А такие патогены, как S.aureus, S.pyogenes, P.aeruginosa, E.coli, K.pneumoniae, H.influenzae, увеличивают вероятность тромботических осложнений. Это связано с вызванной данными микроорганизмами системной воспалительной реакцией и высвобождением цитокинов ИЛ-6, ИЛ-8 и фактора некроза опухоли альфа, что ведет к повреждению эндотелия, активации и агрегации тромбоцитов, увеличению прокоагулянтных белков, таких как тканевой фактор, и снижению активности антикоагулянтных механизмов, таких как фибринолиз [12, 13].
При выборе АБТ при отогенных внутричерепных осложнениях необходимо учитывать проницаемость препаратов через ГЭБ. Большинство авторов при отогенных внутричерепных осложнениях в качестве стартовых препаратов рекомендуют цефалоспорины 3–4-го поколений в сочетании (при наличии абсцесса) с антианаэробными препаратами – метронидазолом либо клиндамицином [9, 10, 14]. Данные препараты, кроме клиндамицина, характеризуются умеренным проникновением через ГЭБ, что требует использования их в максимальных дозировках [15]. В нашем исследовании в качестве антианаэробного препарата использовался метронидазол, поскольку для клиндамицина характерно незначительное проникновение через ГЭБ, даже при наличии воспаления мозговых оболочек. С учетом нарастания устойчивости этиологически значимых в развитии отогенных интракраниальных осложнений микроорганизмов большинство авторов указывают на альтернативную цефалоспоринам 3–4-го поколений терапию меропенемом, разрешенным в педиатрической практике с 3-месячного возраста [3, 10, 14].
Для уменьшения вероятности прогрессирования тромбообразования обязательным компонентом терапии ТСГМ является назначение антикоагулянтной терапии, что позволяет снизить риск фатальных исходов и тяжелой инвалидизации [7]. Неоднозначное отношение к данному виду терапии у детей связано со многими факторами, такими как: несовершенство системы гемостаза у ребенка, вероятность различных межлекарственных взаимодействий этих препаратов с другими лекарственными средствам, высокие риски развития побочных эффектов, отсутствие детских лекарственных форм антитромботических средств [16, 17, 18]. Авторы рекомендуют проводить антикоагулянтную терапию только при наличии признаков гиперкоагуляции, что наблюдалось в нашем исследовании, либо при ухудшении неврологической симптоматики на фоне адекватных АБТ и хирургического вмешательства. Антикоагулянтную терапию начинают с внутривенного введения НФГ с подбором дозы для достижения интервала АЧТВ в 60–85 сек [7]. Альтернативой НФГ является подкожное введение низкомолекулярных гепаринов (НМГ) – дальтепарина натрия, эноксапарина [3, 7, 17]. Несмотря на преимущества НМГ у детей с тяжелым ТСГМ [2, 8, 19], мы использовали данную группу препаратов только в одном случае – у ребенка с наследственным дефицитом VIII фактора свертывания крови. В педиатрической практике из пероральных антикоагулянтов разрешен варфарин (официальная инструкция на лекарственный препарат) [11]. В исследовании G.Coutinho et al. продемонстрирована эффективность длительной терапии (в среднем 9 месяцев) варфарином при тромбозе церебральных сосудов в педиатрической практике [17]. При использовании варфарина в терапии венозных тромбозов необходимо достигать состояние гипокоагуляции (диапазон МНО – 2,0–3,0), поскольку было продемонстрировано, что при показателях МНО <2,0 увеличивается риск тромботических осложнений, а при МНО >3,0 – риск кровотечений [20]. Однако в педиатрической практике существуют определенные трудности в подборе доз варфарина. Это связано и с генетическими особенностями метаболизма препарата, особенностями питания детей в различные возрастные периоды (нестабильная концентрация витамина К в грудном молоке, употребление пищи, богатой витамином К: свежей зелени, зеленых овощей – существенно снижают эффективность данного антикоагулянта) [11]. Необходимо помнить и о всевозможных взаимодействиях варфарина с другими препаратами. Эти взаимодействия могут сопровождаться либо уменьшением антикоагулянтной эффективности варфарина (метамизол натрия, фенобарбитал, глюкокортикостероиды, аскорбиновая кислота, витамин К и некоторые другие), либо усилением действия антикоагулянта с увеличением риска развития геморрагических осложнений (практически все цефалоспорины, антибиотики из группы макролидов – азитромицин, кларитромицин, эритромицин; некоторые пенициллины; гипосекреторные средства – омепразол, эзомепразол и др.; нестероидные противовоспалительные препараты – диклофенак, ибупрофен и др.) [11].
Таким образом, терапия ТСГМ является трудной задачей не только при проведении хирургического вмешательства, но и в подборе оптимального объема медикаментозной терапии, что требует при оказании медицинской помощи междисциплинарного подхода.
Заключение. Своевременная диагностика и специализированная междисциплинарная помощь позволяют избежать тяжелых осложнений и добиться полного выздоровления при ТСГМ даже у детей с наследственным дефицитом VIII фактора свертывания крови.
Библиографическая ссылка
Вешкурцева И.М., Кузнецова Н.Е., Извин А.И., Кудымов С.А., Синяков А.Ю., Пономарева М.Н. НАШ ОПЫТ ВЕДЕНИЯ ДЕТЕЙ С ТРОМБОЗОМ СИНУСОВ ГОЛОВНОГО МОЗГА ОТОГЕННОЙ ЭТИОЛОГИИ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32496 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/spno.32496



