Отдельное место среди материалов, применяемых для внедрения в клинике и эксперименте, занимают биодеградируемые материалы, которые деструктируются без инкапсуляции соединительной тканью. С целью практического применения особо привлекательны изделия из коллагена, главным образом, из-за хороших прочностных характеристик, деформируемости, упругости, биосовместимости, относительно быстрой деградации без остаточных фрагментов [1].
Вместе с этим отдельные публикации демонстрируют возможность образования соединительнотканной капсулы в тканях организма вокруг лизируемых шовных материалов, созданных из коллагена, и развития гранулематозного воспалительного процесса на внедрение таких изделий [2, 3]. Кроме этого, есть результаты работ, которые показывают, пусть и косвенно, вероятность запуска неблагоприятных процессов после имплантации других изделий из коллагена [4, 5].
Мультипотентные стромальные клетки (МСК) в настоящее время достаточно широко используют в регенеративной медицине вследствие их важного значения для тканевой репарации. В клинике и эксперименте МСК чаще всего вводят в ткани в виде суспензии или на матрицах. Коллагеновые материалы очень часто применяют в качестве матриц для доставки МСК в различные ткани организма. Значительная часть работ, посвященных использованию коллагена для изготовления 2- и 3-мерных скаффолдов для МСК, описывают замечательные результаты выживаемости МСК, даже при постепенном разрушении матрицы [6–8].
Вместе с этим научные публикации содержат явно недостаточно результатов о воздействии МСК, адсорбированных на коллагене, на процессы его взаимодействия с тканями живого организма. В связи с вышеизложенным была определена цель исследования: изучить морфологическими методами тканевые реакции на внедрение коллагена после пассивной адсорбции мезенхимальных МСК (ММСККП) в эксперименте.
Материал и методы исследования. В экспериментах были использованы самцы крыс инбредной линии Wag возрастом 6 месяцев и массой 180–200 г. Все манипуляции не были связаны с причинением крысам боли и были проведены с соблюдением ГОСТ 33215-2014 (Руководство по содержанию и уходу за лабораторными животными).
Методы получения, выращивания, характеризации и возможностей дифференцировки ММСККП находились в соответствии с данными литературы [9, 10]. Липиды цитоплазматических мембран ММСККП были мечены Vybrant® CM-Dil (Thermo Fisher Scientific, USA) [9]. Как коллаген применяли Коллост» (ООО «БиоФАРМАХОЛДИНГ», Россия). Ex tempore из коллагена размером 60х50х1,5 мм вырезали более мелкие фрагменты размером около 5х5 мм, на которые пассивно адсорбировали ММСККП: мембраны оставляли в клеточной взвеси на 120 мин.
Коллаген имплантировали подкожно следующим образом: разрезали кожу на спине на 10–20 мм от основания черепа до лопаток. Мембрану из коллагена с или без адсорбированных ММСККП имплантировали в канал длиной 15–20 мм, сформированный в сторону от разреза. Крыс декапитировали спустя 1; 2; 3 и 4 недели после хирургического вмешательства с внедрением коллагена и ММСККП [9, 10]. В каждой группе на каждую точку наблюдения было 12 животных, всего 96 крыс.
Клетчатку с остатками коллагена фиксировали в 4%-ном растворе параформальдегида в течение 24 часов, обезвоживали в спиртах, просветляли в реактиве «Изопреп» (БиоВитрум, Россия) и заключали в пластифицированный парафин. Гистологические срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином, исследовали при увеличении до 1200 раз на световом микроскопе Axioimager M1 (Carl Zeiss, Germany). Кроме того, неокрашенные срезы изучали в люминесцентном режиме указанного микроскопа с фильтрами Alexa Fluor 488 и для родамина.
Измерения изображений были сделаны на экране компьютера, применяли комплекс программ Axiovision (Zeiss, Германия) для морфометрии. На протяжении первой недели после операции инфильтрация клетками и прорастание сосудов клеточных элементов и сосудов были найдены только по краям коллагена, поэтому были исследованы периферические отделы внедренных мембран (до 0,5 см от края).
Статистический анализ полученных морфометрических численных данных проводили на программе MS Excel 7.0 (Microsoft, USA), были получены среднее арифметическое и стандартное отклонение. Статистическую значимость различий сравниваемых полученных вариационных рядов устанавливали с использованием критерия Стьюдента. Статистически значимым считали отличие между сравниваемыми средними с уровнем доверительной вероятности не менее 95%, при этом было учтено, что распределение полученных величин значений было нормальным или близким к таковому.
Результаты исследования и их обсуждение. Адсорбция на коллагеновой мембране ММСККП, а также их дифференцировка в сосуды с последующей элиминацией через макрофагальную адсорбцию были показаны ранее при использовании люминесценции. Через 1 неделю после применения коллагена с адсорбированными ММСККП рядом с имплантатом были найдены типичные очень мелкие сосуды с однослойной оболочкой, которая очень интенсивно флюоресцировала при установке фильтра для родамина (рис. 1). На 2-й неделе и последующие сроки на периферии коллагенового материала и рядом с имплантатом на фоне применения родаминового фильтра красным цветом светились только мелкие включения в макрофагах [9].
Также уже были описаны особенности биодеградации коллагенового материала. Обнаружено, что из-за значительного ангиогенеза и инфильтрации лейкоцитами вследствие адсорбции на коллагене ММСККП к 4-й неделе вся мембрана подвергается деструкции и лизису макрофагами, а на месте имплантата присутствует только плотная волокнистая соединительная ткань [10].
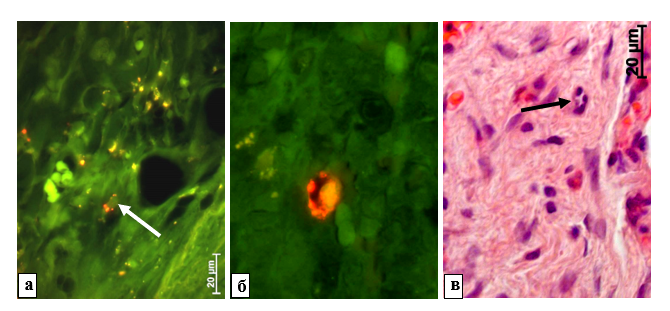
Рис. 1. Край коллагенового материала на 1-й неделе после имплантации с адсорбированными ММСККП. а – Макрофаги (стрелка) с оптически темным центром содержат в цитоплазме множество мелких овальных включений с очень ярким свечением в условиях использования фильтра для родамина. б – Сосуд со сформированным просветом и тонкой однослойной стенкой из ярко светящихся при установке родаминового фильтра клеток. в – Мелкий сосуд с пустым просветом и однослойной оболочкой (стрелка), ядра эндотелиоцитов выступают в просвет сосуда. а, б – Результат совмещения флюоресцентных изображений с применением фильтров Alexa 488 и для родамина. в – Окраска гематоксилином и эозином
После внедрения коллагена без ММСККП процент, занимаемый кровеносными сосудами на краю имплантата спустя 3 и 4 недели после его внедрения, стал больше в 2,1 раза, чем на 1-й неделе (таблица). Постепенно происходит прорастание сосудов в мембрану, и этот процесс начинается с границ материала.
Структурная организация периферии имплантированной коллагеновой мембраны (S±σ)
|
Параметр |
Срок после имплантации |
|||||
|
1 неделя |
2 недели |
3 недели |
4 недели |
|||
|
а |
б |
в |
г |
д |
||
|
Имплантация без ММСККП |
||||||
|
Кровеносные капилляры (АА) |
3,47±1,06г, д |
5,53±0,915 |
7,2±0,941б |
7,27±0,961б |
||
|
Коллагеновая мембрана и соединительная ткань (АА) |
89,9±2,5 в, г, д |
67,6±2,23б, г, д |
50,7±2,87б, в |
57,3±1,84б, в |
||
|
Численная плотность клеток (NA) |
223±49,2в, г, д |
373±45,8б |
547±113б |
600±113б |
||
|
Лимфоциты ( %) Лимфоциты (NA) |
53,5±3,6г 120±27,6д |
47,6±3,64г 177±24,1 |
32,3±4,65б, в 174±32,9 |
45,2±4,55 270±55,1б |
||
|
Нейтрофилы ( %) Нейтрофилы (NA) |
20,8±2 г, д 46,7±13 |
16±1,89г, д 59,7±9,53 |
9,4±1,12б, в 50,6±8,25 |
8,07±0,961б, в 48,2±10,1 |
||
|
Макрофаги ( %) Макрофаги (NA) |
15,9±2,05в, г, д 35,3±8,6в, г, д |
24,6±2,35б, г 91,9±14,5б |
40,3±4,51б, в, д 223±64,3б |
26,4±3,27б, г 159±36,2б |
||
|
Имплантация после пассивной адсорбции ММСККП |
||||||
|
Кровеносные капилляры (АА) |
11,7±1,68д* |
9,6±1,18д* |
7,8±1,42д |
2,8±0,862 б, в, г* |
||
|
Коллагеновая мембрана и соединительная ткань (АА) |
73,9±1,75в, г* |
64,8±1,32б, д |
60,9±2,7б, д* |
77,9±1,58в, г* |
||
|
Численная плотность клеток (NA) |
371±34в, г, д* |
593±88,4б, д* |
640±118б, д |
221±44,3б, в, г * |
||
|
Лимфоциты ( %) Лимфоциты (NA) |
46,5±3,58г 173±24,6 |
41,1±5,12д 245±55,1 |
29,7±5,39б, д 192±57,6 |
55,2±3,78в, г 123±29,3* |
||
|
Нейтрофилы ( %) Нейтрофилы (NA) |
16,9±1,94г, д 63,2±11,3д |
16,1±3,18г, д 94,5±16,1г, д |
8,53±1,51б, в 54,1±11,9в, д |
8,2±1,37б, в 18±4,13б, в, г* |
||
|
Макрофаги ( %) Макрофаги (NA) |
24±3,21г* 88,7±11,8 в, г* |
28,3±2,41г 168±26,2б, д* |
41,6±3,94б, в, д 265±49,5б, д |
25,5±2,13г 56,2±11,5в, г* |
||
Примечание: АА – относительная площадь структур на срезе (%). NA – численная плотность клеток на 105 мкм2 площади среза. б, в, г, д – величины, статистически значимо различающиеся между собой в данных колонках (р≤0,05). * – величины, статистически значимо отличающиеся от соответствующих у животных после имплантации без ММСККП (р≤0,05).
Как результат применения ММСККП следует отметить, что площадь кровеносных сосудов на 1-й и 2-й неделях стала больше в 3,4 раза и на 73,6% соответственно, а к 4-й неделе, наоборот, сократилась в 2,6 раза, чем на такие же сроки после имплантации без ММСККП (таблица).
Согласно литературным данным, трансплантация ММСККП в ткани после операции приводит к их дифференцировке в клетки сосудистых оболочек [9] и увеличению численности сосудов грануляционной ткани. По-видимому, за счет этого быстро нарастает васкуляризация периферии коллагеновой мембраны, что способствует миграции в коллаген клеток и более быстрой его деградации. По мере разрушения изделия, более быстрого, чем при естественном процессе, воспаление, индуцированное операцией и поддерживаемое присутствием лизируемого коллагена, затихает, и там уменьшается количество сосудов [10].
На фоне внедрения мембраны без ММСККП плотность клеточной инфильтрации края коллагена спустя 2; 3 и 4 недели увеличилась соответственно на 67,3%; в 2,5 и 2,7 раза по сравнению с состоянием на 1-й неделе (таблица). Рост лейкоцитарной инфильтрации края имплантата является свидетельством как ускорения его деструкции, так и увеличивающейся активности асептического воспаления, поддерживаемого наличием самого коллагена.
Содержание лимфоцитов среди всех клеток на краю коллагена на 3-й неделе стало ниже на 65,6% и 47,4%, чем на 1-й и 2-й неделях соответственно. Численная плотность этих клеток к 4-й неделе по сравнению с 1-й неделей увеличилась в 2,3 раза (таблица).
Среди клеток на краю коллагена нейтрофильных лейкоцитов на 3-й неделе стало меньше в 2,2 раза и на 70,2%, чем на 1-й и 2-й неделях соответственно. А на 4-й неделе было меньше уже в 2,6 раза и на 98,3% также относительно состояния на 1-й и 2-й неделях и также соответственно (таблица).
Уменьшение процента лимфоцитов и нейтрофилов при нарастании численной плотности лимфоцитов указывает, что воспалительная реакция вокруг коллагеновой мембраны, в том числе и на ее границах, обусловлена не присоединением инфекции, а является асептической и поддерживается, скорее всего, присутствием самого инородного коллагенового материала в тканях организма.
Процентное количество макрофагов на 1-й неделе было ниже на 54,7%; в 2,5 раза и на 66% относительно 2-й; 3-й и 4-й недель соответственно. При этом к 3-й неделе величина таких фагоцитов было больше на 63,8% и 52,7%, чем спустя 2 и 4 недели, также соответственно. Плотность макрофагов к 2-й; 3-й и 4-й неделям возросла относительно состояния на 1-й неделе соответственно в 2,6; 6,3 и 4,5 раза (таблица). По-видимому, в основном процессы деградации коллагенового изделия идут через лизис макрофагами, что совпадает с нашими ранее опубликованными результатами [10] и данными других исследователей [11]. В связи с этим количество макрофагов в лизируемом материале постепенно нарастает.
В результате адсорбции ММСККП плотность лейкоцитов в инфильтрате на 1-й и 2-й неделях возросла соответственно на 66,4% и 59%, тогда как на 4-й неделе, наоборот, сократилась в 2,7 раза, чем на указанные даты после внедрения чистого коллагена, без ММСККП. Абсолютное содержание лимфоцитов и нейтрофилов к 4-й неделе после операции было меньше соответственно в 2,2 и 2,7 раза по сравнению с этой же 4-й неделей после применения инородного тела без адсорбированных ММСККП (таблица).
Во-первых, такой эффект может быть связан с самими ММСККП, которые после имплантации с коллагеном мигрируют в его край, где и дифференцируются в клеточные элементы сосудистых оболочек [9]. Во-вторых, усиление васкуляризации в результате применения ММСККП облегчает миграцию различных клеток из сосудистого русла непосредственно в коллаген. Там клетки появляются раньше, и их численность растет быстрее. В-третьих, сами ММСККП и их детрит обладают какой-то антигенностью [12, 13], скорее всего, приобретенной при стимулированной пролиферации во время поддержания в культуре. Вследствие этого к таким ММСККП, а тем более к их детриту мигрируют фагоциты, и за счет этого на краю коллагенового изделия возрастает содержание клеток. Кроме того, фагоциты, движущиеся к детриту ММСККП, параллельно лизируют и сам коллаген, ускоряя его деградацию [4, 5, 10], давая возможность роста сосудов при ангиогенезе и миграции различных клеток, например фибробластов. По мере исчезновения инородного коллагенового материала затихает и воспаление, связанное с его присутствием в тканях, что, не исключено, служит главной причиной резкого сокращения общей клеточной инфильтрации, содержания лимфоцитов и нейтрофилов на 4-й неделе.
Процент макрофагов на 1-й неделе и их абсолютное количество через 1 и 2 недели были больше на 50,9%; в 2,5 раза и на 82,8% соответственно, чем на эти же 1 и 2 недели после использования коллагена без ММСККП. При этом к 4-й неделе численная плотность таких фагоцитов после применения клеточных технологий стала уже меньше в 2,8 раза (таблица).
В ткани вместе с коллагеновой мембраной попадают ММСККП, часть из которых нежизнеспособна и быстро подвергается деструкции, к таким местам активно мигрируют макрофаги [9] и инфильтрируют край коллагеновой мембраны. Из-за этого на периферии изделия в первые сроки резко растет количество макрофагов, которые лизируют и поглощают не только клеточный дебрис, происходящий из ММСККП, но и сам инородный коллаген. В результате деструкция имплантата происходит быстрее [10], снижается активность воспалительной реакции, поддерживаемой инородным телом. Вследствие полного разрушения инородного тела и стихания воспалительного процесса через 4 недели в тканях на месте коллагена уменьшается не только общее количество лейкоцитов, но и содержание макрофагов.
Выводы
1. Сразу после подкожной имплантации коллагена инициируется асептический воспалительный процесс, сначала в ответ на операцию с повреждением тканей для внедрения инородного материала, а затем – на само присутствие в организме чужеродного объекта.
2. После имплантации в подкожную клетчатку крыс коллагеновой мембраны из окружающих тканей в ее периферию прорастают сосуды и мигрируют клетки. Численность сосудов и клеточных элементов резко нарастает до 3-й недели и остается на этом уровне до окончания полной деструкции инородного тела.
3. Отличительной особенностью применения коллагеновой мембраны с адсорбированными ММСККП являются отмеченные на периферических отделах через 1 и 2 недели после операции усиление васкуляризации (в том числе и за счет формирования сосудов с участием введенных ММСККП) в 3,4 раза и на 73,6%, соответственно, и клеточной инфильтрации, возможно, вследствие привлечения иммунокомпетентных клеток детритом ММСККП, на 66,4% и 59%, также соответственно. Такой эффект клеточных технологий в дальнейшем приводит к более быстрой деградации всего имплантированного коллагена, в том числе и более плотных его участков. Сразу после полного лизиса инородного материала резко падает выраженность воспаления: снижаются васкуляризация и клеточная инфильтрация тканей.
4. В течение 2–3 недель все ММСККП, введенные в ткани вместе с коллагеновой мембраной, разрушаются и фагоцитируются макрофагами, одновременно исчезают структуры, созданные из этих ММСККП в результате их дифференцировки. Возможно, что, разрушаясь, ММСККП стимулируют миграцию иммунокомпетентных клеток к своему детриту в силу определенной его антигенности. Лейкоциты фагоцитируют и лизируют не только дебрис ММСККП, но и коллагеновую матрицу, на которой эти клеточные элементы были внесены в организм, что также способствует более быстрой деструкции внедренного коллагена.
Библиографическая ссылка
Хоменюк С.В., Шевела А.И., Клинникова М.Г., Майбородин И.В. МОРФОЛОГИЧЕСКИЕ РЕЗУЛЬТАТЫ ИМПЛАНТАЦИИ КОЛЛАГЕНОВОЙ МЕМБРАНЫ С АДСОРБИРОВАННЫМИ МУЛЬТИПОТЕНТНЫМИ СТРОМАЛЬНЫМИ КЛЕТКАМИ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32478 (дата обращения: 06.03.2026).
DOI: https://doi.org/10.17513/spno.32478



