Анапластический рак (АР) щитовидной железы (ЩЖ) является одним из самых агрессивных и прогностически неблагоприятных новообразований. Средняя продолжительность жизни после постановки диагноза составляет от 4 до 12 месяцев, выживаемости более 1 года с момента постановки диагноза достигают лишь 10–20% пациентов [1].
Известно, что заболеваемость АР выше в регионах, для которых характерно наличие эндемического зоба среди населения [2]. Однако исследования, посвященные изучению анамнеза пациентов как прогностического параметра общей выживаемости, показывают противоречивые данные. Так, в исследовании L.C. Steggink с соавторами [3] не было доказано прогностической значимости наличия предсуществующего зоба и высокодифференцированного рака ЩЖ. I.R. Paunovic с соавторами [4] в своем исследовании прогностических факторов АР указывают на благоприятное значение наличия предсуществующего зоба.
Исследования морфологических особенностей АР в основном посвящены дифференциальной диагностике заболевания [5, 6]. Однако известно о влиянии гистологического строения некоторых злокачественных новообразований (ЗНО) на их течение и прогноз, и в первую очередь следует упомянуть папиллярный рак ЩЖ. Некоторые агрессивные варианты папиллярного рака ЩЖ имеют большую тенденцию к экстраорганному росту, метастазированию и рецидивам [7]. Несмотря на описанное в мировой литературе многообразие морфологических типов АР, до сих пор остается неизвестным влияние гистологических характеристик опухоли на прогноз заболевания и общую выживаемость (ОВ) пациентов [8]. Связано это, в первую очередь, с редкостью заболевания. Также значительные затруднения в изучении взаимосвязи гистологических характеристик опухоли на ОВ оказывает неоперабельность большинства пациентов на момент постановки диагноза, то есть невозможность получения достаточного объема опухолевого субстрата для гистологических исследований. Работы, посвященные изучению прогностического влияния гистологических характеристик АР, как правило, единичные и носят фрагментарный характер [9].
Целью данной работы является изучение прогностической значимости морфологических особенностей и данных анамнеза на ОВ пациентов.
Материалы и методы исследования
В исследование были включены 30 пациентов с АР, прооперированных в НМИЦ онкологии им. Н.Н. Блохина и Московской городской онкологической больнице № 62 с 2004 по 2020 гг. В каждом из случаев диагноз был поставлен с учетом характерной клинической картины, подтвержден с помощью гистологического и иммуногистохимического исследования операционного материала. Из исследования были исключены пациенты с первично множественными ЗНО, случаи послеоперационной летальности (в пределах 30 суток) и те пациенты, смерть которых не была связана с прогрессированием АР.
В зависимости от данных анамнеза пациенты были разделены на группы с наличием в анамнезе доброкачественных или злокачественных заболеваний ЩЖ, а также с отсутствием заболеваний. Также пациенты были разделены на группы с первичным и вторичным АР. В группу вторичного АР были включены пациенты с наличием в анамнезе предсуществующих злокачественных новообразований ЩЖ, а также те пациенты, в гистологических препаратах которых были обнаружены фокусы высокодифференцированного рака.
Среди гистологических параметров опухоли в нашем исследовании были проанализированы следующие: общее гистологическое строение, митотический индекс, индекс Ki-67 клеток опухоли и наличие очагов некроза. В зависимости от гистологического строения и сходства на светооптическом уровне с другими экстратиреоидными злокачественными опухолями все случаи АР были разделены на четыре основные группы: эпителиоидно-сквамоидная, саркоматоидная, бифазная и недифференцированная (рис. 1). К эпителиоидно-сквамоидной группе были отнесены случаи АР с неспецифичным солидным строением, характерным для низкодифференцированных карцином различной локализации и линии дифференцировки. В группу саркоматоидного варианта АР были включены опухоли, демонстрирующие заметное сходство с различными вариантами сарком. В группу бифазного АР были выделены варианты АР, отличавшиеся сочетанием зон солидного и пучкового строения. Случаи без выраженного преобладающего паттерна роста были выделены в группу недифференцированного варианта строения.
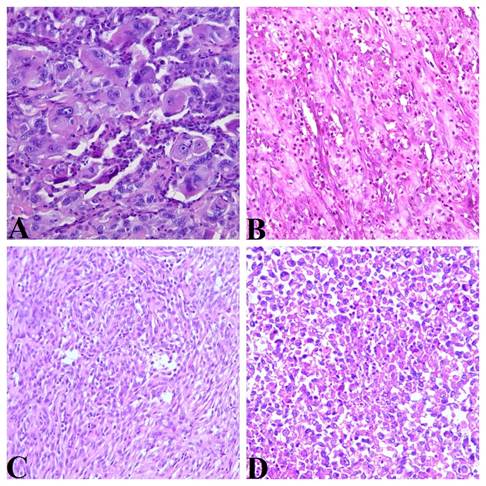
Рис. 1. Гистологические варианты анапластического рака.
Окрашивание гематоксилином и эозином, увеличение х200. А – эпителиоидно-сквамоидный вариант. В – саркоматоидный вариант. С – бифазный вариант.
D – недифференцированный вариант
Для удобства сопоставления митотического АР с другими ЗНО с агрессивным течением оценка митотической активности опухоли проводилась стандартным методом – подсчет митотических фигур в десяти репрезентативных полях зрения (РПЗ) в участках с наибольшей митотической активностью. Репрезентативным полем зрения считался участок жизнеспособной опухоли при увеличении х400, площадь десяти полей составила 2,46 мм2. Оценка объема очагов некроза в первичной опухоли носила полуколичественный характер и подразумевала 3 градации: 0 – отсутствие очагов некроза, 1 – мелкие очаги некроза (не более 1 мм), 2 – крупные очаги некроза (более 1 мм).
Иммуногистохимическое (ИГХ) исследование было проведено на автоматизированной платформе Dako Link48 (система детекции EnVision Flex). Для определения индекса Ki-67 нами был использован клон антитела MIB-1, титр 1:100. С архивных парафиновых блоков были изготовлены срезы толщиной 3–4 мкм. Окрашивание подготовленных срезов было проведено в соответствии с рекомендациями производителя антител. Ядра клеток были докрашены гематоксилином Майера. Индекс Ki-67 был оценен в зонах максимальной экспрессии антигена при 400-кратном увеличении и был рассчитан как процент окрашенных ядер из расчета на 1000 опухолевых клеток.
В связи с выраженной скоротечностью клинического течения АР ОВ была рассчитана в неделях от момента постановки диагноза до наступления летального исхода или периода наблюдения за пациентом.
Статистический анализ был проведен с помощью пакета статистических программ IBM SPSS Statistics (выпуск 22.0) (IBM, Чикаго, США). Описание количественных данных было проведено с вычислением среднего значения (М), стандартного отклонения (σ), диапазона. Корреляция между клинико-морфологическими показателями была оценена с помощью t-теста для независимых выборок при оценке количественных показателей. Анализ выживаемости был проведен по методике Каплана–Майера с использованием теста log-rank. Статистически значимым был признан результат при р<0,05.
Результаты исследования и их обсуждение
В выборке у 12 (40,0%) пациентов в анамнезе присутствовали заболевания щитовидной железы. У 7 (58,3%) больных по данным УЗИ или ТАБ был диагностирован узловой/многоузловой гиперпластический зоб ЩЖ. У 5 (16,7%) пациентов ранее был диагностирован высокодифференцированный рак (ВДР) ЩЖ: в 4 (33,3%) случаях папиллярный рак, в 1 (8,3%) – фолликулярный рак. ОВ пациентов в среднем составила 25,5 недели (min – 4 недели, max – 69 недель, медиана – 22 недели).
Можно отметить более чем двукратное увеличение ОВ группы пациентов с наличием в анамнезе заболеваний ЩЖ по сравнению с контрольной группой без таковых, однако достоверной значимости данные отличия не имеют (табл. 1). При сравнении групп больных в зависимости от характера предшествующего заболевания разница медиан ОВ в этих группах различалась несущественно (табл. 2).
Таблица 1
Общая выживаемость пациентов в зависимости от наличия в анамнезе иных заболеваний ЩЖ
|
Данные анамнеза |
Пациенты (n) |
ОВ (медиана, недель) |
p |
|
Пациенты без заболеваний ЩЖ |
18 |
15,0 |
0,066 |
|
Пациенты с заболеваниями ЩЖ |
12 |
30,0 |
Таблица 2
Общая выживаемость пациентов в зависимости от характера предшествующего заболевания ЩЖ
|
Данные анамнеза |
Пациенты (n) |
ОВ (медиана, нед) |
p |
|
Пациенты с доброкачественными новообразованиями |
7 |
28,0 |
0,682 |
|
Пациенты с первичными ЗНО |
5 |
35,0 |
У 12 (40,0%) больных в гистологических препаратах нами было обнаружено сочетание АР с менее злокачественными карциномами ЩЖ: папиллярным, онкоцитарным, низкодифференцированным раком и их комбинациями (рис. 2). Стоит отметить, что лишь у 4 пациентов в этой группе в анамнезе имелись данные о наличии ЗНО ЩЖ. Несмотря на тенденцию к увеличению ОВ пациентов с наличием более дифференцированного компонента опухоли, статистической значимости данный параметр не получил (табл. 3).
Таблица 3
Общая выживаемость пациентов в зависимости от наличия более дифференцированного опухолевого компонента
|
Строение опухоли |
Пациенты (n) |
ОВ (медиана, нед) |
p |
|
Анапластический рак |
18 |
19,0 |
0,760 |
|
Анапластический рак с участками более дифференцированной опухоли |
12 |
28,5 |
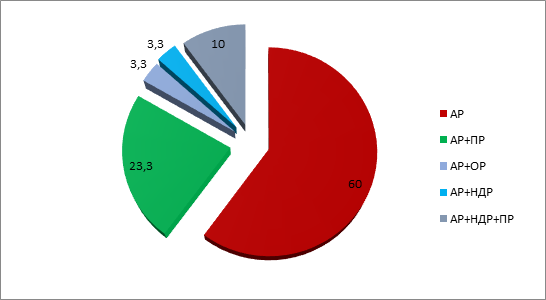
Рис. 2. Частота сочетания анапластического рака с менее злокачественными карцинома щитовидной железы. АР – анапластический рак; ПР – папиллярный рак; ОР – онкоцитарный рак; НДР – низкодифференцированный рак
При изучении взаимосвязи ОВ пациентов с выделенными нами гистологическими группами АР было отмечено заметное увеличение медианы ОВ у пациентов, входящих в группу эпителиоидно-сквамоидного варианта АР (табл. 4). Однако при анализе ОВ пациентов с эпителиоидно-сквамоидным вариантом и другими гистологическими типами опухоли статистического подтверждения данный фактор не получил (р=0,147).
Таблица 4
Общая выживаемость пациентов с различными гистологическими группами АР
|
Гистологическая группа |
Пациенты (n) |
ОВ (медиана, недель) |
|
Эпителиоидно-сквамоидная |
11 |
30,0 |
|
Саркоматоидная |
11 |
19,0 |
|
Бифазная |
5 |
15,0 |
|
Недифференцированная |
3 |
14,0 |
Митотический индекс АР варьировал от 4 до 58 в 10 РПЗ, в среднем – 19/10 РПЗ, медиана – 14/10 РПЗ. Индекс пролиферации опухолевых клеток (индекс Ki-67) в среднем составил 55,0% (σ±16,14), min – 30,0%, max – 90,0%.
При исследовании соотношения уровня митотической активности опухоли с индексом пролиферации опухолевых клеток и медианой ОВ пациентов нами было отмечено незначительное увеличение индекса Ki-67 с ростом митотической активности опухоли (табл. 5). Также была отмечена обратно пропорциональная связь уровня митотической активности опухолевых клеток с ОВ пациентов. Однако подобной связи ОВ пациентов с индексом Ki-67 не наблюдалось. Таким образом, можно считать уровень митотической активности опухолевых клеток более значимым для прогноза заболевания, чем индекс Ki-67.
Значение митотической активности клеток опухоли ≥20 митозов в 10 РПЗ в нашем исследовании является статистически достоверным неблагоприятным фактором прогноза (р=0,033, рис. 3).
Таблица 5
Общая выживаемость пациентов с различным уровнем митотической активности и индекса Ki-67
|
Митозы (n в 10 РПЗ) |
Индекс Ki-67 (среднее, %) |
Пациенты (n) |
ОВ (медиана, недель) |
|
<10 |
52,3 |
9 |
35,0 |
|
≥10 – <20 |
55,4 |
12 |
26,0 |
|
≥20 |
57,1 |
9 |
16,0 |
Крупные очаги некроза отмечались в 15 (50,0%) случаях, а в 8 (26,7%) случаях отсутствовали вовсе. Была отмечена тенденция к уменьшению медианы ОВ пациентов с увеличением объема очагов интратуморального некроза (табл. 6). При статистической обработке данных параметров нами было отмечено достоверное различие ОВ в группах с отсутствием и наличием интратуморальных очагов некроза (р=0,044, рис. 4), а также в группах с крупными интратуморальными очагами некроза и мелкими / отсутствием очагов некроза (р= 0,038, рис. 5).
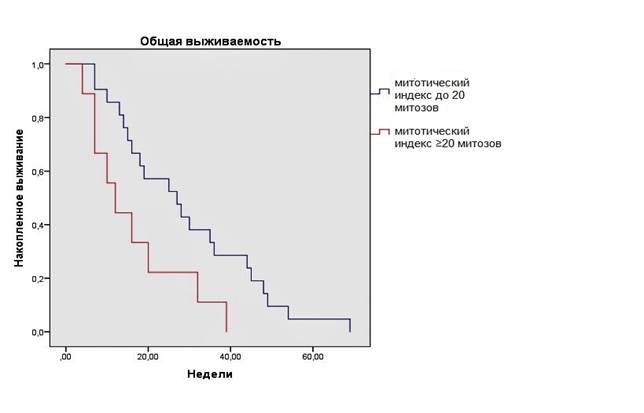
Рис. 3. Общая выживаемость пациентов с митотическим индексом до 20 и ≥20 митозов в 10 РПЗ
Таблица 6
Общая выживаемость пациентов с различным объемом интратуморальных очагов некроза
|
Очаги некроза |
Пациенты (n) |
ОВ (медиана, недель) |
p |
|
Отсутствие |
8 |
32,5 |
0,044 |
|
Мелкие очаги некроза (<10% объема опухоли) |
7 |
25,0 |
|
|
Крупные очаги некроза (≥10% объема опухоли) |
15 |
15,0 |
0,038 |
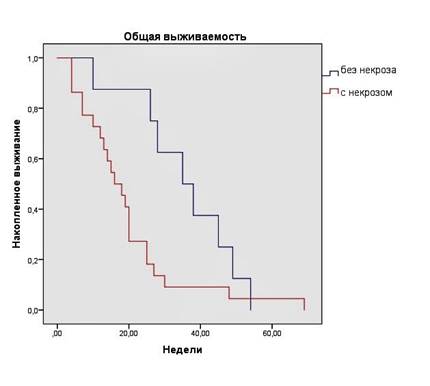
Рис. 4. Общая выживаемость пациентов с наличием и отсутствием очагов некроза
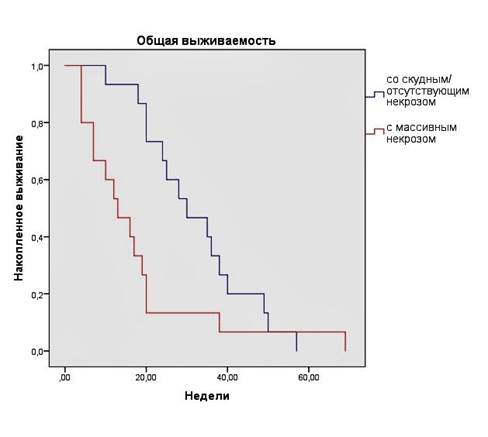
Рис. 5. Общая выживаемость пациентов с крупными интратуморальными некрозами и мелкими очагами / отсутствием некрозов
Несмотря на общепризнанное мнение об отсутствии прогностического влияния гистологических особенностей АР на ОВ пациентов, отдельные исследования в данной области опровергают эту гипотезу. Так, M. Hirokawa с соавторами [9] в своем исследовании выделяют наличие опухоли-предшественника, эпителиоидный характер роста и наличие очагов плоскоклеточной дифференцировки опухолевых клеток как прогностически благоприятные факторы.
В данном исследовании, несмотря на значительную разницу ОВ пациентов с эпителиоидно-сквамоидным вариантом АР по сравнению с ОВ пациентов в других группах, этот параметр не получил статистически значимого подтверждения. Схожая картина наблюдается в группе пациентов с наличием в анамнезе заболеваний ЩЖ, аналогично исследованию L.C. Steggink с соавторами [3]. Наличие в анамнезе пациентов предсуществующего зоба или высокодифференцированных карцином ЩЖ не было достоверно связано с продолжительностью жизни пациентов.
Несмотря на то что высокая митотическая активность опухолевых клеток и наличие интратуморальных очагов некроза неизменно указываются как важные диагностические критерии АР, изучение влияния данных параметров на течение и прогноз заболевания ранее не проводилось. В данном исследовании эти параметры показали статически значимое влияние на ОВ пациентов. Статистически достоверными неблагоприятными факторами прогноза в данном исследовании оказались высокая митотическая активность клеток опухоли (более 20 митозов в 10 РПЗ) и наличие крупных интратуморальных очагов некроза (более 10% от объема опухоли). Стоит отметить, что индекс пролиферативной активности клеток опухоли (индекс KI-67) не коррелирует ни с митотической активностью, ни с ОВ пациентов. Индекс Ki-67 клеток опухоли следует рассматривать исключительно как диагностический маркер для правильной постановки диагноза, но не как прогностически значимый фактор.
К благоприятным прогностически значимым факторам в данном исследовании относится полное отсутствие интратуморальных очагов некроза.
Заключение. В данном исследовании были выявлены статистически достоверные неблагоприятные и благоприятные морфологические факторы прогноза АР. К неблагоприятным факторам прогноза были отнесены высокая митотическая активность клеток опухоли (более 20 митозов в 10 РПЗ) и наличие крупных интратуморальных очагов некроза (более 10% от объема опухоли). К благоприятным факторам прогноза было отнесено полное отсутствие интратуморальных очагов некроза.
Библиографическая ссылка
Вилкова А.С., Козлов Н.А., Бржезовский В.Ж., Волков А.Ю. СРАВНИТЕЛЬНЫЙ АНАЛИЗ ПРОГНОСТИЧЕСКОЙ ЗНАЧИМОСТИ ИНДЕКСА KI-67 И ПОЛУКОЛИЧЕСТВЕННЫХ МОРФОЛОГИЧЕСКИХ ПАРАМЕТРОВ АНАПЛАСТИЧЕСКОГО РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32477 (дата обращения: 31.01.2026).
DOI: https://doi.org/10.17513/spno.32477



