На прогноз заболевания COVID-19 главным образом влияет полиорганное поражение. Острый респираторный дистресс-синдром, сердечная недостаточность, почечная недостаточность, поражение печени, шок и полиорганная недостаточность тесно связаны с заболеваемостью и смертностью [1]. Патология заболевания COVID-19, вероятно, связана с гипервоспалительной реакцией организма, характеризующейся патологическим уровнем цитокинов. Синдром цитокинового шторма, возможно, является одним из важнейших признаков тяжести заболевания COVID-19 [2].
Цитокиновый шторм – это потенциально фатальное иммунное заболевание, характеризующееся высокой активацией иммунных клеток и избыточной продукцией массивных воспалительных цитокинов и химических медиаторов. Это считается основной причиной тяжести заболевания и смерти у пациентов с COVID-19 и связано с высоким уровнем циркулирующих цитокинов, тяжелой лимфопенией, тромбозом и массивной мононуклеарной клеточной инфильтрацией во многих органах [3] у пациентов, в связи с чем они нуждаются в госпитализации в отделение интенсивной терапии (ОИТ). Ликвидация COVID-19 в настоящее время практически невозможна, а специфического лечения тяжелобольных пациентов с COVID-19 не существует; однако возможной стратегией может быть подавление воспалительной реакции [4].
Пищевой статус человеческого организма играет ключевую роль в развитии эффективного и надлежащим образом сбалансированного иммунного ответа на патогенные вирусы. У людей с дефицитом питательных веществ снижается выработка клеток крови, что приводит к нарушению защитных клеток и повышенному риску инфицирования. Нутритивная поддержка чрезвычайно важна для борьбы с инфекциями и их предотвращения. Известно, что пациенты с COVID-19 склонны к катаболизму и снижению белкового резерва в сочетании с кахексией и гипорексией, которые провоцируюет нутритивный дефицит и дисбактериоз [5]. Длительная госпитализация, включая иммобилизацию и катаболизм, вызывает снижение массы тела и мышечной массы, что может привести к саркопении – состоянию, которое ухудшает дыхательную и сердечную функции и ухудшает прогноз. Кроме того, белково-энергетическая недостаточность вызывает несбалансированный иммунный ответ на вирусные патогены, что может способствовать инфильтрации легких воспалительными клетками, поэтому может потребоваться система нутритивной поддержки для уменьшения осложнений, вызванных SARS-CoV-2, снижения прогрессирования цитокинового шторма и уровня летального исхода [6].
Традиционно исследования в области питания сосредоточены на связи между болезнями и группами продуктов питания или определенными питательными веществами. Такие исследования не позволяют всесторонне оценить сложность взаимосвязи между питанием и патологическим процессом. Изучение моделей питания и режимов питания, оценивающих рацион в целом, является актуальной областью исследований, и изучение этих взаимосвязей может дать важную информацию о влиянии статуса питания на тяжесть заболевания. Кроме того, в отечественной медицинской практике оценка влияния комплексной терапии с нутритивной поддержкой на вероятность развития гиперцитокинемии и уровень выживаемости пациентов с COVID-19 в отделении интенсивной терапии ранее не поводилась, что обусловливает актуальность направления данного исследования.
Целью исследования является изучение влияния комплексной терапии с нутритивной поддержкой на вероятность развития гиперцитокинемии и уровень выживаемости пациентов с COVID-19 в отделении интенсивной терапии.
Материалы и методы исследования
Исследование базируется на анализе результатов лечения 210 пациентов с COVID-19, находившихся с января 2020 г. по декабрь 2021 г. на лечении в ОИТ.
Было проведено стратифицированное распределение больных на две группы. Первая группа сравнения включала 100 пациентов, у которых применили традиционную методику нутритивной поддержки. Вторую группу исследования составили 110 пациентов, набранных проспективно, лечение которых проводили по мультимодальной программе с включением усовершенствованной схемы нутритивной поддержки с применением перорального, энтерального и/или парентерального путей нутритивной поддержки.
Для энтерального питания в группе исследования нами применялась модифицированная методика нутритивной поддержки с использованием препаратов: Респалор для легочных пациентов, Pulmocare, NovaSource Pulmonary ®, Нутрен Пульмонари®. Кроме того, в исследовании применяли назогастральный катетер NutriVent™, который показан всякий раз, когда дренирование желудка и энтеральное питание необходимо сочетать с измерением внутрибрюшного давления (например, при перитоните, ожирении, множественных переливаниях крови, политравме) или измерением плеврального давления (у пациентов, которым проводится инвазивная или неинвазивная механическая вентиляция легких).
Парентеральное питание в большинстве случаев проводили с применением систем «три в одном» с введением Кабивен® центральный, Липоплюс 20. Смесь подбирали индивидуально согласно показаниям к нутритивной поддержке. Расчет количества смеси, которое получали больные, производился также строго индивидуально с коррекцией метаболических нарушений.
Группа контроля получала принятую в ОИТ схему нутритивной поддержки для пациентов в зависимости от их состояния без вариативности использования препарата (до введения новой схемы питания).
С целью выявления вероятности развития гиперцитокинемии и уровня выживаемости пациентов с COVID-19 оценивали показатели СРБ, прокальцитонина и интерлейкина-6 (ИЛ-6) в сыворотке крови перед началом нутритивной поддержки, на 1-е, 7-е и на 14-е сутки после начала нутритивной поддержки; развитие синдрома полиорганной недостаточности по индексу SOFA, а также 14-дневную, 30-дневную и 60-дневную смертность.
Статистический анализ данных проводили на основании пакетов прикладных программ Microsoft Excel и с помощью специализированного программного обеспечения STATISTICA 64. Распределение данных по числовым переменным анализировали с помощью критерия нормальности Шапиро–Уилка. Для анализа общей выживаемости и смертности использовали кривые Каплана–Мейера и достоверное различие по логарифмическому рангу. Для межгруппового сравнительного анализа числовых переменных применяли критерий Манна–Уитни. Для внутригруппового анализа использовали критерий Вилкоксона. Для анализа качественных переменных применяли точный критерий Фишера (односторонний); значения p≤0,05 считались показательными для статистической значимости.
Результаты исследования и их обсуждение
Динамика среднего уровня концентрации СРБ, прокальцитонина и интерлейкина-6 в крови у пациентов I и II групп при поступлении и на 1-е, 7-е, 14-е сутки после начала нутритивной поддержки в ОИТ представлена в таблице 1.
Таблица 1
Динамика среднего уровня концентрации СРБ, прокальцитонина и интерлейкина-6 в крови
у пациентов I и II групп
|
Точки определения |
Группы пациентов |
Р |
|
|
|
I группа (сравнения) |
II группа (сравнения) |
|
||
|
СБР референсные значения от 0 до 5мг/л |
||||
|
При поступлении в ОИТ |
75,3±40,7 |
79,32±41,3
|
0,67 |
|
|
На 1-е сутки |
65,3±35,2 |
66,8±34,1 |
0,58 |
|
|
На 7-е сутки |
54,5±22,4 |
38,4±31,2 |
0,001 |
|
|
На 14-е сутки |
40,63±44,97 |
25,75±25,31 |
0,005 |
|
|
Прокальцитонин референсные значения 0–0,046 нг/мл |
||||
|
При поступлении в ОИТ |
0,13±0,14 |
0,12±0,12 |
0,99 |
|
|
На 1-е сутки |
0,12±0,11 |
0,10±0,11 |
0,87 |
|
|
На 7-е сутки |
0,11±0,15 |
0,099±0,10 |
0,75 |
|
|
На 14-е сутки |
0,098±0,14 |
0,085±0,11 |
0,71 |
|
|
ИЛ-6 референсные значения 0–7 пг/мл |
||||
|
При поступлении в ОИТ |
11,8±4,15 |
11,96±4,02 |
0,88 |
|
|
На 1-е сутки |
10,77±3,5 |
10,81±3,2 |
0,64 |
|
|
На 7-е сутки |
7,31±2,7 |
6,51±2,8 |
0,001 |
|
|
На 14-е сутки |
4,93±2,65 |
4,04±1,97 |
0,005 |
|
Имеющиеся данные показывают, что провоспалительные цитокины играют ключевую роль в патофизиологии у пациентов, пораженных COVID-19. У пациентов, пораженных COVID-19, может развиться молниеносная и повреждающая иммунная реакция, поддерживаемая цитокинами, что приводит к альвеолярной инфильтрации макрофагами и моноцитами. Интерлейкин-6 (IL-6), продуцируемый в ответ на инфекции и повреждения тканей, способствует защите хозяина посредством стимуляции ответов острой фазы, гемопоэза и иммунных реакций. Хотя его экспрессия строго контролируется транскрипционными и посттранскрипционными механизмами, нарушение регуляции непрерывного синтеза IL-6 оказывает патологическое влияние на хроническое воспаление и аутоиммунитет. После синтеза IL-6 в локальном очаге на начальной стадии воспаления он с током крови перемещается в печень, после чего происходит быстрая индукция широкого спектра острофазовых белков, таких как С-реактивный белок (СРБ), сывороточный амилоид А (SAA), фибриноген, гаптоглобин и α1-антихимотрипсин. Однако IL-6 снижает продукцию фибронектина, альбумина и трансферрина. IL-6 также участвует в регуляции уровней железа и цинка в сыворотке посредством контроля их переносчиков. Ось IL-6-гепсидин ответственна за гипоферремию и анемию, связанные с хроническим воспалением. Повышенный уровень IL-6 обнаруживается у многих пациентов с COVID-19, что является предиктором тяжести заболевания и смертности при COVID-19 [4].
В нашем случае на момент госпитализации у пациентов I и II групп концентрация IL-6 статистически значимо не отличалась и составила в I группе 11,8±4,15 пг/мл (Ме 12 [4; 18]), во II группе – 11,96±4,02 пг/мл (Ме 12 [4; 18]) (р=0,88). Однако на 14-е сутки при нутритивной поддержке в I группе была обнаружена тенденция к более значимому снижению уровня концентрации ИЛ-6 – 4,93±2,65 пг/мл (Ме 5 [0; 16]) со статистически достоверной разницей в показателе по сравнению с пациентами II группы, где анализируемый показатель составил 4,04±1,97 пг/мл (Ме 4 [0; 7]) (р=0,05). Таким образом, можно предположить влияние нутритивного статуса пациентов группы исследования на снижение концентрации уровня IL-6 в сыворотке крови.
Сывороточный С-реактивный белок (СРБ) является важным маркером, который значительно изменяется у пациентов с тяжелой формой COVID-19. СРБ связывается с микроорганизмами и способствует их удалению посредством фагоцитоза. Риск развития тяжелых событий у пациентов с COVID-19 увеличивается на 5% на каждую единицу увеличения концентрации СРБ [7].
Согласно полученным результатам исследования, концентрация СРБ на момент госпитализации у пациентов I группы составила 75,3±40,7 мг/л (Ме 64,5 [12; 240]), у пациентов II группы – 79,32±41,3 мг/л (Ме 77 [26; 240]) и статистически значимо не отличалась (р=0,67) (рис. 2).
При этом у большинства пациентов обеих анализируемых групп концентрация СРБ в крови превышала референсные значения в 10 и более раз. На 14-е сутки в I группе была обнаружена тенденция к более высокому уровню концентрации СРБ – 40,63±44,97 мг/л (Ме 16 [4; 233]) со статистической достоверностью по сравнению с пациентами II группы, где анализируемый показатель составил 25,75±25,31 мг/л (Ме 24,5 [4; 200]) (р=0,005).
Повышенные значения прокальцитонина связаны с примерно 5-кратным увеличением риска тяжелой инфекции SARS-CoV-2 [8]. Концентрация прокальцитонина на момент госпитализации у пациентов I группы составила 0,13±0,14 нг/мл (Ме 0,07 [0,01; 0,7]), у пациентов II группы – 0,12±0,12 нг/мл (Ме 0,07 [0,01; 0,7]) и статистически значимо не отличалась (р=0,99). У большинства пациентов обеих анализируемых групп концентрация прокальцитонина в крови превышала референсные значения в несколько раз. На 14-е сутки в I группе показатель концентрации прокальцитонина в крови составил 0,098±0,14 нг/мл (Ме 0,05 [0; 0,7]), у пациентов II группы анализируемый показатель составил 0,085±0,11 нг/мл (Ме 0,06 [0; 0,7]) (р=0,71).
Известный как синдром полиорганной дисфункции (СПОН), полиорганная недостаточность или через некоторые из его наиболее заметных проявлений, такие как острый респираторный дистресс-синдром (ОРДС) или диссеминированное внутрисосудистое свертывание крови (ДВС-синдром), является наиболее частой причиной смерти пациентов с COVID-19, поступающих в ОИТ. И, хотя синдром включает дисфункцию многих органов, он также влияет на физиологические системы, которые классически не считаются органами, включая гематологическую систему, иммунную систему или эндокринную систему. Поскольку синдром почти всегда возникает после активации воспалительной реакции хозяина, СПОН можно рассматривать как неадекватное последствие острого воспаления, системный эквивалент функциональной недостаточности или потерю функции, кардинальный признак острого локализованного воспаления [9].
При сравнении показателей частоты развития СПОН на фоне нутритивной поддержки было выявлено, что по сравнению с I группой частота СПОН во II группе была значительно ниже – 25,5% (28/110) против 36% (36/100) в I группе (р<0,05) При этом у пациентов I группы появление СПОН зарегистрировано на 13-й день пребывания в ОИТ – 12,8±4,2 дня (Ме 13 [5; 22]), среди пациентов II группы появление СПОН зарегистрировано на 10-й день пребывания в ОИТ – 11,4±5,9 дня (Ме 10 [3; 24]). Оценка СПОН в анализируемых группах выявила, что ее средний показатель среди пациентов I группы составил 12,7±4,4 балла (Ме 12 [5; 22]), среди пациентов II группы – 14,1±5,01 балла (Ме 13,5 [4; 25]). Это может говорить о том, что даже при более высоком уровне СПОН у пациентов с усовершенствованной схемой нутритивной поддержки с большей вероятностью происходило постепенное улучшение их общего состояния. Об этом также можно судить по оценке летальности среди пациентов (табл. 2 и рисунок).
Таблица 2
Показатель уровня летальности у пациентов с разной схемой нутритивной поддержки
|
Уровень/Группа |
I группа (сравнения) |
II группа (сравнения) |
|||
|
Кол-во |
% |
Кол-во |
% |
||
|
Выжило |
42 |
42,0 |
77 |
70,0 |
|
|
Умерло |
58 |
58,0 |
33 |
30,0 |
|
|
День констатации смерти (средний показатель) |
26,35±14,6 |
20,27±13,03 |
|||
|
14-дневная выживаемость |
87 |
87,0 |
96 |
87,3 |
|
|
30-дневная выживаемость |
60 |
60,0 |
85 |
77,3 |
|
|
60-дневная выживаемость |
42 |
42,0 |
77 |
70,0 |
|
14-дневная выживаемость была зарегистрирована у 87% (87/100) пациентов I группы и у 87,3% (96/110) пациентов II группы. В дальнейшем динамика выживаемости меняется: 30-дневная выживаемость была зарегистрирована у 60% (60/100) пациентов I группы и у 77,3% (85/110) пациентов II группы. 60-дневная выживаемость была зарегистрирована у 42% (42/100) пациентов I группы и у 70% (77/110) пациентов II группы.
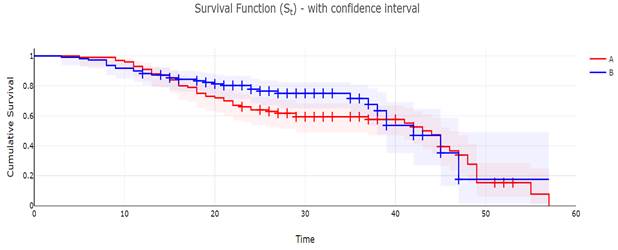
60-дневная выживаемость у пациентов с разной схемой нутритивной поддержки
Ожидаемая частота летальности в группе на 30-й день составляет 35,1, тогда как во II группе – 32,8 (χ²=3,7, р = 0,055). Ожидаемая частота летальности в I группе на 60-й день составляет 53,5, тогда как во II группе – 37,5 (χ²=0,9, р<0,05).
Заключение
Таким образом, проведенное исследование показало, что уровень концентрации сывороточного интерлейкина-6 и других индексов воспаления (СРБ, прокальцитонина) в сыворотке крови был умеренно повышенным – это можно использовать в качестве важного показателя прогрессирования и тяжести COVID-19. Кроме того, настоящее исследование предполагает, что пациенты с более высоким уровнем концентрации рассмотренных индексов воспаления должны находиться под тщательным наблюдением на протяжении всего течения болезни.
Применение предложенной усовершенствованной схемы нутритивного питания у пациентов с COVID в условиях ОИТ приводит к более быстрому снижению концентрации сывороточного интерлейкина-6 и других индексов воспаления (СРБ, прокальцитонина). Микронутриенты могут повысить иммунитет хозяина против вирусных инфекций, включая COVID-19. Схема нутритивной поддержки пациентов с COVID-19 способна оказывать влияние на частоту развития синдрома полиорганной дисфункции и ее более тяжелую форму, что, в свою очередь, может оказывать влияние на 30- и 60-дневную выживаемость пациентов.
Библиографическая ссылка
Кхан М.И., Абусуев А.А. ВЛИЯНИЕ КОМПЛЕКСНОЙ ТЕРАПИИ С НУТРИТИВНОЙ ПОДДЕРЖКОЙ НА ВЕРОЯТНОСТЬ РАЗВИТИЯ ГИПЕРЦИТОКИНЕМИИ И УРОВЕНЬ ВЫЖИВАЕМОСТИ ПАЦИЕНТОВ С COVID-19 В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ // Современные проблемы науки и образования. 2023. № 2. ;URL: https://science-education.ru/ru/article/view?id=32476 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/spno.32476



