В пищевой промышленности, а также в фармацевтической отрасли, косметологии для увеличения сроков хранения и подавления активности микроорганизмов и грибков применяется пищевая добавка Е211 – бензоат натрия. Его можно встретить в составе консервов, молочных и мясных продуктов, приправ, полуфабрикатов, а также в наружной оболочке лекарственных препаратов и средствах личной гигиены. Несмотря на широкое применение, остается открытым вопрос о безопасности бензоата натрия. Это связано с тем, что получены данные, свидетельствующие о развитии целого ряда неблагоприятных эффектов в организме после воздействия бензоата натрия: аллергические реакции, гепато- и нефротоксичность, гонадотоксичность, мутагенное и тератогенное действие [1]. Из положительных сторон применения бензоата натрия можно отметить его эффективность в составе комплексного лечения болезни Паркинсона, некоторых деменций, форм шизофрении, а также болезней, сопровождающихся гипераммониемией [2; 3]. В то же время остаются не освещенными вопросы, касающиеся влияния длительного воздействия бензоата натрия на структурную организацию эндокринных желез, регулирующих функции исполнительных систем и метаболизм, в частности на щитовидную железу.
Цель исследования. В период после завершения 60-суточного воздействия бензоата натрия (период реадаптации) в эксперименте установить особенности качественных и количественных изменений гистологического строения щитовидной железы.
Материал и методы исследования. Эксперимент проведен на 90 белых беспородных половозрелых крысах-самцах массой 200-210 г, которые были распределены на 3 группы по 6 особей в каждой. Первая группа служила контролем для двух последующих, где лабораторные животные получали в течение 60 суток внутрижелудочно физиологический раствор. Во второй и третьей группах (группы Б1 и Б2) вместо 0,9% изотонического раствора натрия хлорида животных подвергали воздействию бензоата натрия в дозировке 500 и 1000 мг/кг массы тела (производитель Eastman Chemical B.V., Нидерланды). Содержание и манипуляции над животными проводили в соответствии с правилами содержания экспериментальных животных, установленных Директивой 2010/63/EU Европейского парламента и Совета Европейского союза [4]. Эксперимент завершали на 3, 10, 15, 24 и 45-е сутки после окончания 60-суточного воздействия пищевой добавки методом декапитации под эфирным наркозом. Выделяли и изолировали щитовидную железу, подвергали ее обработке по стандартным этапам гистологической проводки. Срезы толщиной 5-6 мкм окрашивали гематоксилин-эозином. Изучение срезов на полученных стеклопрепаратах и их фотографирование осуществляли при помощи комплекса, состоящего из персонального компьютера с установленным программным обеспечением Nis-Elements BR 4.60.00, микроскопа Nikon Eclipse Ni с цифровой камерой Nikon DS-Fi3.
Для объективизации качественных изменений гистологического строения щитовидной железы проводили морфометрические замеры в центральном и периферических отделах щитовидной железы, учитывая разную морфологию фолликулов в них. Для измерений выбирали визуально целые фолликулы. В ручном режиме с использованием объектива 10х вычисляли внутренний диаметр фолликула, высоту фолликулярного эпителия и как отношение первого ко второму показателю – просвет-эпителиальный индекс. С использованием объектива 100х определяли площадь ядра и цитоплазмы фолликулярных клеток путем ручного обведения их контуров и далее рассчитывали ядерно-цитоплазматическое отношение. Для расчета окончательного значения каждого параметра учитывали данные, полученные не менее чем от 10 измеренных участков железы. Затем результаты подвергали анализу с использованием лицензионного программного обеспечения MS Excel и Statistiсa 5.1. Для определения метода сравнения контрольных и экспериментальных данных – параметрического или непараметрического, использовали критерий Колмогорова - Смирнова и тест Шапиро - Уилка. Выстраивали вариационные ряды, вычисляли среднее арифметическое значение показателей, стандартную ошибку, среднее квадратичное отклонение и величину процента отклонения показателя от контрольного. Для установления статистической значимости использовали параметрический t-критерий Стьюдента. Различие считалось достоверным при вероятности ошибки меньше 5%.
Результаты исследования и обсуждение
Результаты исследования показали, что гистологическое строение щитовидной железы контрольных крыс не отличалось от такового, установленного другими авторами [5; 6]. У половозрелых крыс контрольной группы наблюдали положительную динамику изменений морфометрических параметров щитовидной железы в ходе периода реадаптации. Внутренний диаметр фолликулов в центральной части железы увеличивался с 3-х по 45-е сутки наблюдения с 61,95±0,73 до 64,29±1,22 мкм, высота фолликулярного эпителия – с 7,94±0,07 до 8,32±0,09 мкм, а просвет-эпителиальный индекс – с 7,89±0,08 до 8,15±0,08. Площадь ядер фолликулярных клеток возрастала с 26,45±0,43 до 26,73±0,58 мкм2, площадь их цитоплазмы – с 33,81±0,29 до 33,95±0,57 мкм2, а ядерно-цитоплазматическое отношение – с 0,803±0,003 до 0,807±0,007. В периферических отделах железы внутренний диаметр фолликулов в ходе наблюдения увеличивался с 86,23±0,80 до 86,58±0,87 мкм, высота фолликулярного эпителия – с 6,63±0,05 до 6,79±0,05 мкм, просвет-эпителиальный индекс – с 13,88±0,09 до 14,27±0,19, площадь ядер фолликулярных клеток – с 18,18±0,35 до 18,41±0,45 мкм2, площадь цитоплазмы фолликулярных клеток – с 26,36±0,33 до 26,75±0,41 мкм2 и наконец ядерно-цитоплазматическое отношение – с 0,720±0,004 до 0,725±0,004.
На 3-и сутки эксперимента в группе Б1 выявляли фолликулы неправильной формы, выстланные фолликулярными клетками кубической (преобладают в центре железы) или плоской (преобладают на периферии железы) формы. Коллоид в некоторых фолликулах организовался в центре и отсутствовал (пространство в виде светлого ободка) около тироцитов. Среди последних можно выделить эпителиальные клетки со светлой цитоплазмой без ядра или с темным (пикнотическим) ядром. К 24 суткам в поле зрения наблюдали постепенное уменьшение количества фолликулов с плоским эпителием под капсулой, а также количества клеток со светлой цитоплазмой, а в пристеночной области со стороны коллоида появлялись резорбционные вакуоли разного размера. К 45 суткам фолликулы были выстланы кубическим эпителием, а в коллоиде располагались одиночные вакуоли.
На периферии органа в данный срок эксперимента встречались единичные фолликулы с плоскими клетками. В группе Б1 установлены следующие достоверные отличия значений изучаемых гистоморфометрических показателей щитовидной железы от аналогичных в контрольной группе с 3 по 24 сутки эксперимента (здесь и далее по тексту при уровне статистической значимости р<0,05). В центральных отделах щитовидной железы высота фолликулярного эпителия была ниже с 3 по 15 сутки на 10,21%, 6,75%, 4,33%, площадь ядер фолликулярных клеток – с 3 по 10 сутки на 5,18%, 5,02%, а ядерно-цитоплазматическое отношение – с 3 по 24 сутки на 3,94%, 3,96%, 4,15%, 2,69%. При этом просвет-эпителиальный индекс с 3 по 15 сутки был больше на 3,85%, 3,89%, 3,53%. В периферических отделах щитовидной железы высота фолликулярного эпителия снижалась, по сравнению с данными контрольной группы, с 3 по 15 сутки на 4,60%, 3,80%, 3,35%, ядерно-цитоплазматическое отношение – на 4,17%, 4,23%, 4,40%, а просвет-эпителиальный индекс возрастал с 3 по 10 сутки на 2,34%, 2,68%.
К 3 суткам эксперимента в группе Б2 выявляли фолликулы неправильной формы с тироцитами низкой кубической (в центральной части железы) или плоской формы (в центральной и периферической части железы). Коллоид имел неоднородную структуру, а также неравномерно был распределен в полости фолликула. Последняя могла содержать единичные или расположенные группами скопления слущенных эпителиальных клеток, а также скопления эритроцитов. В стенке фолликула визуализировались клетки со светлой цитоплазмой и уплощенным ядром. К 24 и 45 суткам наблюдалась аналогичная, но менее выраженная, тенденция изменений с вышеописанной группой (на 24 сутки в поле зрения выявлен единичный фолликул, заполненный концентрическими плотными слоистыми скоплениями ткани и ограниченный эпителиоцитами плоской формы). Причем следует отметить, что на периферии железы к 45 суткам эксперимента в поле зрения было больше фолликулов с плоскими тироцитами, чем в группе Б1 (рисунок).
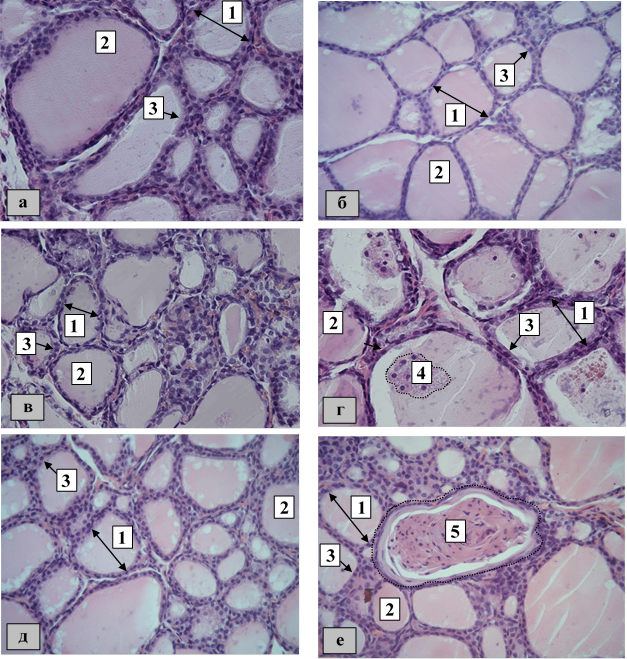 |
 Микроскопические особенности строения щитовидной железы (3-и сутки эксперимента: а – контрольная группа, в – экспериментальная группа после воздействия бензоата натрия первой дозы, д – экспериментальная группа после воздействия бензоата натрия второй дозы; 24-е сутки эксперимента: б – контрольная группа, г - экспериментальная группа после воздействия бензоата натрия первой дозы, е - экспериментальная группа после воздействия бензоата натрия второй дозы): 1 – фолликул, 2 – коллоид, 3 – тироцит кубической формы, 4 – слущенные эпителиальные клетки, 5 – единичный фолликул, заполненный концентрическими плотными слоистыми скоплениями ткани и ограниченный эпителиоцитами плоской формы. Окраска: гематоксилином и эозином. Увеличение: ×400
Микроскопические особенности строения щитовидной железы (3-и сутки эксперимента: а – контрольная группа, в – экспериментальная группа после воздействия бензоата натрия первой дозы, д – экспериментальная группа после воздействия бензоата натрия второй дозы; 24-е сутки эксперимента: б – контрольная группа, г - экспериментальная группа после воздействия бензоата натрия первой дозы, е - экспериментальная группа после воздействия бензоата натрия второй дозы): 1 – фолликул, 2 – коллоид, 3 – тироцит кубической формы, 4 – слущенные эпителиальные клетки, 5 – единичный фолликул, заполненный концентрическими плотными слоистыми скоплениями ткани и ограниченный эпителиоцитами плоской формы. Окраска: гематоксилином и эозином. Увеличение: ×400
В группе Б2 в центральных отделах щитовидной железы высота фолликулярного эпителия была ниже аналогичного показателя контрольной группы с 3 по 24 сутки на 11,93%, 7,40%, 6,26%, 5,64%, площадь ядер фолликулярных клеток – с 3 по 15 сутки на 10,04%, 6,33%, 5,31%, ядерно-цитоплазматическое отношение – с 3 по 45 сутки на 5,39%, 5,21%, 4,98%, 2,94%, 2,69%, просвет-эпителиальный индекс – был выше с 3 по 24 сутки на 5,56%, 6,93%, 5,84%, 4,88%, а площадь цитоплазмы фолликулярных клеток – на 10 сутки на 3,33%. В периферических отделах щитовидной железы сохранялась аналогичная тенденция: внутренний диаметр фолликулов был больше на 10 сутки на 3,20%, высота фолликулярного эпителия уменьшалась с 3 по 45 сутки на 7,02%, 6,17%, 4,97%, 3,87%, 4,88%, площадь ядер фолликулярных клеток – с 3 по 10 сутки на 7,38%, 6,24%, ядерно-цитоплазматическое отношение – с 3 по 15 сутки на 5,56%, 5,32%, 5,09%. Просвет-эпителиальный индекс оставался выше аналогичного контрольного показателя с 3 по 15 сутки на 4,66%, 3,87%, 2,47% (таблица).
Гистоморфометрические параметры щитовидной железы крыс в период реадаптации после 60-суточного воздействия бензоата натрия (M±m)
|
Срок перио-да реадап-тации |
Внутренний диаметр фолликула, мкм |
Высота фоллику-лярного эпителия, мкм |
Просвет-эпителиаль-ный индекс |
Площадь ядер фоллику-лярных клеток, мкм2 |
Площадь цитоплазмы фоллику-лярных клеток, мкм2 |
Ядерно-цитоплазма-тическое отношение |
|
Контроль |
||||||
|
3 |
61,95±0,73 86,23±0,80 |
7,94±0,07 6,63±0,05 |
7,89±0,08 13,88±0,09 |
26,45±0,43 18,18±0,35 |
33,81±0,29 26,36±0,33 |
0,803±0,003 0,720±0,004 |
|
10 |
62,27±0,93 86,32±0,80 |
8,00±0,07 6,67±0,06 |
7,89±0,09 13,91±0,09 |
26,45±0,48 18,20±0,37 |
33,80±0,29 26,38±0,35 |
0,800±0,004 0,720±0,004 |
|
15 |
62,33±1,10 86,80±0,60 |
8,04±0,09 6,71±0,06 |
7,94±0,09 14,02±0,12 |
26,57±0,50 18,26±0,33 |
33,87±0,58 26,40±0,32 |
0,803±0,003 0,720±0,004 |
|
24 |
62,64±1,12 86,17±0,58 |
8,09±0,09 6,72±0,05 |
7,99±0,09 14,15±0,18 |
26,59±0,70 18,31±0,43 |
33,75±0,62 26,47±0,37 |
0,805±0,004 0,725±0,004 |
|
45 |
64,29±1,22 86,58±0,87 |
8,32±0,09 6,79±0,05 |
8,15±0,08 14,27±0,19 |
26,73±0,58 18,41±0,45 |
33,95±0,57 26,75±0,41 |
0,807±0,007 0,725±0,004 |
|
Группа Б1 |
||||||
|
3 |
63,42±0,73 87,05±0,84 |
7,13±0,11* 6,32±0,05* |
8,19±0,07* 14,21±0,09* |
25,08±0,35* 17,27±0,28 |
34,60±0,34 26,92±0,38 |
0,772±0,005* 0,690±0,004* |
|
10 |
63,20±0,83 87,70±0,73 |
7,46±0,08* 6,42±0,08* |
8,20±0,09* 14,29±0,12* |
25,13±0,38* 17,39±0,26 |
34,64±0,33 27,07±0,48 |
0,768±0,005* 0,687±0,005* |
|
15 |
62,94±1,08 87,69±0,99 |
7,69±0,08* 6,49±0,07* |
8,22±0,09* 14,37±0,11 |
25,46±0,44 17,74±0,45 |
34,69±0,54 27,14±0,42 |
0,770±0,006* 0,688±0,004* |
|
24 |
63,03±1,06 87,63±0,66 |
7,88±0,09 6,55±0,07 |
8,20±0,10 14,44±0,19 |
25,99±0,65 17,85±0,50 |
34,71±0,53 27,12±0,27 |
0,783±0,005* 0,717±0,009 |
|
45 |
64,31±1,09 88,02±0,84 |
8,24±0,09 6,69±0,06 |
8,24±0,09 14,61±0,26 |
26,11±0,50 18,32±0,55 |
34,78±0,48 27,07±0,53 |
0,802±0,006 0,723±0,007 |
|
Группа Б2 |
||||||
|
3 |
64,18±0,99 88,85±0,75* |
6,99±0,09* 6,16±0,09* |
8,33±0,08* 14,53±0,10* |
23,80±0,48* 16,84±0,36* |
34,82±0,41 27,37±0,44 |
0,760±0,009* 0,680±0,004* |
|
10 |
64,07±1,01 89,08±0,75* |
7,41±0,09* 6,26±0,05* |
8,44±0,08* 14,45±0,17* |
24,78±0,47* 17,06±0,25* |
34,92±0,40* 27,19±0,52 |
0,758±0,003* 0,682±0,005* |
|
15 |
64,65±1,05 89,10±0,82* |
7,54±0,10* 6,38±0,06* |
8,40±0,07* 14,37±0,09* |
25,16±0,33* 17,19±0,41 |
34,98±0,51 27,24±0,54 |
0,763±0,004* 0,683±0,005* |
|
24 |
64,77±1,08 88,40±0,84* |
7,64±0,11* 6,46±0,05* |
8,38±0,10* 14,51±0,15 |
25,29±0,42 17,38±0,43 |
35,10±0,61 27,22±0,27 |
0,781±0,005* 0,710±0,006 |
|
45 |
65.68±1,11 88,74±0,71 |
8,13±0,10 6,46±0,09* |
8,38±0,11 14,74±0,22 |
25,68±0,33 18,01±0,39 |
35,08±0,52 27,31±0,51 |
0,785±0,006* 0,713±0,005 |
Примечание: * означает достоверное отличие от контрольных значений.
Полученные данные можно объяснить исходя из установленных механизмов действия бензоата натрия. Во-первых, имеются сведения о способности бензоата натрия вызывать нарушение двухцепочечного спирального строения ДНК ядер и митохондрий гепатоцитов печени [7; 8] и, как следствие, трансляции белка [9]. Во-вторых, влияние воздействия бензоата натрия на фолликулярные клетки щитовидной железы опосредуется через торможение продукции лептина клетками белой жировой ткани. Последний, влияя на аркуатное ядро гипоталамуса, снижает секрецию тиреолиберина и, следовательно, тиреотропина [10]. Последнее обстоятельство приводит к уменьшению функциональной активности фолликулярных клеток, что может объяснить наличие фолликулов с плоским и низким кубическим эпителием в эксперименте. В-третьих, бензоат натрия способен усиливать перекисное окисление липидов и индуцировать апоптоз [11]. Наличие темных ядер, светлой вакуолизированной цитоплазмы, слущенного эпителия в полости фолликулов являются морфологическими признаками апоптоза, который может активизироваться при снижении активности антиоксидантов [12]. Также известно, что окислительный стресс может индуцировать воспалительные процессы [11]. Вышеизложенное объясняет появление (в группе Б1) и последующее увеличение (в группе Б2) количества тироцитов с явлениями апоптоза в поле зрения гистопрепаратов, по сравнению с контролем, на 3, 10, 15 и 24-е сутки эксперимента. Также появление единичного фолликула, заполненного плотными слоистыми скоплениями клеток, на 24-е сутки эксперимента (в группе Б2) может быть конечным результатом локального воспалительного процесса.
Заключение
Введение бензоата натрия в течение 60 суток половозрелым крысам сопровождается как качественными, так и количественными изменениями строения центральных и периферических отделов щитовидной железы. Степень выраженности, а также длительность изменений в ходе периода реадаптации зависит от дозы вводимого пищевого консерванта. В группе после воздействия бензоата натрия в дозе 500 мг/кг массы тела восстановление гистологической картины до контрольного уровня наступает к 15 суткам после окончания введения препарата, при увеличении дозы до 1000 мг/кг изменения сохраняются вплоть до 45 суток наблюдения.
Библиографическая ссылка
Морозов В.Н. ГИСТОМОРФОМЕТРИЧЕСКИЕ ПАРАМЕТРЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ КРЫС В ПЕРИОД РЕАДАПТАЦИИ ПОСЛЕ 60-ТИ ДНЕВНОГО ВОЗДЕЙСТВИЯ БЕНЗОАТА НАТРИЯ // Современные проблемы науки и образования. 2023. № 1. ;URL: https://science-education.ru/ru/article/view?id=32448 (дата обращения: 19.01.2026).
DOI: https://doi.org/10.17513/spno.32448



