По данным Всемирной организации здравоохранения, к 2020 году в мире насчитывалось около 48 млн бесплодных пар [1]. В связи с этим одной из задач современной медицины на сегодняшний день является сохранение фертильности. Среди маркеров, отражающих репродуктивную способность, выделяют показатели овариального резерва. Необходимо подчеркнуть, что сниженный овариальный резерв не приравнивается к бесплодию, но потенциально может привести к значимому нарушению репродуктивной функции [2]. Важным показателем овариального резерва является антимюллеров гормон (АМГ). Антимюллеров гормон - димерный гликопротеин и член семейства трансформирующих факторов роста b (TGF-b). Его рецепторы расположены в стероидных клетках яичников и клетках головного мозга. Высокий уровень экспрессии АМГ присутствует в клетках гранулезы вторичных, преантральных и малых антральных фолликулов ≤4 мм в диаметре [3].
Одним из заболеваний, которое может влиять на снижение фертильности, является ожирение [Ошибка! Источник ссылки не найден.].
Следствиями ожирения являются метаболические нарушения в виде нарушений углеводного и липидного обмена, избыток висцеральной жировой ткани, что и может оказывать влияние на фертильность. Ремоделирование жировой ткани при ожирении тесно связано с репродуктивной функцией. Таким образом, жировую ткань принято считать эндокринным органом, оказывающим значимое влияние на регуляцию разнообразных физиологических процессов, включающих репродукцию, углеводный и липидный метаболизм, благодаря секреции различных биологически активных веществ, именуемых адипокинами. Физиологическая концентрация адипокинов играет важную роль в адекватной работе оси гипоталамус-гипофиз-яичники, а также в обеспечении, успешной имплантации эмбрионов и в самом течении беременности [5]. Для адипокинов характерно достаточно двоякое влияние на инсулинорезистентность. Важное место в формировании инсулинорезистентности занимает адипонектин, который принимает участие в регуляции энергетического баланса, обладает противовоспалительным, антиатерогенным и антигипергликемическим эффектами.
Среди адипокинов выделяют также резистин, который служит предиктором развития инсулинорезистентности, ожирения и сахарного диабета 2 типа. Важным параметром является отношение уровня резистина к уровню адипонектина. В случае развития абдоминального ожирения происходит нарушение адипокинового баланса: уровень резистина повышается, а уровень адипонектина, наоборот, снижается. Эти изменения способствуют развитию метаболических нарушений, таких как гиперинсулинемия, инсулинорезистентность, а также дислипидемия [Ошибка! Источник ссылки не найден.].
Известно, что другой адипокин – лептин, может оказывать воздействие на выработку гонадотропин-рилизинг-гормона (ГнРГ), посредством которого реализуется влияние лептина на репродуктивную систему. Концентрация лептина в организме коррелирует с количеством жировой ткани: чем больше жировой ткани, тем выше концентрация лептина. Однако как при дефиците массы тела, так и при ожирении отмечается снижение репродуктивной функции. Таким образом, высокие концентрации лептина не ассоциированы с улучшением показателей фертильности. Это может быть связано с особенностями ожирения, поскольку подавляющее количество форм ожирения ассоциировано с формированием устойчивости к лептину на центральном уровне за счет снижения экспрессии рецепторов. При этом в других тканях чувствительность к лептину остается сохранной, поэтому они находятся под воздействием высоких доз адипокина. Воздействие высоких концентраций лептина на яичники приводит к нарушению клеточного стероидогенеза и процесса овуляции, что и приводит к нарушению репродуктивной функции [5].
Возможности жировой ткани не ограничиваются продукцией веществ, регулирующих обмен липидов, провоспалительных цитокинов. Ароматизация тестостерона в эстрадиол – одна из ключевых функций, необходимых для поддержания репродуктивного здоровья [7]. В условиях избыточной массы тела и ожирения наблюдается также дефицит рецепторов к половым гормонам на мембране адипоцитов, что определенно вносит вклад в дестабилизацию работы репродуктивной системы. Однако ожирение не единственный фактор, способствующий снижению овариального резерва. В настоящее время активно изучается влияние витамина 25(OH)D на фолликулогенез [8]. В исследовании Wong и соавт. была показана корреляция между снижением экспрессии гена АМГ и снижением количества рецепторов к витамину D [9]. Также доказано влияние витамина D на процессы стероидогенеза [10]. В исследованиях последних лет была продемонстрирована взаимосвязь между дефицитом витамина D и преждевременной недостаточностью яичников [11]. Тем не менее патогенетические механизмы вышеописанных влияний до конца не изучены, и многие положения остаются спорными, что требует проведения дополнительных исследований в этой области. Вполне вероятно, что результаты передовых исследований сделают возможным добавить витамин 25(OH)D в схемы лечения патологий репродуктивной системы, приводящих к преждевременному истощению яичников [12].
Не оставляет сомнений важность воздействия жировой ткани и адипокинов на репродуктивный потенциал женщины, в связи с чем в настоящее время активно изучается влияние снижения массы тела на улучшение показателей фертильности [5]. Снижение веса у женщин является необходимым для возобновления овуляции. Существуют исследования динамики АМГ на фоне низкокалорийного питания и различных лекарственных препаратов, однако эти данные противоречивы [13]. Ряд авторов указывает на улучшение овариального резерва на фоне уменьшения массы тела [14]. В других исследованиях такие взаимосвязи не получены [15]. Совершенствование процесса организации своевременного выявления и лечения пациенток с избыточной массой тела и ожирением, особенно на этапе планирования беременности, является важным условием повышения качества медицинской помощи, увеличения шансов на физиологичное зачатие и улучшения исходов беременности.
Цель исследования – оценить уровень антимюллерова (АМГ) гормона в сыворотке крови у пациенток с разным индексом массы тела, сопоставить содержание АМГ с показателями инсулинорезистентности и концентрацией витамина 25(OH)D и оценить влияние снижения массы тела на концентрацию АМГ.
Материалы и методы исследования. В исследование было включено 77 пациенток молодого репродуктивного возраста (от 20 до 38 лет). От всех участников исследования было получено письменное информированное согласие. Критериями исключения были операции на органах малого таза, химиотерапия или лучевая терапия в анамнезе, опухолевидные образования яичников, синдром поликистозных яичников (СПКЯ), приём комбинированных оральных контрацептивов в течение последних 6 месяцев, беременность, тяжелая соматическая патология; злоупотребление алкоголем, наркомания и токсикомания.
Всем пациентам был выполнен забор крови для определения следующих показателей: АМГ на 3-5 день менструального цикла, глюкоза, инсулин (рассчитан индекс HOMA-IR), 25(OH)D. За референсные показатели были приняты следующие значения: АМГ 0,07-3,39 нг/мл, глюкоза 4,1-6,1 ммоль/л, инсулин 2,6-24,9 мкЕд/мл, индекс HOMA-IR 0-2,7. Концентрация витамина D, согласно рекомендациям Российской ассоциации эндокринологов 2021 года, менее 20 нг/мл расценивается как дефицит витамина D, 20-30 нг/мл - недостаточность витамина D, более 30 нг/мл - нормальный уровень витамина D.
Обработка результатов исследования выполнена с помощью статистической программы SPSS 16.0 (SPSS Inc, США). Количественные признаки представлены в виде среднего арифметического значения ± стандартное отклонение (при нормальном распределении значений признака) или в виде медианы (25; 75 процентили) – при распределении, отличающемся от нормального (значения йодурии). Межгрупповое сравнение значений количественных признаков проводилось с применением t-критерия Стьюдента и U-теста Манна–Уитни соответственно. Сравнение частотных показателей в независимых выборках проведено с помощью критерия Пирсона χ², а при числе наблюдений в одной из ячеек 4-польной таблицы <5 – с помощью точного критерия Фишера. Статистически значимыми считали различия при p < 0,05.
Результаты исследованияи их обсуждение. Средний возраст обследованных женщин составил 27,21±0,67 года. Пациентки в зависимости от индекса массы тела (ИМТ) были разделены на 5 групп: группа 1 – нормальная масса тела (ИМТ<25,0 кг/м2), группа 2 – избыточная масса тела, группа 3 – ожирение I степени (ИМТ 30,0-34,9 кг/м2), группа 4 – ожирение II степени (ИМТ 35,0-39,9 кг/м2), группа 5 – ожирение III степени (ИМТ≥40,0 кг/м2). Все женщины были сопоставимы по возрасту. Результаты обследования представлены в таблице.
Клинико-лабораторная характеристика обследованных женщин с разным индексом массы тела
|
Показатель
Группа |
Индекс ИР (HOMA-IR) |
25(OH)D |
Частота нарушений МЦ (%) |
АМГ (нг/мл) |
|
Группа 1 (n=14) |
2,28±0,12 |
29,02±5,82 |
7,14% |
3,8±0,51 |
|
Группа 2 (n=12) |
4,38±0,54 |
30,71±2,81 |
25% |
3,01±0,72 |
|
Группа 3 (n=10) |
5,02±0,58 |
32,03±1,61 |
42,86% |
3,09±0,43 |
|
Группа 4 (n=11) |
8,54±0,99 |
17,89±2,14 |
45,55% |
2,21±0,31 |
|
Группа 5 (n=30) |
8,93±1,12 |
24,13±2,91 |
60% |
2,54±0,43 |
|
Достоверность различий |
p1-5 = 0,02 |
p1-5 = 0,03 |
p1-5 = 0,01 |
p1-5 = 0,01 |
|
Примечание: ИР – инсулинорезистентность; 25(OH)D - 25 – гидроксивитамин Д; МЦ – менструальный цикл; АМГ – антимюллеров гормон. |
||||
Как видно из представленных данных, у пациенток группы 1 (с нормальным ИМТ) частота нарушений МЦ была значимо меньше по сравнению с группами женщин с большим ИМТ. Наибольший процент нарушения МЦ был выявлен у женщин с морбидным ожирением (60%). В группе 1 (женщины с нормальной массой тела) уровень АМГ был значимо выше по сравнению с группами 2, 3, 4 и 5 (p=0,01). Также была выявлена отрицательная корреляционная связь между ИМТ и АМГ (r=-0,542, p=0,01), то есть по мере увеличения массы тела снижался уровень АМГ.
Уровень глюкозы, инсулина, а также индекс инсулинорезистентности (HOMA-IR) нарастали по мере увеличения ИМТ. Была выявлена обратная корреляционная связь между HOMA-IR и концентрацией АМГ (r=-0,55; p=0,007). Так, по мере увеличения HOMA-IR определялось снижение концентрации АМГ (рис. 1).

Рис. 1. Корреляционная связь между антимюллеровым гормоном и индексом инсулинорезистентности
При анализе уровня витамина 25(OH)D было выявлено снижение его уровня по мере увеличения ИМТ (p=0,03). Также была выявлена положительная корреляционная связь между уровнем АМГ и дефицитом витамина 25(OH)D (r=-0,53; p=0,007).
У всех женщин с избыточной массой тела и ожирением была проведена беседа о важности снижения веса, были даны рекомендации по питанию и физической активности. В дальнейшее в наблюдение была включена 21 пациентка с 1-й и 2-й степенями ожирения. Средний возраст женщин составил 29,21±0,69 года, ИМТ – 34,2±1,92 кг/м2.
Через 6 месяцев была проведена оценка динамики снижения веса, а также определялся уровень АМГ. Было выявлено, что у пациенток, которым удалось снизить массу тела на 5% и более, значимо увеличился уровень АМГ с 3,2 до 3,5 нг/мл (0,049). У пациенток, не снизивших вес, уровень АМГ практически не изменился (p=0,9) (рис. 2).
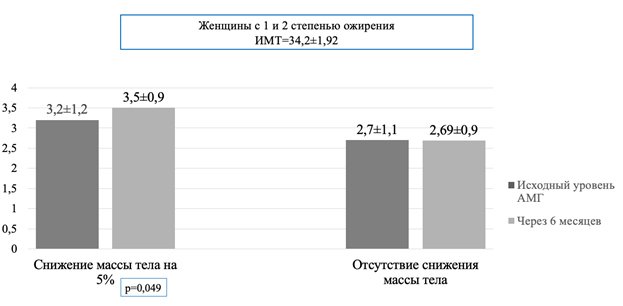
Рис. 2. Изменения антимюллерова гормона после снижения массы тела
Заключение. В настоящем исследовании показано, что у пациенток с ожирением II степени имеется значимое снижение антимюллерова гормона. Выявлена взаимосвязь между ожирением, повышением HOMA-IR, дефицитом витамина 25(OH)D и уровнем АМГ. Также было показано, что снижение массы тела способствует повышению уровня антимюллерова гормона. Представляется важным изучить влияние снижения массы тела на улучшение показателей овариального резерва. Снижение массы тела у больных ожирением и сниженным овариальным резервом не всегда сопровождается значимым повышением АМГ. Таким образом, необходимы дальнейшие работы по изучению показателей овариального резерва на фоне применения различных подходов к снижению веса у женщин репродуктивного возраста.
Библиографическая ссылка
Азизова К.В., Дора С.В., Волкова А.Р., Кульчицкая Е.А., Черебилло И.В. РОЛЬ ОЖИРЕНИЯ В РАЗВИТИИ РЕПРОДУКТИВНЫХ НАРУШЕНИЙ У ЖЕНЩИН: ПУТИ ПРЕОДОЛЕНИЯ // Современные проблемы науки и образования. 2023. № 1. ;URL: https://science-education.ru/ru/article/view?id=32440 (дата обращения: 06.02.2026).
DOI: https://doi.org/10.17513/spno.32440



