Гастроинтестинальные стромальные опухоли (ГИСО, gastrointestinal stromal tumors, GIST) представляют собой новообразования с различным потенциалом злокачественности, начиная от практически вялотекущих опухолей и заканчивая быстро прогрессирующими формами рака.
Впервые в качестве диагностического термина ГИСО была предложена профессорами М.Т. Мазуром и Х.Б. Кларком в 1983 г. [1]. Первоначально считалось, что ГИСО развиваются из стромальных клеток желудочно-кишечного тракта. В 1998 г. Kindblom было обнаружено, что эти опухоли в конечном итоге произошли из интерстициальных клеток Кахаля, регулирующих перистальтику ЖКТ [2]. Hirota и его коллеги обнаружили, что эти опухоли экспрессируют антиген CD117 (C-Kit) – мутацию, ответственную за активацию роста этих образований [3].
В последние годы было идентифицировано несколько типов биомаркеров GIST. Zequn Li и соавторами был открыт белок TIPE2 [4]. TIPE2 был идентифицирован как биомаркер для оценки степени риска ГИСО. TIPE2 заметно подавлял жизнеспособность, образование колоний, миграцию и инвазию клеток ГИСО. TIPE2 играл ключевую роль в прогрессировании ГИСО. TIPE2 служит многообещающим биомаркером для оценки степени риска ГИСО и потенциальной мишенью для лечения ГИСО.
Последующие исследования показали, что DOG1, известный и как TMEM16A или ANO1, также является диагностическим маркером ГИСО [5]. И DOG1, и KIT могут служить в качестве положительного контроля для иммуногистохимического анализа.
Особый интерес к ГИСО связан с тем, что они считаются первым примером успешной таргетной терапии солидных опухолей ингибиторами тирозинкиназ (ТК) [6].
Клинико-морфологические особенности ГИСО
Хотя ГИСО считаются редкими опухолями, большинство из них обнаруживаются случайно. Они различаются по локализации, размеру, гистологическому типу клеток, степени злокачественности, риску прогрессии и клиническому течению.
ГИСО может быть наследуемым заболеванием: в некоторых семьях с высокой частотой ГИСО выявлены герминальные мутации [7]. Встречаются ГИСО и у детей [8]. В США ежегодно выявляют 5–10 тыс. новых случаев ГИСО, что составляет 0,7 на 100 000 человек в год. Заболеваемость у мужчин в 1,5 раза выше, чем у женщин. Частота ГИСО у европеоидов в 1,5 раза ниже, чем у представителей других рас. Средний возраст заболевших – 62,9 года [9]. В России точных данных по заболеваемости нет, расчетная частота составляет 2000– 2500 случаев в год [10, 11].
Большинство опухолей образуются в желудке или тонком кишечнике (60%), включая тощую кишку или подвздошную кишку (30%). Редко опухоли возникают в двенадцатиперстной кишке (4–5%), толстой кишке, аппендиксе (1–2%), пищеводе (1%), а иногда и вне желудочно-кишечного тракта [12, 13].
Клинико-патологические характеристики ГИСО тощей и двенадцатиперстной кишки – наиболее частым симптомом является кровотечение, за которым следует боль в животе [14].
Современная классификация и дифференциальная диагностика ГИСО
ГИСО возникают из интерстициальных клеток Кахаля, которые являются электрическими водителями ритма и медиаторами энтеральной нейротрансмиссии в мышечной оболочке желудочно-кишечного тракта [15]. ГИСО могут локализоваться в любом месте желудочно-кишечного тракта и редко – в брюшине и забрюшинном пространстве. Гистопатологическая оценка важна как для диагностики, так и для стратификации риска у пациентов с ГИСО.
При окрашивании гематоксилином-эозином ГИСО морфологически классифицируются как веретеноклеточный тип (70%), эпителиоидно-клеточный тип (20%) или смешанный тип [16, 17]. Типы веретенообразных и эпителиоидных клеток, по-видимому, соответствуют лейомиомам и лейомиобластомам в классификации до того, как были определены ГИСО. Веретенообразные клетки имеют длинную, тощую или веретенообразную форму, а эпителиоидные клетки имеют круглую или полигональную форму. ГИСО смешанного типа включают как веретеновидный, так и эпителиоидный компоненты.
В зависимости от морфологии проводится иммуногистохимия, необходимая для отличия ГИСО от других опухолей. Для этого используют KIT, десмин, белок S100, α-гладкомышечный актин, CD34, обнаруженный на GIST-1, преобразователь сигнала и активатор транскрипции 6, β-катенин и киназу анапластической лимфомы [18]. Ki-67 полезен для оценки биологической агрессивности GIST. Сукцинатдегидрогеназа B (SDHB) необходима для субтипирования GIST [19].
82–87% ГИСО содержат активирующие мутации в KIT или PDGFRA [20]. Они оба представляют собой рецепторную тирозинкиназу типа III с высокой гомологией и сходными нисходящими сигнальными путями, но взаимоисключающими. Мутации в KIT в основном происходят в экзоне 11, который может активировать киназу путем разрушения самоингибирующей функции околомембранного домена, за которым следует экзон 9, который также может активировать киназу. Хотя мутации в экзоне 13 и экзоне 17 очень редки, они распространены во вторичных мутациях и имеют важное клиническое значение при вторичной лекарственной устойчивости. Мутации PDGFRA часто возникают в экзоне 18, что еще больше стабилизирует активный статус киназы, но редко – в экзоне 12 и экзоне 149. Мутации KIT или PDGFRA приводят к конститутивной и независимой от лиганда активации рецептора, которая затем активирует нижестоящие сигнальные пути, включая путь киназы MAP (RAF, MEK, ERK), путь STAT и путь PI3K/AKT. Однако существуют значительные различия в активации нижестоящих сигнальных путей при различных мутантных типах ГИСО, что объясняет различия в биологическом поведении опухолей [21, 22].
Терапия ГИСО
Традиционная химиотерапия и лучевая терапия не эффективны при ГИСО. Хирургическая резекция всегда была основой лечения данных заболеваний [23, 24]. В качестве адъювантной терапии применялись доксорубицин и дакарбазин.
Ранее лечение ГИСО включало последовательное применение иматиниба, сунитиниба и регорафениба независимо от генотипа. Этот подход обеспечил начальную пользу для определенных молекулярных подмножеств ГИСО (например, мутантов KIT) и незначительную пользу или никакой пользы для других (например, мутантов PDGFRA D842V). Повышенное понимание биологии ГИСО выявило явную гетерогенность среди молекулярных подтипов и соответствующую потребность в новых терапевтических средствах, направленных на специфические для подтипов ГИСО. Недавно это было подтверждено успехом авапритиниба в лечении ГИСО с мутантным PDGFRA D842V, что побудило одобрить авапритиниб в качестве терапии первой линии для этого подтипа при неоперабельных или метастатических условиях [22, 25].
Факторы прогноза ГИСО
Наибольшее значение при определении прогноза для пациента с ГИСО имеют расположение и размеры опухоли, наличие распада и показатели митоза. Такие факторы, как возраст, пол, курение, употребление алкоголя и желудочно-кишечное кровотечение, не показали наличия достоверной корреляции с прогнозом 5-летней выживаемости пациентов.
Общий показатель пятилетней выживаемости с применением химиотерапии и хирургического лечения по современным схемам вырос с 10–30% до 75–85%. Частота возникновения рецидивов снизилась с 60–70% до 30–40% [17–19].
Клинический случай
Пациентка М., 80 лет, поступила в тяжелом состоянии с жалобами на рвоту кровянистым содержимым и содержимым вида кофейной гущи, выраженную слабость и боли в эпигастральной области. При пальпации живот болезненный в эпигастральной и околопупочной областях, в эпигастральной области определяется плотное округлое образование.
Была проведена ФГДС: Опухоль малой кривизны желудка диаметром 7 см с глубоким изъязвлением диаметром 4 см с активным кровотечением. Большая площадь кровоточащей поверхности обусловливает невозможность эндоскопического гемостаза. Была назначена консервативная гемостатическая терапия и заместительная терапия препаратами крови.
Клиника гемической гипоксии и сердечно-сосудистой недостаточности нарастала, пациентка переведена в ОРИТ, проводилась вазопрессорная терапия. Несмотря на проводимое лечение, на вторые сутки от момента госпитализации диагностированы остановка дыхания и сердечной деятельности, реанимационные мероприятия безуспешны, констатирована биологическая смерть.
Заключительный клинический диагноз:
Основное заболевание: Рак желудка TxNxMx.
Осложнения основного заболевания: Желудочно-кишечное кровотечение. Анемия смешанного генеза тяжелой степени. Острая сердечно-сосудистая недостаточность.
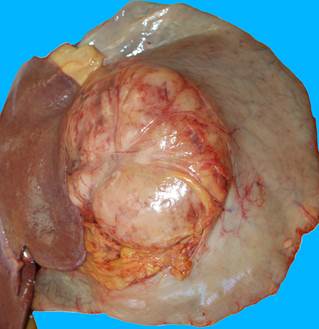
Рис. 1. Макропрепарат. Опухоль (ГИСО) малой кривизны желудка
При патологоанатомическом исследовании в желудке кровянистое содержимое объемом до 300 мл, слизистая оболочка сглаженная, пропитана кровью. В области малой кривизны стенка желудка утолщена, из нее произрастает округлое образование диаметром 18 см (рис. 1), на разрезе белесоватого цвета, с крупной извилистой полостью, открывающейся в просвет желудка в виде язвы диаметром 4 см (рис. 2). В тонкой кишке кровянистое содержимое.
При гистологическом исследовании – стенка желудка с умеренным кровенаполнением, некрозом поверхностных слоев эпителия слизистой оболочки, выраженная лимфоидная инфильтрация слизистого, подслизистого и мышечного слоев. В адвентиции – разрастание огромного поля опухолевой ткани, построенной из веретеновидных клеток, со слабо выраженным клеточным атипизмом, единичными фигурами митозов (рис. 3).
Проведено иммуногистохимическое исследование: опухоль имеет резко положительную окраску KIT (CD117) и отрицательную – десмином и S100, что позволило дифференцировать ГИСО от лейомиомы.
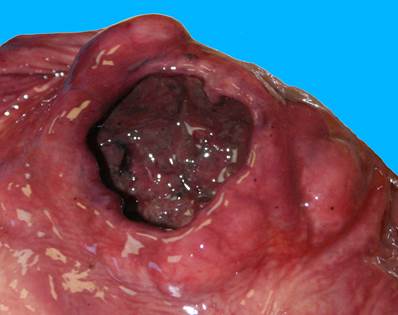
Рис. 2. Макропрепарат. Опухоль (ГИСО) желудка с изъязвлением и кровотечением
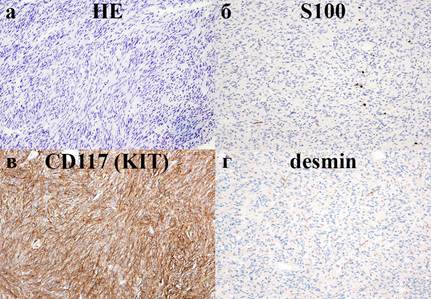
Рис. 3. Микропрепарат. ГИСО, веретеноклеточный склерозирующий вариант.
а) веретеновидные клетки, окраска: гематоксилин, эозин; б) S100 отрицательный; в)KIT резко положительный; г) десмин отрицательный. х200
Был сформулирован заключительный патологоанатомический диагноз:
Основное заболевание: Гастроинтестинальная стромальная опухоль желудка (ГИСО, гистологически – веретеноклеточный склерозирующий вариант) с распадом. T4N0M0.
Осложнения основного заболевания: Массивное желудочное кровотечение. Острая постгеморрагическая анемия тяжелой степени (Hb крови 67 г/л). Отек легких.
Обсуждение
Очевидно, что клинический случай является экзотическим наблюдением гигантских размеров ГИСО желудка. Опухоли этой группы часто обнаруживаются при патологоанатомических вскрытиях или при исследованиях биопсийного и операционного материала и редко представляют большой практический и научный интерес. Веретеноклеточные варианты ГИСО, характеризующиеся слабо выраженной злокачественностью и часто лишенные какой-либо клинической картины, чаще являются субъектами сопутствующего диагноза.
Данный клинический случай показывает, что степень злокачественности не всегда коррелирует с прогнозом для жизни и здоровья. Огромных размеров опухоль, с явными нарушениями трофики в узле, подвержена распаду и изъязвлению, чему способствует и агрессивная среда в просвете желудка. Авторы не сомневаются, что ранняя диагностика в данном случае, до развития летального кровотечения, могла и должна была быть осуществлена, а своевременное оперативное лечение могло улучшить прогноз для пациента.
Заключение
В работе показаны проблема диагностики ГИСО, связанная с отсутствием явных диагностических признаков, а также риск развития осложнений, способных привести к летальному исходу. Представленное клиническое наблюдение демонстрирует разнородность симптоматики опухолей желудка, что позволяет им на протяжении долгого времени оставаться одной из наиболее сложных проблем опухолей желудочно-кишечного тракта.
Библиографическая ссылка
Яшин С.С., Меликджанян М.В., Писарев Д.В., Сухачев П.А., Исакова Н.В., Юнусова Ю.Р., Кириченко Н.Д. ГАСТРОИНТЕСТИНАЛЬНЫЕ СТРОМАЛЬНЫЕ ОПУХОЛИ: ОБЗОР ЛИТЕРАТУРЫ И ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ ГИГАНТСКОЙ ОПУХОЛИ ЖЕЛУДКА // Современные проблемы науки и образования. 2023. № 1. ;URL: https://science-education.ru/ru/article/view?id=32420 (дата обращения: 22.01.2026).
DOI: https://doi.org/10.17513/spno.32420



