Неалкогольная жировая болезнь печени (НАЖБП) характеризуется наличием избыточного накопления жира в печени (>5%) без значительного употребления алкоголя, вирусной инфекции гепатита или других вторичных причин накопления жира в печени [1]. Спектр НАЖБП варьируется от простой неалкогольной жировой дистрофии печени (НАЖБП) до неалкогольного стеатогепатита (НАСГ), который со временем может привести к циррозу печени, гепатоцеллюлярной карциноме и органной недостаточности [2]. Многие эпидемиологические исследования показали, что НАЖБП тесно связана с метаболическими нарушениями, такими как ожирение [3, 4] и сахарный диабет 2-го типа (СД2) [5–7]. Анализ причинно-следственной связи между этими тремя заболеваниями имеет значение как для понимания этиологии заболевания, так и для разработки эффективных диагностических, терапевтических и профилактических стратегий. Выяснение причинно-следственной связи из-за различных смешанных факторов (например, образа жизни, социально-экономического статуса) или смещения обратной причинности весьма затруднено [8], и в результате эти заболевания часто рассматриваются как сопутствующие друг другу.
Недавние исследования показали, что глобальная распространенность СД2 составляет 22,5% среди пациентов с рентгенологически определенной НАЖБП. СД2 среди пациентов с гистологически подтвержденным НАСГ составляет 43,6% [1]. Другие исследования показали, что распространенность НАЖБП по данным магнитно-резонансной спектроскопии и гистологически подтвержденного НАСГ у пациентов с СД2 и нормальными ферментами печени составляет 50% и 56% соответственно [9]. Эти данные подтверждают двунаправленную связь между СД2 и НАЖБП/НАСГ, которые имеют общий патогенетический механизм [10, 11].
В настоящее время большое количество исследований подтверждает, что данные коморбидные заболевания зависят от сочетания влияния множественных генетических и средовых факторов. Так, в своих исследованиях P. Dongiovanni et al. (2018) показали, что генетически обусловленный стеатоз печени был связан с резистентностью к инсулину и небольшим увеличением риска развития СД2 [10]. S. Stender et al. (2017) обнаружили, что генетические предикторы индекса массы тела (ИМТ) были связаны с НАЖБП [12]. Z. Liu et al. (2020) предполагают, что генетически обусловленная НАЖБП способствует развитию СД2 с поздним началом диабетического субфенотипа типа 1 и центральным ожирением, в то время как генетически обусловленный СД2, ожирение и центральное ожирение увеличивают риск НАЖБП. Их исследование показало, что вариант 148M гена PNPLA3 приводит к НАЖБП и накоплению жира в центральных органах, что может привести к хроническому воспалению тканей, изменению передачи сигналов инсулина/глюкагона и дальнейшему снижению толерантности к глюкозе [13]. В своих исследованиях W.H. Liao et al. (2016) и K.K.Y. Ho et al. (2018) установили, что НАЖБП может также способствовать потемнению и термогенезу периферической жировой ткани при сохранении нормального профиля циркулирующих липидов. Они обнаружили, что экспрессия генов термогенного пути была значительно усилена в подкожной белой жировой ткани и бурой жировой ткани, но не в эпидидимальном жире, что позволяет предположить, что носители -I148M могут проявлять повышенный термогенез за счет превращения подкожного жира в тепло. Их исследования показали, что термогенез является физиологической защитой от ожирения, которая ограничивает увеличение веса в ответ на метаболический стресс [14, 15]. Предполагается, что повышенное накопление висцерального жира и активированный термогенез в подкожном жире могут отражать генетическую адаптацию к холодовому стрессу во время эволюции и миграции человека, учитывая резкое увеличение частоты аллеля PNPLA3-148M от африканцев (<10 %) к евразийцам (20–40%) и к коренным американцам (70–80%) [16].
Ранее проведенное нами исследование якутской популяции на вариабельность гена PNPLA3 показало высокую частоту рискового аллеля G (70,4%) у якутов [17].
Цель исследования: анализ биохимических показателей крови и индекса массы тела у якутов, страдающих сахарным диабетом 2-го типа и НАЖБП, в зависимости от генотипа полиморфизма rs738409 гена PNPLA3.
Материалы и методы исследования. Работа была проведена на базе лаборатории наследственной патологии отдела молекулярной генетики Якутского научного центра комплексных медицинских проблем. Образцы ДНК в количестве 386 штук взяты из коллекции биоматериала ЯНЦ КМП с использованием УНУ «Геном Якутии» (рег. № USU_507512). Все участники молекулярно-генетического исследования были добровольцами. Исследование было одобрено локальным комитетом по биомедицинской этике при ЯНЦ КМП.
Выборка была сформирована по этническому признаку, все участники являются якутами. Выборка состояла из 137 пациентов эндокринологического отделения Республиканской больницы № 2 Государственного бюджетного учреждения «Центр экстренной медицинской помощи» с диагнозом СД 2-го типа. Исследуемая выборка была разделена на две подгруппы: первая подгруппа – 67 пациентов с диагностированной НАЖБП и вторая подгруппа – 70 человек без НАЖБП. Группой сравнения служила выборка из 249 добровольцев без хронических заболеваний.
Критериями включения в исследование были: отсутствие поражение печени хроническими вирусными гепатитами, аутоиммунный гепатит, первичный билиарный холангит, первичный склерозирующий холангит, наследственный гемохроматоз, болезнь Вильсона–Коновалова, а также отсутствие злоупотребления алкоголем (>30 г/л).
Анкета для каждого участника была заполнена при личном осмотре. Рост и вес измерялись у участников без обуви и верхней одежды. ИМТ рассчитывали путем деления веса (кг) на квадрат роста (м2). После не менее чем 12-часового ночного голодания брали образец венозной крови для биохимического исследования. Все гематологические и биохимические исследования были проведены в эндокринологическом отделении Республиканской больницы № 2.
Для проведения молекулярно-генетического анализа образцы геномной ДНК выделяли из цельной крови коммерческим набором для выделения ДНК Excell biotech (г. Якутск, Россия). Амплификация области гена, содержащего полиморфный вариант, проводилась стандартными парами праймеров (форвард праймер: 5’-TGGGCCTGAAGTCCGAGGGT-3’ и реверс праймер: 5’- CCGACACCAGTGCCCTGCAG-3’) (ООО «Биотех-Индустрия», г. Москва) для анализа полиморфизма rs738409. Состав реакционной смеси для ПЦР (общий объем реакционной смеси – 25 мкл): 18 мкл ddH2O, 2,5 мкл 10xПЦР буфер с MgCl2, 2,5 мкл dNTP Mix, 0,5 мкл каждого олигонуклеотидного праймера, 0,5 мкл Taq-полимеразы и 1 мкл ДНК. Температурные условия ПЦР были следующими: 95°C – 5 мин, затем 37 циклов при 94°C – 30 сек, 66°C – 30 сек и 72°C – 40 сек и заключительная элонгация при 72°C – 5 минут. Затем продукты ПЦР разрезали с помощью рестриктазы BstF5 I (ООО «СибЭнзим», г. Новосибирск) в течение 16 часов при 65°С. Детекция ПДРФ продуктов проводилась с помощью горизонтального электрофореза в пластине 4%-ного агарозного геля, окрашенного бромистым этидием, с использованием стандартного трис-ацетатного буфера при 120 В в течение 1 часа. Визуализацию рестрикционных продуктов проводили в UV-лучах c использованием гель-документирующей системы (рис. 1).
Интерпретация результатов генотипирования была выполнена на основе различных шаблонов бэндов: CC генотип 200 и 133 п.н., CG генотип – 333, 200 и 133 п.н., GG генотип –333 п.н.
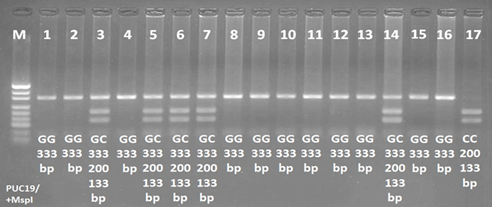
Рис. 1. Электрофореграмма продукта амплификации участка гена PNPLA3 в 4%-ном агарозном геле. 17 – генотип CC; 3, 5, 6, 7, 14 – генотип GC; 1, 2, 4, 8, 9, 10, 11, 12, 13, 15, 16 – генотип GG; М – маркер PUC19/+Msp I; bp – пар оснований
Статистическую обработку полученных данных проводили с помощью программы «Office Microsoft Excel 2010». При анализе сопряженности частоты неблагоприятного аллеля G с заболеванием использовали четырехпольную таблицу сопряженности и критерий χ-квадрат с поправкой Йейтса с расчетом отношения шансов (OR). Для оценки значимости отношения шансов рассчитывались границы 95%-ного доверительного интервала (95% CI). Средние биохимические показатели крови, веса и ИМТ в зависимости от генотипа сравнивали с помощью t-критерия Стьюдента по следующей формуле:
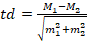 ,
,
где 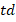 – t-критерий Стьюдента,
– t-критерий Стьюдента, 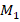 и
и 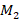 – сравниваемые (сопоставляемые) средние величины;
– сравниваемые (сопоставляемые) средние величины; 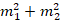 – соответствующие средние (стандартные) ошибки.
– соответствующие средние (стандартные) ошибки.
Далее величину t-критерия сопоставляли с его граничным значением, различия считались достоверными при p<0,05.
Результаты исследования и их обсуждение. В исследовании участвовали 137 пациентов с сахарным диабетом 2-го типа, средний возраст которых составил 59,6±0,07 года, ИМТ 31,2±0,07 кг/м2. Часть из них, помимо СД2, страдали НАЖБП (n=67). Средний возраст выборки здоровых добровольцев составил 34,23±0,06 года, ИМТ 22,9±0,10 кг/м2.
Распределение аллелей и генотипов с расчетом отношения шансов (OR) для аллеля G полиморфизма rs738409 гена PNPLA3 среди пациентов с СД 2-го типа и здоровой выборкой показано в таблице 1.
Таблица 1
Распределение аллелей и генотипов с расчетом отношения шансов (OR) для аллеля G полиморфизма rs738409 гена PNPLA3
|
Аллели, генотипы и Se |
Группа |
Здоровые |
Хи-квадрат |
OR (ДИ 95%) |
p |
|
СД2 с НАЖБП (n=67) |
|||||
|
СС |
11,9 |
14,5 |
0,31 |
1,15 (0,74–1,78) |
0,85 |
|
CG |
25,4 |
25,7 |
|||
|
GG |
62,7 |
59,8 |
|||
|
С |
0,25 |
0,27 |
0,26 |
0,61 |
|
|
G |
0,75 |
0,73 |
|||
|
Se |
0,001 |
0 |
– |
– |
– |
|
СД2 без НАЖБП (n=70) |
|||||
|
СС |
11,4 |
14,5 |
2,78 |
0,91 (0,60-1,37) |
0,25 |
|
CG |
35,7 |
25,7 |
|||
|
GG |
52,9 |
59,8 |
|||
|
С |
0,29 |
0,27 |
0,13 |
0,72 |
|
|
G |
0,71 |
0,73 |
|||
|
Se |
0,001 |
0 |
– |
– |
– |
Примечание: n – количество человек, OR – отношение шансов, Sе – статистическая ошибка частоты аллеля или генотипа, p – значимость хи-квадрат с поправкой Иейтса. ДИ – доверительный интервал
При анализе связи аллелей и генотипов полиморфизма rs738409 гена PNPLA3 с сахарным диабетом 2-го типа достоверной связи выявлено не было ни в одной исследованной группе.
Распределение аллелей и генотипов с расчетом отношения шансов (OR) среди пациентов с СД 2-го типа с НАЖБП и без НАЖБП представлено в таблице 2.
Таблица 2
Распределение аллелей и генотипов с расчетом отношения шансов (OR) для аллеля G полиморфизма rs738409 гена PNPLA3 в подгруппе больных СД2 с НАЖБП в сравнении с группой больных СД2 без НАЖБП
|
Аллели, генотипы и Se |
СД2 + НАЖБП |
СД2 без НАЖБП |
Хи-квадрат |
OR (ДИ 95 %) |
p |
|
СС |
11,9 |
11,4 |
1,77 |
1,27 (0,74–2,17) |
0,41 |
|
CG |
25,4 |
35,7 |
|||
|
GG |
62,7 |
52,9 |
|||
|
С |
0,25 |
0,293 |
0,54 |
0,46 |
|
|
G |
0,75 |
0,71 |
|||
|
Se |
0,001 |
0,001 |
Примечание: n – количество человек, OR – отношение шансов, Sе – статистическая ошибка частоты аллеля или генотипа, p – значимость хи-квадрат с поправкой Иейтса. ДИ – доверительный интервал
Распределение биохимических показателей крови и индекса массы тела в зависимости от генотипа представлено в таблицах 3, 4 и 5.
Таблица 3
Средние биохимические показатели крови и индекса массы тела добровольцев без хронических заболеваний в зависимости от генотипа полиморфизма rs738409 гена PNPLA3
|
Характеристика |
Генотипы (n=249) |
t |
|||||||
|
СС (n=36; 14,5%) |
CG (n=64; 25,7%) |
GG (n=149; 59,8%) |
GG vs CC |
р |
GG vs CG |
р |
CG vs CC |
р |
|
|
ИМТ |
22,57±0,14 |
22,64±0,17 |
22,52±0,19 |
0,21 |
0,83 |
0,47 |
0,638 |
0,32 |
0,75 |
|
Глюкоза натощак, ммоль/л |
5,00±0,56 |
5,17±0,16 |
5,38±0,37 |
0,57 |
0,57 |
0,52 |
0,60 |
0,29 |
0,77 |
|
Триглицериды, ммоль/л |
1,7±0,18
|
1,62±0,18
|
1,86±0,29 |
0,47 |
0,64 |
0,7 |
0,48 |
0,31 |
0,75 |
|
Холестерин, ммоль/л |
5,20±0,66 |
4,99±0,18 |
5,23±0,26 |
0,04 |
0,97 |
0,76 |
0,45 |
0,31 |
0,76 |
|
ЛПВП, ммоль/л |
1,03±0,15 |
1,41±0,16 |
1,32±0,98 |
0,29 |
0,77 |
0,09 |
0,93 |
1,73 |
0,09 |
|
ЛПНП, ммоль/л |
3,13±0,43 |
3,27±0,98 |
2,79±0,22 |
0,7 |
0,48 |
0,48 |
0,63 |
0,13 |
0,90 |
|
АСТ, Ед/л |
22,93±3,18 |
31,58±6,39 |
20,71±0,97 |
0,67 |
0,51 |
1,69 |
0,09 |
1,22 |
0,23 |
|
АЛТ, Ед/л |
21,32±0,91 |
20,97±0,94 |
22,75±0,15 |
1,55 |
0,12 |
1,87 |
0,06 |
0,27 |
0,79 |
|
АСТ/АЛТ |
0,97±0,43 |
1,08±0,32 |
1,00±0,19 |
0,06 |
0,95 |
0,21 |
0,83 |
0,21 |
0,84 |
|
Общий билирубин, мкмоль/л |
10,09±0,12 |
10,63±0,23 |
10,20±0,28 |
0,36 |
0,72 |
1,19 |
0,24 |
2,08 |
0,04 |
Примечание: t-критерий Стьюдента, n – количество человек, p – значимость, vs – против.
Таблица 4
Средние биохимические показатели крови и индекса массы тела пациентов с СД2 и НАЖБП в зависимости от генотипа полиморфизма rs738409 гена PNPLA3
|
Характеристика |
Генотипы (n=67) |
t |
|||||||
|
СС (n=8; 11,9%) |
CG (n=17; 25,4%) |
GG (n=42; 62,7%) |
GG vs CC |
р |
GG vs CG |
р |
CG vs CC |
р |
|
|
ИМТ |
32,75±0,90 |
31,19±0,97 |
32,35±0,14 |
0,44 |
0,66 |
1,19 |
0,24 |
1,18 |
0,25 |
|
Глюкоза натощак, ммоль/л |
9,41±1,65 |
7,56±0,47 |
9,00±0,39 |
0,24 |
0,81 |
2,34 |
0,02 |
1,08 |
0,29 |
|
Триглицериды, ммоль/л |
1,85±0,26 |
1,72±0,14 |
1,85±0,16 |
0 |
1,00 |
0,6 |
0,553 |
0,44 |
0,667 |
|
Холестерин, ммоль/л |
5,55±0,44 |
5,47±0,20 |
5,17±0,17 |
0,81 |
0,425 |
1,12 |
0,267 |
0,17 |
0,87 |
|
ЛПВП, ммоль/л |
1,08±0,08 |
1,60±0,26 |
1,36±0,17 |
1,45 |
0,15 |
0,77 |
0,44 |
1,93 |
0,07 |
|
ЛПНП, ммоль/л |
2,93±0,62 |
3,21±0,27 |
2,79±0,21 |
0,21 |
0,83 |
1,23 |
0,22 |
0,42 |
0,68 |
|
АСТ, Ед/л |
22,59±3,19 |
23,86±5,15 |
20,76±0,30 |
0,57 |
0,57 |
0,60 |
0,55 |
0,21 |
0,84 |
|
АЛТ, Ед/л |
23,96±6,58 |
22,04±3,10 |
23,33±0,32 |
0,10 |
0,92 |
0,41 |
0,68 |
0,26 |
0,79 |
|
АСТ/АЛТ |
1,24±0,29 |
1,15±0,16 |
0,95±0,12 |
0,92 |
0,36 |
0,57 |
0,57 |
0,27 |
0,79 |
|
Общий билирубин, мкмоль/л |
18,34±10,13 |
9,88±1,50 |
9,58±0,37 |
0,86 |
0,39 |
0,14 |
0,89 |
0,83 |
0,42 |
Примечание: t-критерий Стьюдента, n – количество человек, p – значимость, vs – против.
Таблица 5
Средние биохимические показатели крови и индекса массы тела пациентов подгруппы с СД2 без НАЖБП в зависимости от генотипа полиморфизма rs738409 гена PNPLA3
|
Характеристика |
Генотипы (n=70) |
t |
|||||||
|
СС (n=8; 11,4%) |
CG (n=25; 35,7%) |
GG (n=37; 52,8%) |
GG vs CC |
р |
GG vs CG |
р |
CG vs CC |
р |
|
|
ИМТ |
33,36±2,05 |
31,16±1,28 |
29,62±0,18 |
1,82 |
0,08 |
1,19 |
0,24 |
0,91 |
0,37 |
|
Глюкоза натощак, ммоль/л |
9,33±1,58 |
9,68±1,04 |
9,38±0,41 |
0,03 |
0,98 |
0,27 |
0,79 |
0,18 |
0,85 |
|
Триглицериды, ммоль/л |
2,18±0,53 |
1,67±0,17 |
2,69±0,74 |
0,56 |
0,58 |
1,35 |
0,18 |
0,92 |
0,37 |
|
Холестерин, ммоль/л |
5,20±0,66 |
4,41±0,28 |
4,90±0,16 |
0,44 |
0,66 |
1,52 |
0,13 |
1,10 |
0,28 |
|
ЛПВП, ммоль/л |
1,24±0,14 |
1,25±0,13 |
1,31±0,13 |
0,37 |
0,71 |
0,32 |
0,75 |
0,05 |
0,96 |
|
ЛПНП, ммоль/л |
2,86±0,40 |
3,21±0,38 |
2,93±0,19 |
0,16 |
0,87 |
0,65 |
0,52 |
0,63 |
0,53 |
|
АСТ, Ед/л |
15,05±0,76 |
20,14±2,85 |
18,46±0,33 |
4,11 |
0,0002 |
0,59 |
0,56 |
1,73 |
0,09 |
|
АЛТ, Ед/л |
16,8±2,50 |
23,94±4,24 |
22,32±0,30 |
2,19 |
0,03 |
0,38 |
0,70 |
1,45 |
0,16 |
|
АСТ/АЛТ |
0,97±0,09 |
0,94±0,07 |
1,00±0,33 |
0,09 |
0,93 |
0,18 |
0,86 |
0,27 |
0,79 |
|
Общий билирубин, мкмоль/л |
8,41±0,74 |
9,06±1,18 |
10,78±0,28 |
2,99 |
0,005 |
1,42 |
0,16 |
0,47 |
0,64 |
Примечание: t-критерий Стьюдента, n – количество человек, p – значимость, vs – против.
При оценке показателей биохимического анализа крови в группах пациентов с СД2 отмечается высокий уровень глюкозы натощак независимо от генотипа (от 7,56±0,47 до 9,68±1,04 ммоль/л). Выявлено повышение триглицеридов в крови выше нормального уровня в группе СД2 без НАЖБП у носителей генотипа GG (2,69±0,74 ммоль/л).
При сравнении ИМТ в зависимости от генотипа установили, что в обеих группах пациентов с СД 2-го типа его средние значения были выше нормы. Нужно отметить, что наблюдается некий градиент значений ИМТ по генотипам полиморфизма rs738409 в группе с СД2 без НАЖБП. Так, выше ИМТ у носителей генотипа СС (33,36±2,05) (табл. 5) и соответственно ниже ИМТ у носителей генотипа GG (29,62±0,18).
НАЖБП, СД2 и ожирение эпидемиологически коррелируют друг с другом, но причинно-следственная связь между ними остается не до конца изученной. Согласно недавно проведенным исследованиям, генетически обусловленная НАЖБП значительно увеличивает риск СД2 и центрального ожирения, но не резистентностью к инсулину или генерализованному ожирению, в то время как генетически обусловленный СД2 и ИМТ причинно увеличивали риск развития НАЖБП. Исследование на животных, посвященное гену PNPLA3, подтвердило эти причинно-следственные эффекты: по сравнению с контрольной группой у трансгенных мышей, экспрессирующих изоформы PNPLA3-I148M человека, развилась непереносимость глюкозы и увеличено количество висцерального жира, но сохранялась нормальная чувствительность к инсулину, снижена масса тела и снижен уровень общего холестерина в крови. Предполагается, что пожизненная генетически обусловленная НАЖБП причинно способствует развитию СД2 с поздним началом диабетического субфенотипа типа 1 и центральным ожирением, в то время как генетически обусловленный СД2, ожирение и центральное ожирение причинно увеличивают риск НАЖБП.
Стало известно, что генотип GG гена PNPLA3 и его взаимодействие с изменением массы тела усугубляют стеатоз печени, но защищают от повышенного риска возникновения диабета. Взаимодействие между генотипом GG и изменениями массы тела при НАЖБП сильно зависит от метаболического статуса человека.
Причины различий во влиянии полиморфизмов PNPLA3 на прогрессирование и ремиссию НАЖБП при различных метаболических состояниях неизвестны. Лабораторные исследования показали, что вариант G PNPLA3 сам по себе был недостаточен для того, чтобы вызвать стеатоз печени у мышей, которых кормили продуктами с высоким содержанием жиров (45% ккал), но вызывал двух-трехкратное увеличение риска НАЖБП у мышей, которых кормили продуктами с высоким содержанием сахарозы (58% сахарозы, 0% жира или 74% сахарозы) [18].
Одно недавнее исследование показало, что PNPLA3 функционирует как триацилглицеролгидролаза, специфичная для полиненасыщенных жирных кислот с очень длинной цепью, которая способствует переносу полиненасыщенных жирных кислот от триацилглицерина к фосфатидилхолину, и что вариант PNPLA3 C>G вызывает 80%-ное снижение активности PNPLA3 и снижение соотношения насыщенных и полиненасыщенных триацилглицеринов в печени [19].
Ранее сообщалось, что взаимодействие между генотипом PNPLA3 и ожирением влияет на стеатоз печени и повышает уровень АЛТ в сыворотке. В нашем исследовании связь с генотипом PNPLA3 и повышением уровня АЛТ в сыворотке крови не установлена.
Кроме отмеченных нами высокого ИМТ и высоких показателей глюкозы натощак у всех исследованных пациентов с сахарным диабетом 2-го типа, у носителей генотипа GG в подгруппе с СД2 без НАЖБП наблюдается увеличение уровня триглицеридов в крови. Однако в подгруппе с СД2 и НАЖБП увеличения уровня триглицеридов не наблюдается, что, возможно, связано с нарушением метаболизма триглицеридов в печени в результате замещения гепатоцитов на адипоциты у пациентов с НАЖБП.
Выводы. Проведенное исследование показало повышение триглицеридов в крови выше нормального уровня в группе носителей генотипа GG, больных СД2, без НАЖБП.
В выборке якутов, больных СД2, связь с генотипом полиморфизма rs738409 гена PNPLA3 не выявлена.
Полученные данные указывают на необходимость дальнейшего изучения влияния гена PNPLA3 на патогенез СД2 и НАЖБП у якутов с персонализированным подходом на более крупных выборках.
Библиографическая ссылка
Павлова Н.И., Бочуров А.А., Алексеев В.А., Крылов А.В., Сыдыкова Л.А. ПОЛИМОРФИЗМ ГЕНА АДИПОНУТРИНА И БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ КРОВИ У ЯКУТОВ СТРАДАЮЩИХ САХАРНЫМ ДИАБЕТОМ 2 ТИПА И НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНЬЮ ПЕЧЕНИ // Современные проблемы науки и образования. 2023. № 1. ;URL: https://science-education.ru/ru/article/view?id=32417 (дата обращения: 27.12.2025).
DOI: https://doi.org/10.17513/spno.32417



