Рост числа высокоэнергетических травм в гражданских условиях, а также в условиях боевых действий, ведет к росту числа случаев использования металлических имплантатов в ортопедо-травматологической практике [1]. Одним из наиболее опасных осложнений, связанных с хирургической установкой ортопедических устройств (устройства для фиксации переломов, протезы суставов), является остеомиелит, который вызывается инфекционными микроорганизмами и приводит к прогрессирующему разрушению и потере костной ткани [2]. Несмотря на совершенствование технологий лечения, количество таких осложнений продолжает неуклонно расти [3; 4], что требует дальнейшей разработки эффективных способов профилактики и ликвидации остеомиелитического процесса. В настоящее время среди разрабатываемых методов перспективным является применение постоянного электрического тока. В клинической практике его использование обусловлено положительным остеогенным эффектом при сращении переломов и лечении ортопедической патологии [5]. Кроме того, в экспериментальных исследованиях in vitro определены параметры тока, позволяющие получить антимикробный эффект по отношению к некоторым патогенным микроорганизмам [6], а in vivo установлено, что локальное воздействие электрического тока без сопутствующей антимикробной терапии является эффективным методом лечения остеомиелита [7]. Однако показания к применению данной методики в клинической медицине отсутствуют, так как не существует четких рекомендаций относительно времени начала воздействия, параметров тока, длительности и периодичности проведения процедур.
Цель исследования ‑ изучить особенности течения остеомиелита у крыс в условиях местного воздействия постоянным электрическим током.
Материал и методы исследования. Исследование проведено на 18 крысах (Wistar) обоего пола в возрасте 11-12 месяцев, средней массой 396±17,6 г. Все исследования были выполнены в соответствии с требованиями «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1986) и Директивы 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, а также были одобрены Комитетом по этике ФГБУ «НМИЦ ТО им. академика Г.А. Илизарова».
Животные случайным образом были разделены на 3 группы – 2 опытные и контрольную. Всем крысам в условиях операционной выполняли моделирование остеомиелита бедренной кости путем введения в костномозговой канал 50 мкл бактериальной суспензии (1×108 КОЕ Staphylococcus aureus; MSSA, музейный штамм) с последующей установкой стабильно фиксированного интрамедуллярного металлического имплантата из нержавеющей стали [8; 9]. На протяжении всего эксперимента крыс содержали в индивидуальных клетках, доступ к пище и воде не ограничивали; обработку операционной раны не проводили, антимикробные средства не применяли. Содержание и уход за животными осуществляли в соответствии с ГОСТ 33216-2014, ГОСТ 33215-2014, СанПиН 3.3686-21.
В послеоперационном периоде крысам опытных групп 1 и 2 проводили сеансы электровоздействия на внутрикостный канал бедренной кости, используя прибор «Биопотенциометр БМП-2». Катод (+) присоединяли к спице, введенной на уровне нижней трети бедренной кости, анод (-) - к спице, введенной в интрамедуллярный канал. Процедуру осуществляли постоянным электрическим током силой 150 мАм в течение 1 минуты. Животным опытной группы 1 электровоздействие выполняли на 0, 2, 4 и 6 сутки после операции; животным опытной группы 2 - на 7, 9, 11 и 13 сутки. Крысам контрольной группы сеансы электровоздействия не проводили.
Оценка состояния животных проводилась ежедневно на протяжении всего эксперимента и включала клинические наблюдения, определение массы тела, измерение общей температуры тела (электронный термометр DT-622 с гибким нетравмирующим наконечником, 1 минута) и местной температуры обеих тазовых конечностей в области середины бедра (инфракрасный медицинский электронный термометр WF-5000, B.Well). Анализ изменения массы тела проводили по контрольным точкам: день до операции, 7, 14 и 21 сутки после операции. Общую температуру тела и местную температуру тканей в области оперированного и контрлатерального сегментов анализировали в аналогичные сроки.
Рентгенографическое исследование области бедра (плоскопанельный детектор для ветеринарии CANON CXDI-401C COMPACT (Япония); рентгеновская трубка TOSHIBA (Rotanode) Model E7239. N: 10G749 (Япония); 2,5-3,2 mA, 43-44 kV, фокусное расстояние 90 см, выдержка автоматическая) в прямой и боковой проекциях выполняли в день операции, а также через 21 сутки наблюдения.
Наркотизированных животных подвергали эвтаназии на 21 сутки после операции.
Все количественные данные были описаны как среднее (М) ± стандартное отклонение (SD). Статистический анализ проводили с использованием программы AtteStat 13.1 (Россия). Достоверность различий полученных значений определяли критерием Вилкоксона. Значение p <0,05 считалось статистически значимым.
Результаты исследования и их обсуждение
Клиническая картина остеомиелита зависит от анатомической локализации патологического процесса, временного интервала между микробной инокуляцией и проявлением инфекции, а также от вида микроорганизма [10]. В проведенном исследовании интрамедуллярное введение культуры S. aureus не повлияло на общую выживаемость животных.
У всех животных контрольной группы (n=8) был выявлен отек мягких тканей в области оперированного сегмента. У 62,5% крыс отек отмечали только в раннем послеоперационном периоде (1-5 сутки), у 25% крыс регистрировали непродолжительные рецидивирующие отеки в разные сроки наблюдения, у 12,5% крыс отек сохранялся на протяжении всего эксперимента. У 100% крыс контрольной группы с 8 по 21 сутки наблюдали выделение гнойного или гнойно-геморрагического экссудата из спицевых каналов. Также у 50% крыс было выявлено нарушение функции коленного сустава оперированной конечности. Кроме того, отмечали единичные случаи образования непродолжительного отека в области тазобедренного сустава, атрофии четырехглавой мышцы бедра и образование абсцесса на медиальной поверхности бедра. Металлоконструкция, фиксирующая интрамедуллярный металлический имплантат, оставалась стабильной на протяжении всего эксперимента у 25% крыс; у 50% животных нестабильность фиксации определяли к 13-16 дню наблюдения; у 25% крыс стабильность конструкции была нарушена вследствие механического воздействия на 5 сутки после операции.
В опытной группе 1 (n=6) отек мягких тканей в области оперативного вмешательства отмечали только в раннем послеоперационном периоде у 83,3% животных. Истечение гнойного экссудата из спицевых каналов наблюдали у 100% животных преимущественно с 8 суток, однако оно было либо непродолжительным, либо носило эпизодический характер. Нарушения функций суставов оперированной конечности не выявлено ни у одной крысы. Нестабильность металлоконструкции выявлена у 66,7% крыс на 7-16 сутки эксперимента.
В опытной группе 2 (n=6) у 33,3% крыс на 8-13 сутки после операции выявлена нестабильность металлоконструкции и произведен ее демонтаж, вследствие чего сеансы воздействия электрическим током были проведены частично. Указанные животные были исключены из экспериментального исследования. У крыс, получивших полный курс электровоздействия и учтенных в результатах, отек мягких тканей в области операционной раны отмечали с 1 по 7 сутки. У 50% животных с 6 суток после операции и до окончания эксперимента происходило скудное выделение густого гнойного экссудата из спицевых каналов. У 25% крыс появление гнойного отделяемого отмечено в более поздние сроки (с 15 суток), еще у 25% выделения экссудата зарегистрировано не было. У 25% крыс наблюдали резкое ограничение функции коленного сустава, у 75% крыс опытной группы 2 суставы оперированной конечности не имели патологии.
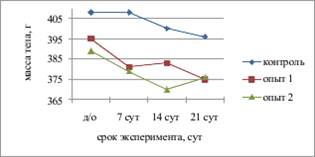
Наиболее часто используемыми индикаторами воспаления, применяющимися при проведении экспериментальных исследований, являются такие физиологические параметры, как масса тела и температура [11]. В послеоперационном периоде у животных всех групп наблюдалось изменение массы тела (рис. 1а). На момент завершения эксперимента в контрольной группе значительное уменьшение веса относительно исходных значений отмечено у 62,5% крыс, в опытных группах 1 и 2 ‑ у 100%. Максимальная потеря массы составила в контрольной группе 7,7%, в опытных группах 1 и 2 ‑ по 6%, в среднем ‑ 2,8%, 5,1% и 3,3% соответственно. Однако у всех животных опытной группы 2 после 14 суток эксперимента наблюдалась тенденция к увеличению массы тела, в отличие от контрольной и опытной группы 1, в которых вес стабильно снижался на протяжении всего периода исследования.
|
|
|
|
а |
б |
|
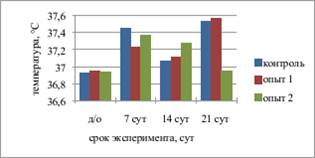
Рис. 1. Динамика массы и общей температуры тела экспериментальных животных |
|
При анализе изменений общей температуры тела выявлено, что она была достоверно выше дооперационных значений в контрольной группе на 7 (р=0,018) и 21 (р=0,04) сутки наблюдения, в опытной группе 2 - на 14 сутки (р=0,037). В опытной группе 1 на 21 сутки также отмечено значительное повышение общей температуры, однако ее значения достоверно не отличались от дооперационных значений (р=0,05) (рис. 1б).
Анализ показателей, характеризующих местную температуру тканей тазовых конечностей у крыс контрольной группы, не выявил достоверных отличий между симметричными участками оперированной и контрлатеральной конечностей (таблица). В опытной группе 1 на 21 сутки после бактериальной инокуляции температура оперированной конечности была достоверно выше (р=0,043), чем на симметричном участке интактной конечности. В опытной группе 2 достоверно более высокие значения температуры инфицированной конечности (относительно аналогичного участка второй конечности) отмечены на 14 сутки наблюдения (р=0,031), однако к 21 суткам произошло существенное ее снижение и статистически значимой разницы между местной температурой конечностей на данном сроке установлено не было.
Локальная температура симметричных участков тазовых конечностей, °C
|
Группа / срок эксперимента |
Местная температура оперированного сегмента |
Местная температура контрлатерального сегмента |
Достоверность различий между сегментами |
|
|
контрольная группа |
д/о** |
37,12±0,34 |
37,18±0,39 |
р=0,91 |
|
7 сут. |
36,27±0,19 |
36,82±0,34 |
р=0,2 |
|
|
14 сут. |
36,53±0,16 |
36,65±0,2 |
р=0,63 |
|
|
21 сут. |
36,96±0,21 |
36,98±0,22 |
р=0,97 |
|
|
опытная группа 1 |
д/о** |
36,97±0,39 |
37±0,44 |
р=0,98 |
|
7 сут. |
37,1±0,18 |
36,73±0,18 |
р=0,19 |
|
|
14 сут. |
37,2±0,05 |
36,92±0,13 |
р=0,09 |
|
|
21 сут. |
37,02±0,13 |
36,6±0,12 |
р=0,043* |
|
|
опытная группа 2 |
д/о** |
37,42±0,21 |
37,5±0,29 |
р=0,97 |
|
7 сут. |
37,03±0,32 |
36,75±0,22 |
р=0,51 |
|
|
14 сут. |
37,28±0,14 |
36,78±0,09 |
р=0,031* |
|
|
21 сут. |
36,38±0,06 |
36,6±0,18 |
р=0,3 |
|
* - p<0,05, ** - до операции.
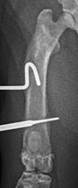
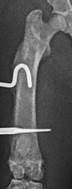
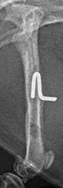
Рентгенография является одним из наиболее доступных визуализирующих методов исследования, необходимых для изучения остеомиелита [12]. На рентгенограммах, полученных через 21 сутки после индукции остеомиелита, оценивали диафизарно-периостальную реакцию, симптомы костной деструкции и изменение мягких тканей в области оперированного сегмента (рис. 2).
У 50% крыс контрольной и опытной группы 1, а также у 33,3% крыс опытной группы 2 на рентгенограммах в боковой проекции отмечали участки истончения корковой пластинки в средней части диафиза. У 100% животных опытных групп 1 и 2 вокруг интермедуллярного участка проксимальной спицы определялась зона просветления, свидетельствующая о лизисе костной ткани. В контрольной группе зона просветления отмечалась только в области контакта проксимальной спицы и корковой пластинки.
Рентгенологические признаки резорбции костной ткани вокруг дистальной спицы в контрольной группе отмечали в 83,3% случаев, в опытных группах 1 и 2 - в 100%. При этом в опытной группе 1 на 83,3% рентгенограмм зоны резорбции были окружены участками склероза костной ткани, а в опытной группе 2 в 33,3% случаев края кости в зоне резорбции были плотные и имели четкий контур.
|
к |
к |
1 |
1 |
2 |
2 |
|
|
|
|
|
|
|
|
а |
б |
в |
г |
д |
е |
|
Рис. 2. Рентгенограммы области бедра крысы в прямой (а, б, в, д) и боковой (г, е) проекциях на 21 сутки эксперимента: а, б – контрольная группа, в, г – опытная группа 1, г, д – опытная группа 2 |
|||||
У 33,3% крыс контрольной группы и у 100% крыс опытной группы 1 на снимках определялись периостальные наслоения средней рентгенологической плотности. В контрольной группе они располагались на краниальной и латеральной поверхностях кости и по толщине были меньше или равны толщине корковой пластинки. В опытной группе 1 отмечены их циркулярное расположение в средней трети диафиза и толщина, равная или превышающая толщину корковой пластинки. В опытной группе 2 периостальные наслоения, выявленные у 50% животных, имели низкую рентгенологическую плотность, располагались в основном на латеральной поверхности диафиза и по толщине были равны толщине корковой пластинки.
Наличие рыхлых эндостальных теней разной степени выраженности, распространяющихся по всей длине диафиза, в контрольной и опытной группе 1 отмечали в 100% случаев, в опытной группе 2 - в 33,3%.
На рентгенограммах животных контрольной и опытной группы 1 в проекции костномозгового канала отмечали округлые единичные зоны просветления (полости) небольшого размера. В опытной группе 2 аналогичных очаговых изменений выявлено не было. Также у 100% животных всех групп мягкие ткани в зоне инфицирования имели равномерную рентгенологическую плотность без признаков уплотнений или образования полостей.
Таким образом, в проведенном исследовании наиболее ярко выраженные клинические признаки воспалительного процесса [10] отмечены в контрольной группе. В опытной группе 1 признаки воспалительной реакции носили менее выраженный характер, но со временем имели тенденцию к усугублению. В опытной группе 2 также были выявлены признаки воспаления, но к окончанию периода наблюдения их проявление уменьшалось.
Рентгенологическая картина, характерная для воспалительного процесса кости [13], была обнаружена во всех группах животных. Однако изменения, отмеченные в опытной группе 2, свидетельствовали о более пассивном течении инфекции, что привело к большей сохранности костной ткани бедренной кости к концу наблюдений.
Заключение. Локальное воздействие на кость постоянного электрического тока на модели остеомиелита у крыс в разные сроки после микробной инокуляции показало минимальный терапевтический эффект между исследуемыми группами. В проведенном исследовании размер выборки был относительно небольшим, а срок наблюдения за животными - недостаточным для оценки развития, прогрессирования или затухания костной инфекции. Результаты эксперимента указывают на необходимость дальнейшего изучения влияния данного метода на инфекционный процесс, протекающий в костной ткани, с учетом полученных сведений.
Библиографическая ссылка
Кубрак Н.В., Дюрягина О.В., Овчинников Е.Н. ПРИМЕНЕНИЕ ПОСТОЯННОГО ЭЛЕКТРИЧЕСКОГО ТОКА В МОДЕЛИ ОСТЕОМИЕЛИТА У КРЫС // Современные проблемы науки и образования. 2023. № 1. ;URL: https://science-education.ru/ru/article/view?id=32390 (дата обращения: 08.01.2026).
DOI: https://doi.org/10.17513/spno.32390