Во всем мире рак шейки матки (РШМ) входит в число четырех онкологических заболеваний, наиболее распространенных у женщин [1]. Ежегодно выявляют порядка 500 000 новых случаев РШМ и регистрируют более 260 000 смертей от него, что превышает показатели любой другой гинекологической патологии [2, 3].
В стандарты лечения ранних стадий РШМ входят радикальная гистерэктомия или только лучевая терапия (ЛТ), а местнораспространенные формы рака лечат только ЛТ [4]. Уничтожение раковых клеток достигается путем облучения высокой дозой энергии в диапазоне 40–85 Гр [5]. По рекомендациям FIGO (International Federation of Gynecology and Obstetrics) пациенткам с РШМ IB1, IB2 и IIA1 (опухоль размером <4 см) при невозможности проведения хирургического этапа лечения по соматическим показаниям или желанию пациентки рекомендовано проводить самостоятельную химиолучевую терапию (ХЛТ) [6].
По оценкам некоторых авторов [7], 60% больных РШМ получают ЛТ в качестве стандартного лечения, однако около 50% из них приобретают резистентность к ней, и это является основным фактором, способствующим неэффективности лечения и рецидивам. Данные ряда исследований показывают, что несколько микроРНК тесно коррелируют с радиорезистентностью при РШМ. Так, исследование Zhang et al. (2013) показало, что 14 микроРНК (miR-1246, -1290, -137, -150, -3138, -3663-3p, -371-5p, -3926, -4271, -4327, -572, -584, -630, -765) были гиперэкспрессированы и 6 микроРНК (miR-BHRF1-1, -1271, -15b, -19b-1, -378, -95) были гипоэкспрессированы в клеточных линиях радиорезистентного рака шейки матки [8]. Авторы идентифицировали сигнатуру экспрессии микроРНК (miR-630, 1246, 1290, 3138), которая связана с повышенной радиорезистентностью при РШМ [9].
Соответственно, полный клинический ответ от проведения ЛТ опухолей шейки матки, как и при ряде других нозологий, достигается только у определенной доли больных, что в большей степени связано с развитием радиорезистентности у опухолевых клеток [10, 11]. К 2022 г. целым рядом исследователей был сформирован значительный список маркеров для предсказания ответа на ЛТ, но ни один из них пока не вошел в отечественную и мировую клиническую практику [7]. Поэтому целью исследования стал поиск генетических маркеров для малоинвазивного выявления чувствительности РШМ к ЛТ.
Материалы и методы исследования
Исследование было проведено на выборке из 200 больных РШМ (IB1, IB2, IIA1, опухоль <4 см) и 30 доноров без онкопатологии. Средний возраст пациенток составлял 59,1±7,6 года. Дистанционная ЛТ (ДЛТ) выполнялась на линейном ускорителе Varian TrueBeam в режиме VMAT или IMRT (РОД 2 Гр до СОД 50 Гр). На фоне дистанционной лучевой терапии проводилось еженедельное введение цисплатина в РД 40 мг/м2 от 4 до 6 введений. После этого пациентки получали курс внутриполостной брахитерапии до СОД 35–40 Гр по изоэффекту (EQD2).
Анализ базы данных TCGA (The Cancer Genome Atlas) стал первым этапом работы. Данные из Genomic Data Commons Data Portal (https://portal.gdc.cancer.gov/) получали с помощью языка R v.4.0.0 в оболочке Rstudio, используя пакет TCGABiolinks. Алгоритм GISTIC был применен для формирования списка генов на основании выявления областей генома, размер которых значительно изменялся в ряде образцов опухолей шейки матки [12]. Список генов включал 34 локуса (ERBB2, BIRC2, TRPC6, YAP1, MIR-569, LRRC31, SPRED3, MIR-4456, CYP-1A, -A2, CYP11A1, MIR-4786, TIGD1, GPX4, ST14, LINC00167, LINC00558, LINC00400, FOXO1, ENOX1, EPSTI1, NEK5, KCTD4, SERP2, MIR-621, PTEN, SOD2, MIR-3939, ATM, CASP-1, -4, -5, CHEK1 и H2AFX).
На следующем этапе исследования для высококачественной дифференцировки опухолевых и нормальных клеток из срезов тканей шейки матки, заключенных в FFPE (Formalin-fixed paraffin-embedded)-блоки, 200 пациенток использовали лазерную микродиссекцию с бесконтактным захватом (Palm MicroBeam, Carl Zeiss, Германия) [13]. Из извлеченных таким способом клеток методом фенол-хлороформной экстракции было выделено 400 образцов ДНК, которую использовали в ПЦР в режиме реального времени (Real-Time qPCR) для определения уровня относительной копийности генов. Для осуществления этого метода были сконструированы последовательности 37 пар синтетических олигонуклеотидов (праймеров), включая пары для референсных локусов (ACTB, B2M, GAPDH). Количественная ПЦР в режиме реального времени с интеркалирующим красителем EvaGreen®Dye (Biotium, США) проводилась на термоциклере Bio-Rad CFX96. Каждый образец ДНК амплифицировали в 3 повторах.
Относительную копийность генетического локуса (CNVR) вычисляли по формуле e-ΔCt, где e – эффективность реакции амплификации, определяемая по формуле: 10-1/Z, где Z – коэффициент из уравнения Ct = Z•logP0 + b. Конечный результат представляли в виде кратности изменений (fold change, FC) копийности генов в опухолевых образцах по отношению к нормальным: FC=CNVR(оп)/CNVR(н) = e-ΔCt(оп)/e-ΔCt(н) [14].
Статистический анализ данных выполняли в Statistica 11.0 (StatSoft, США), биоинформационный анализ – в Rstudio (v4.0.1). Непараметрический U-критерий Манна–Уитни с поправкой Бонферрони (множественное сравнение) использовали для оценки различий значений. Функциональный анализ показателей копийности генов осуществляли с помощью FMD (Functional module detection)-алгоритма [15].
Результаты исследования и их обсуждение
Результаты анализа копийности генов с помощью алгоритма GISTIC2. Вариабельность числа копий генов (CNV, copy number variation) представляет собой особый вид полиморфизмов, изменяющий количество определенного гена в геноме и, следовательно, косвенно влияющий на уровень матричной или некодирующей РНК [16].
К 2022 г. накоплены внушительные объемы данных о CNV в клетках опухолей, в том числе опухолей шейки матки. Для формирования списка потенциальных генетических маркеров в целях определения чувствительности этих опухолей к радиотерапии были использованы данные из проекта The Cancer Genome Atlas (TCGA), извлеченные с портала Genomic Data Commons. Алгоритм GISTIC позволил определить области генома с аномальным изменением размера для образцов опухолей.
В этом анализе было использовано 295 образцов опухолей и было обнаружено изменение копийности 4350 генетических локусов. Данные гены были распределены по функциональным модулям с использованием алгоритма FMD (рис. 1). Была проведена фильтрация сигнальных путей для генов, снизивших копийность, и выбраны только те локусы и регулируемые ими сигнальные каскады, которые могут быть ассоциированы с устойчивостью к лучевой терапии: регуляция продукции интерлейкинов, клеточного ответа на облучение, клеточного ответа на стимулы внешней среды, регуляция убиквитинирования белка, активация иммунного ответа, апоптотическая фрагментация ДНК, регуляция активности фосфатидилинозитол-3-киназы, репарация межнитевых поперечных связей ДНК. Аналогичная фильтрация была выполнена для генов с повышенной копийностью относительно нормальной ткани. Были идентифицированы следующие сигнальные пути: регуляция распространения клеток, зависящего от адгезии к субстрату, клеточное деление, реорганизация внеклеточного матрикса, регуляция организации хромосом, регуляция митотического деления, водный гомеостаз многоклеточных организмов, регуляция уровня гормонов, передача сигналов регуляции контрольных точек клеточного цикла, реакция на ионизирующее излучение.
Рис. 1. Распределение снизивших (слева) и увеличивших (справа) копийность генов по функциональным модулям с использованием алгоритма FMD
Таким образом, из 4350 генов были выбраны 34 локуса, с наибольшей вероятностью связанных с радиорезистентностью: H2AFX, ERBB2, CHEK1, BIRC2, TRPC6, YAP1,LRRC31, SPRED3, MIR-569, MIR-4456, MIR-4786, MIR-621, MIR-3939, CYP-1A, CYP-A2, CYP11A1, TIGD1, GPX4, ST14, LINC00167, LINC00558, LINC00400, FOXO1, ENOX1, EPSTI1, NEK5, KCTD4, SERP2, PTEN, SOD2, ATM, CASP-1, CASP-4 и CASP-5.
Анализ копийности генов в клетках шейки матки. Анализ эффективности радиотерапии позволил разделить 200 пациенток на 2 группы – чувствительных к ЛТ (n=114, 1-я группа) и резистентных (n=86, 2-я группа). Выявленный на этапе биоинформационного анализа паттерн из 34 генов был валидирован методом ПЦР на ДНК из опухолевых и нормальных клеток тканей шейки матки. У пациенток группы 1 обнаружено статистически значимое (р<0,05) уменьшение копийности генов H2AFX, ATM, CHEK1, LINC00400 в 2,0, 2,5, в 1,7 и 4,5 раза и увеличение копийности генов CASP-1, -4, -5, CYP1-A1, -A2 и GPX4 в 1,8, 2,5, 2,0, 2,7, 2,1 и 2,6 раза соответственно в опухолевых клетках относительно этих показателей в нормальных клетках (рис. 2). У пациенток группы 2 обнаружены статистически значимое (р<0,05) уменьшение копийности генов CASP4, CASP5, CYP1A1, YAP1 в 3,3, 1,7, 1,4 и 2,0 раза и увеличение копийности H2AFX, CHEK1, ERBB2 и BIRC2 в 3,5, 3,2, 2,8 и 3,4 раза соответственно в опухолевых клетках относительно CNV в нормальных клетках шейки матки (риc. 2).
CNV генов H2AFX, CHEK1, ERBB2, LINC00400, CASP-4, -5 и CYP1A1 различалась статистически значимо (р<0,005) в опухолевых клетках между двумя группами пациенток. Так, CNV гена H2AFX в 7,0 раз была выше в опухолевых клетках радиорезистентных пациенток, гена CHEK1 – в 5,3 раза выше, гена ERBB2 – в 2,3 раза выше, LINC00400 – в 6,8 раза выше, а CASP-4 – в 8,3 раза ниже, CASP-5 – в 3,3 раза выше и CYP1A1 – в 3,9 раза ниже, чем в опухолевых клетках в группе пациенток, чувствительных к ЛТ (рис. 2).
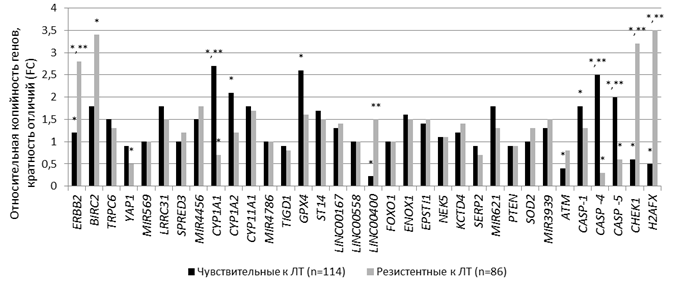
Рис. 2. Копийность генов в опухолевых клетках шейки матки относительно нормальных клеток.
* – статистически значимые отличия от нормальных клеток; ** – статистически значимые отличия между копийностью генов в опухолевых клетках пациенток, резистентных и чувствительных к ЛТ
Анализ копийности генов во внДНК плазмы крови. Создание современных высокоэффективных молекулярных малоинвазивных методов диагностики невозможно без поиска маркеров во внеклеточной ДНК (внДНК) плазмы крови. Этот аспект касается и маркеров чувствительности РШМ к ЛТ.
В крови источником внДНК может быть ядерная и митохондриальная ДНК соматических и опухолевых клеток [17]. При этом сама внДНК долго сохраняет стабильность во внеклеточных средах организма человека, в том числе и в плазме крови [18]. Показатель копийности генетических локусов H2AFX, CHEK1, LINC00400, CASP-1, -4, -5, CYP1-A1, -A2, GPX4, YAP1, ERBB2 и BIRC2 был проанализирован во внДНК плазмы крови пациенток, чувствительных и резистентных к ЛТ.
В 1-й группе больных выявлены значимое снижение (р<0,05) числа копий генов H2AFX, CHEK1, LINC00400 в 1,7, 2,5 и 2,5 раза, а также значимое увеличение (р<0,05) числа копий генов CASP-4/ -5, CYP1-A1/ -A2 и GPX4 – в 2,8, 3,0, 2,3, 2,2 и 2,0 раза соответственно. Во 2-й группе больных обнаружены значимое снижение (р<0,05) числа копий генов CASP-4/ -5, CYP1-A1, YAP1 – в 2,0, 2,0, 3,3 и 2,0 раза соответственно – и увеличение (р<0,05) числа копий генов H2AFX, CHEK1, ERBB2 и BIRC2 – в 3,8, 3,6, 2,2 и 3,0 раза соответственно – относительно этих показателей у здоровых доноров. CNV генов H2AFX, CHEK1, ERBB2, BIRC2, LINC00400, CASP-4/-5 и CYP1-A1 статистически значимо (р<0,005) отличалась во внДНК 1-й и 2-й групп больных РШМ: у пациенток, резистентных к ЛТ, число копий H2AFX в 6,3 раза больше, CHEK1 – в 9,0 раз больше, ERBB2 – в 1,8 раза больше, BIRC2 – в 2,1 раза больше, LINC00400 – в 3,8 раза больше, CASP-4/-5 и CYP1-A1 была в 5,6, 6,0 и 7,7 раза меньше, чем у пациенток, чувствительных к ЛТ (рис. 3).
Возможным следствием, основанным на изменении копийности этих генов, может быть аномальное функционирование системы репарации ДНК. Из данных литературы хорошо известно, что ионизирующее облучение при действии на живые клетки приводит к индукции двуцепочечных разрывов ДНК. В ответ на это в клетке запускается цепь событий, направленных на удаление этих повреждений. А для этого хроматин должен находиться в неконденсированном состоянии [19]. В поддержании его деконденсированной формы задействован гистоновый ген H2AFX (H2AX, H2A histone family member X). Продукт этого гена в ответ на облучение фосфорилируется и переходит в форму γH2AX, поддерживая хроматин неконденсированным. Это позволяет репарационным комплексам присоединиться к ДНК [20]. Повреждение ДНК приводит также к активации CHEK1 и, соответственно, инициации контрольных точек клеточного цикла [21]. CHEK1 необходим для выживания клеток и благодаря высоким уровням экспрессии в опухолях может индуцировать пролиферацию опухолевых клеток. Опухолевые клетки с повышенным уровнем CHEK1 приобретают преимущества в плане выживания благодаря способности переносить более высокий уровень повреждения ДНК. Следовательно, CHEK1 может способствовать резистентности к ЛТ и химиотерапии [22].
Сигнальные пути, регулирующие апоптоз, также вовлечены в формирование чувствительности к ЛТ. Так, белок, кодируемый геном BIRC2(cIAP1), ингибирует апоптоз путем связывания с факторами TRAF1 и TRAF2, а также путем вмешательства в активацию ICE-подобных протеаз. Этот многофункциональный белок не только регулирует каспазы, но и модулирует воспалительные сигнальные пути и иммунитет, клеточную пролиферацию, клеточную инвазию и метастазирование. Он действует как убиквитин-протеинлигаза Е3, регулирующая передачу сигналов NF-каппа-В, и регулирует как каноническую, так и неканоническую передачу сигналов NF-каппа-В [23].
Каспазы 4 и 5, кодируемые генами CASP-4/-5 соответственно, представляют собой ферменты, которые протеолитически расщепляют другие белки по остатку аспарагиновой кислоты, и принадлежит к семейству цистеиновых протеаз. Функции каспазы 4 и 5 до конца не известны, но считается, что они являются воспалительными каспазами [24].
LINC00400 (Long Intergenic Non-Protein Coding RNA 400) представляет собой ген длинной не кодирующей белок РНК (lncRNA). Публикации, описывающие функции этой РНК, немногочисленны [11, 25]. В работе W. Yuan и соавторов было показано, что LINC00400 играет важную роль в развитии и прогрессировании рака. Возможно, lncRNA регулируют посттранскрипционную активность генов путем сети ceRNA (конкурентно взаимодействующих РНК): lncRNA, вероятно, действует как молекулярная «губка» для микроРНК, конкурентно связывая их и влияя на их гены-мишени [11]. Потенциальной ceRNA-мишенью для LINC00400 являются микро-РНК, взаимодействующие с генами сигнального пути p53 и регулирующие апоптоз [25].
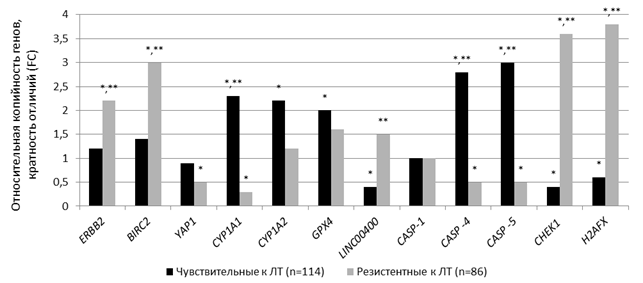
Рис. 3. Число копий генов во внДНК плазмы крови у больных с разной чувствительностью к радиотерапии.
* – статистически значимые отличия от числа копий генов во внДНК здоровых доноров; ** – статистически значимые отличия между числом копий генов во внДНК пациенток, резистентных к ЛТ, и этим показателем во внДНК пациенток, чувствительных к ЛТ
В регуляции деления клеток также задействован ген ERBB2 (HER2), который кодирует her2 (erbB-2) – мембранный белок из семейства рецепторов эпидермального фактора роста. В нормальной клетке есть 2 копии этого гена, в опухолевой – намного больше. Поэтому на поверхности опухолевых клеток находится множество белков her2, что вызывает дисрегуляцию их нормального роста. Опухолевые клетки с большим количеством белков her2 быстрее растут, более агрессивны и почти не подвержены воздействию лучевой терапии [26]. Увеличение числа копий или повышение экспрессии этого гена играют важную роль в патогенезе и прогрессировании различных агрессивных типов рака, а также могут служить молекулярным маркером и мишенью для таргетной терапии [27]. Амплификация her2 связана с устойчивостью к противораковому препарату цетуксимаб [28].
В патогенезе некоторых гинекологических злокачественных новообразований важную роль играет гиперэстрогения [29]. По данным, представленным в исследовательских работах О.И. Кита и соавторов [29, 30], метаболическая активация эстрадиола является ключевым фактором в развитии и прогрессировании опухолей шейки матки. Из данных отечественных и зарубежных исследователей известно, что ряд гинекологических опухолей характеризуется высокой экспрессией генов регуляторов гидроксилирования эстрадиола. Так, например, ген CYP1A1, кодирующий фермент из семейства цитохромов Р450, регулирует гидроксилирование 17-β-эстрадиола в положении С-2 [31].
Таким образом, проведенный анализ позволил установить, что у больных РШМ чувствительность к ЛТ ассоциирована с особенностями копийности генетических локусов, регулирующих сигнальные пути репарации ДНК, апоптоза, пролиферации клеток и метаболизма эстрадиола.
Заключение
Комбинация математических и молекулярных подходов позволила выявить маркеры – показатели копийности: H2AFX, CHEK1, ERBB2, BIRC2, LINC00400, CASP4, CASP5 и CYP1A1 – в тканях и во внДНК, которые могут стать основой для способов (в том числе малоинвазивных) определения чувствительности РШМ к ЛТ.
Библиографическая ссылка
Цаплина Н.Н., Фатькина Н.Б., Гусарева М.А., Васильева Е.О., Солнцева А.А., Зинькович М.С., Толмачева Е.А., Кошелева Н.Г., Павлятенко И.В., Порханова Н.В. ПОКАЗАТЕЛЬ КОПИЙНОСТИ ГЕНОВ КАК МАЛОИНВАЗИВНЫЙ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ МАРКЕР ЧУВСТВИТЕЛЬНОСТИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ШЕЙКИ МАТКИ К ЛУЧЕВОЙ ТЕРАПИИ // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32369 (дата обращения: 15.02.2026).
DOI: https://doi.org/10.17513/spno.32369



