Рак толстой кишки (РТК) входит в пятерку самых распространенных и наиболее часто приводящих к смерти злокачественных опухолей в мире [1]. В последние годы отмечается неуклонный рост уровня РТК вследствие увеличения продолжительности жизни населения развитых стран, большего влияния факторов риска и улучшения выявляемости опухолей за счет внедрения программ скрининга [2]. В общей структуре онкологической заболеваемости Российской Федерации РТК стоит на третьем месте, с ежегодной диагностикой около 18 тыс. новых случаев [3]. В структуре смертности населения России от злокачественных опухолей РТК занимает третье место, ежегодно становясь причиной смерти более 23 тыс. человек [3]. Основным фактором, ограничивающим продолжительность жизни пациентов с РТК, является метастазирование. По данным ряда публикаций, до трети пациентов имеют рецидив заболевания в виде отдаленного метастазирования [4, 5]. Метастазы чаще всего обнаруживаются в течение 3 лет после радикального лечения. При этом наиболее частыми локализациями метастазов РТК являются легкие и печень [5, 6].
Современные исследования фундаментальной онкологии связывают метастазирование РТК с эпителиально-мезенхимальным переходом (ЭМП), в силу которого клетки карцином приобретают свойства и признаки мезенхимальных клеток. ЭМП наделяет клетки РТК большей подвижностью и меньшей сопряженностью с базальной мембраной, что, в свою очередь, способствует инвазии клеток в сосуды и диссеминации. Кроме этого, опухолевые клетки становятся устойчивыми к апоптозу и лекарственной терапии. Таким образом, эпителиально-мезенхимальный переход играет ключевую роль в повышении риска отдаленных метастазов и снижении выживаемости пациентов с РТК [7].
Обнаружение в карциноме качеств, характерных для мезенхимальной транзиции, позволяет соотнести опухоль к самому неблагоприятному из подтипов колоректального рака – CMS4 (в соответствии с Международным консорциумом от 2015 г.). Кроме того, принятый консенсус молекулярных подтипов колоректального рака (англ. consensus molecular subtypes, CMS) выделяет еще 3 подтипа: гипериммунный (CMS1), характеризуется благоприятным прогнозом на ранней стадии, при этом CMS1 не отвечают на стандартную химиотерапию [8]; канонический (CMS2) и метаболический (CMS3) подтипы демонстрируют схожие эпителиальные особенности, имеют лучший ответ на химиотерапию и благоприятный прогноз выживаемости [9]. Типирование CMS демонстрирует прогностическую и предиктивную значимость [10], однако из-за недоступности методики существуют сложности для использования CMS в рутинной практике. Данные обстоятельства делают актуальным поиск доступных маркеров для разделения опухолей на молекулярные подтипы.
Связь иммуногистохимических маркеров ЭМП с клинико-морфологическими характеристиками РТК нами была исследована ранее [11]. Однако вопрос изучения безметастатической выживаемости больных РТК в зависимости от иммуногистохимической экспрессии комплекса маркеров суррогатных подтипов в первичной опухоли, по-видимому, до конца не изучен и нуждается в более детальном обсуждении.
Цель исследования: изучить безметастатическую выживаемость больных раком толстой кишки в зависимости от иммуногистохимической экспрессии комплекса маркеров суррогатных подтипов в первичной опухоли.
Материал и методы исследования
Проведено ретроспективное нерандомизированное исследование, в котором проанализированы результаты лечения 100 пациентов с РТК, проходивших лечение в НИИ онкологии Томского НИМЦ. Критериями включения в исследование явились морфологически верифицированный рак толстой кишки IIА – IIIС стадии, информированное согласие пациента на участие в исследовании, радикально выполненное оперативное вмешательство, стандартная адъювантная химиотерапия. Критерии исключения из исследования: первично-множественные злокачественные образования; наличие отдаленных метастазов на момент постановки диагноза.
Стадию заболевания устанавливали в соответствии с Международной классификацией злокачественных опухолей по системе TNM (AJCC/UICC 8th ed., 2017) [12]. Распределение больных по полу, степени гистологической злокачественности, гистологическому типу опухоли относительно стадий заболевания было сопоставимым. Диагноз новообразования устанавливался согласно «Гистологической классификации опухолей желудочно-кишечного тракта» (ВОЗ, 2020) [13].
Пациенты не получали предоперационного лечения. Хирургическое лечение было выполнено всем пациентам в объеме гемиколонэктомии или резекции кишки. Адъювантная химиотерапия назначалась пациентам при выявлении поражения регионарных лимфатических узлов (N+), при прорастании опухолью серозной оболочки кишки (T4), а также при наличии факторов риска (низкая степень дифференцировки, наличие лимфоваскулярной/периневральной инвазии, положительный край резекции) [13]. Химиотерапия включала 5-фторурацил и оксалиплатин (схема FOLFOX) [13]. Динамическое наблюдение пациентов составило 3 года и включало комплексное лабораторно-инструментальное обследование [13]. Безметастатической выживаемостью считали период от даты окончания лечения РТК до регистрации метастатического распространения (рис. 1).
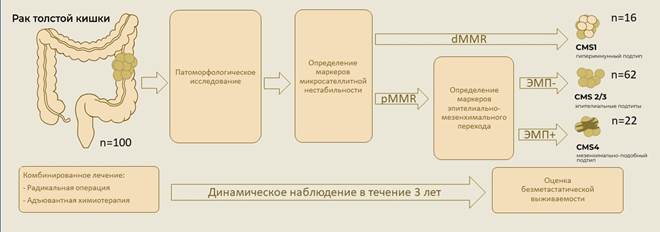
Рис. 1. Дизайн исследования. «dMMR» (mismatch repair deficiency) – дефицит белков системы репарации; «pMMR» (mismatch repair proficiency) – достаточная экспрессия белков системы репарации; «ЭМП-» – отсутствие или слабая экспрессия маркеров ЭМП; «ЭМП+» – высокий уровень экспрессии маркеров ЭМП
Операционный материал удаленной опухоли и лимфатических узлов был подвергнут патоморфологическому исследованию. При морфологическом исследовании были оценены следующие параметры: размер и макроскопическая форма роста опухоли, глубина инвазии в стенку кишки, состояние краев резекции, количество пораженных метастазами лимфатических узлов. Методом световой микроскопии оценивали степень дифференцировки опухоли, выраженность стромального и паренхиматозного компонентов, степени инфильтрации стромы опухоли иммунокомпетентными клетками. Изучение экспрессионных параметров проводили на парафиновых срезах образцов опухолевой ткани методом иммуногистохимии на иммуногистостейнере Bond RX (Leica Biosystem) [14]. Распределение РТК на суррогатные подтипы проводили в соответствии с их фенотипическими особенностями по алгоритму, предложенному Anne Trinh с соавторами [15]. К подтипу CMS1 были отнесены опухоли с гипериммунным фенотипом, в которых определялся дефицит одного или нескольких белков репарации неспаренных нуклеотидов (англ. mismatch repair, MMR). Исследование системы мисмэтч-репарации выполнено с использованием моноклональных антител к белкам: MLH1 (clone ES05. 1:50. Leica Biosystem, USA); MSH2 (clone 25D12. RTU. Leica Biosystem, USA); MSH6 (clone PU29. 1:100. Leica Biosystem, USA); PMS2 (clone M0R4G. 1:40. Cell Marque, USA). Карциномы, имеющие сочетание низкой экспрессии транскрипционного фактора CDX2 (RTU. Diagnostic Biosystem) с высоким уровнем экспрессии маркеров эпителиально-мезенхимального перехода HTR2B (1:100. Invitrogen), FRMD6 (1:100. Invitrogen), ZEB1 (1:100. Invitrogen), были расценены как мезенхимально-подобные (CMS4). К подтипам CMS2/3 были отнесены карциномы с отсутствием иммуногистохимического окрашивания маркеров эпителиально-мезенхимальной транзиции. Оценку изучаемых белков проводили по следующим параметрам: наличие или отсутствие факта окрашивания с антителом; процент позитивных опухолевых клеток [14].
Статистическая обработка проведена с использованием пакета программ StatSoft «Statistica 10.0». Для проверки нормальности распределения изучаемых показателей использовали критерии Шапиро–Уилка. Учитывая ненормальное распределение изучаемых признаков, для сравнения независимых выборок использовали непараметрические критерии Манна–Уитни, Краскела–Уоллиса. Исследование связи между парами дискретных качественных признаков проводили посредством оценки критерия Пирсона Хи-квадрат. Количественные признаки с ненормальным распределением представлены в виде медианы (Me) и интерквартильных значений (Q1÷Q3). Различия считались статистически достоверными при уровне р<0,05. Функцию трехлетней безметастатической выживаемости больных РТК оценивали методомКаплана–Мейера.
Результаты исследования и их обсуждение
В исследование были включены 100 больных РТК в возрасте от 49 до 75 лет (средний возраст составил 62,2±12,9 года). Распределение больных по полу, стадии заболевания, гистологическому строению и степени дифференцировки карцином представлено в таблице 1.
Таблица 1
Клинико-патологическая характеристика пациентов
|
Показатели |
Количество больных |
|
|
Пол |
Мужчины |
46 (46,0%) |
|
Женщины |
54 (54,0%) |
|
|
Всего |
100 (100,0%) |
|
|
Стадия РТК |
IIA |
22 (22,0%) |
|
IIB |
23 (23,0%) |
|
|
IIC |
22 (22,0%) |
|
|
IIIA |
4 (4,0%) |
|
|
IIIB |
21 (21,0%) |
|
|
IIIC |
8 (8,0%) |
|
|
Всего |
100 (100,0%) |
|
|
Гистологическое строение РТК |
Аденокарцинома |
87 (87%) |
|
Муцинозная карцинома |
13 (13%) |
|
|
Всего |
100 (100,0%) |
|
|
Степень дифференцировки аденокарциномы |
G1 |
18 (20,7%) |
|
G2 |
55 (63,2%) |
|
|
G3 |
14 (16,1%) |
|
|
Всего |
87 (100%) |
|
Проведен анализ частоты встречаемости опухолей с дефицитом белков системы репарации ДНК. По данным нашего исследования, в 16% наблюдений результаты иммуногистохимического исследования позволили выявить дефицит в системе неспаренных нуклеотидов. Данные опухоли были отнесены к иммунному подтипу (CMS1). Подгруппа CMS4 составила 22 наблюдения. Оставшиеся 62% наблюдений с отсутствием dMMR и слабой или негативной экспрессией маркеров ЭМП были отнесены в объединенную подгруппу эпителиальных карцином (CMS2/3).
Проведен анализ зависимости трехлетней безметастатической выживаемости от клинико-морфологических параметров и подтипа рака толстой кишки. У 17 больных за период наблюдения возникли отдаленные метастазы. Была выявлена зависимость частоты отдаленного метастазирования со стадией РТК и критерием «Т» первичной опухоли (соответственно: χ2=10,82; p=0,054 и χ2=10,17; p=0,017). Кроме того, частота отдаленного метастазирования опухоли была сопряжена с низкой степенью дифференцировки аденокарциномы (χ2=9,94; p=0,006). При этом у пациентов с муцинозной карциномой метастазов РТК обнаружено не было. Выявлены различия в проценте экспрессии ZEB1 в опухоли у больных с наличием и отсутствием отдаленных метастазов (0 (0÷18); 32 (0÷68), p=0,028, соответственно). Аналогичного рода различия выявлены для FRMD6, в случаях с отсутствием метастазов за период наблюдения экспрессия FRMD6 клетками опухоли составила 0 (0÷10), и 20 (0÷63) – в случаях с обнаруженным отдаленным метастазированием РТК, p=0,001. В отношении уровня экспрессии HTR2B подобных различий не показано. Согласно полученным нами данным, при развитии у пациентов гематогенного метастазирования РТК уровень экспрессии CDX2 в первичной опухоли был в 4 раза ниже по сравнению с пациентами без метастазов (р<0,001). По данным ряда авторов, дефицит в системе репарации неспаренных нуклеотидов сопряжен с лучшей общей и безрецидивной выживаемостью пациентов после радикального лечения [9]. В нашем исследовании анализ связи развития метастазов РТК и наличия дефицита в системе MMR в первичной опухоли не выявил статистически значимой зависимости, что может быть связано с недостаточным количеством больных с карциномами данного молекулярного подтипа. Частота отдаленного метастазирования при различных молекулярных субтипах РТК приведена в таблице 2.
Таблица 2
Частота обнаружения метастазов рака толстой кишки в зависимости от молекулярного подтипа рака толстой кишки
|
Суррогатный молекулярный подтип |
Метастазирование рака толстой кишки, абс. ч. (%) |
|
|
Нет (n=83) |
Да (n=17) |
|
|
CMS1 |
12 (14,5%) |
4 (23,5%) |
|
CMS2/3 |
58 (69,8%) |
4 (23,5%) |
|
CMS4 |
13 (15,7%) |
9 (53%) |
|
χ2=14,52; p<0,001 |
||
Наибольшая частота гематогенного метастазирования была отмечена при опухолях толстой кишки, имеющих мезенхимально-подобный фенотип по результатам иммуногистохимической экспрессии маркеров ЭМП (χ2=14,52; p<0,001). Безметастатическая трехлетняя выживаемость также была наименьшей в подгруппе больных, опухоли которых соответствовали CMS4 (χ2=13,4; p=0,001) (рис. 2).
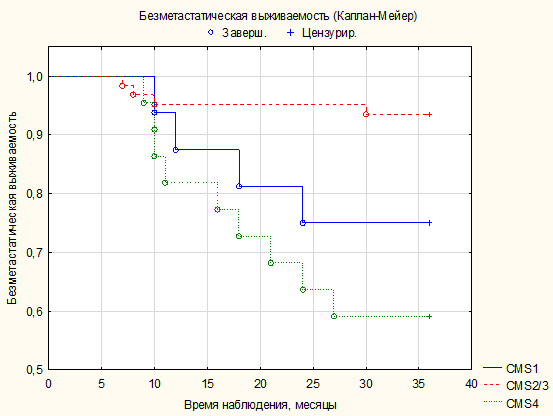
Рис. 2. График трехлетней безметастатической выживаемости по Каплану–Майеру больных РТК в зависимости от молекулярного подтипа опухоли
Полученные нами результаты о частоте выявления метастазов у пациентов с РТК при разных молекулярных подтипах опухоли согласуются с данными о клинических особенностях и прогнозе РТК в зависимости от молекулярного подтипа, определенного в соответствии с консенсусом [10].
Выводы
Результаты проведенного исследования отчетливо свидетельствуют о возможности распределения аденокарцином толстой кишки на основании панели иммуногистохимических маркеров на молекулярные подтипы. Предлагаемое разделение рака толстой кишки подтверждается различиями в клинико-патологических характеристиках опухоли и клиническим течением заболевания. Аденокарциномы толстой кишки с выраженным мезенхимным профилем характеризуются высокой степенью гистологической злокачественности, а также большей частотой отдаленных метастазов после радикального комбинированного лечения. Комплексная иммуногистохимическая оценка экспрессии маркеров ЭМП и статуса MMR первичной опухоли может служить в качестве подхода для распределения РТК на суррогатные молекулярные подтипы, сопряженные с 3-летней безметастатической выживаемостью больных. Наименьшую 3-летнюю безметастатическую выживаемость имеют больные с мезенхимально-подобным подтипом карциномы толстой кишки.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-31-70001.
Библиографическая ссылка
Синянский Л.Е., Крахмаль Н.В., Паталяк С.В., Афанасьев С.Г., Вторушин С.В. ИЗУЧЕНИЕ ТРЕХЛЕТНЕЙ БЕЗМЕТАСТАТИЧЕСКОЙ ВЫЖИВАЕМОСТИ В ЗАВИСИМОСТИ ОТ ЭКСПРЕССИИ МАРКЕРОВ СУРРОГАТНЫХ ПОДТИПОВ РАКА ТОЛСТОЙ КИШКИ // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32272 (дата обращения: 21.01.2026).
DOI: https://doi.org/10.17513/spno.32272



