Инсульт – ведущая причина инвалидизации во всем мире. Изменения моторики возникают у большинства пациентов с нарушением мозгового кровообращения в острой фазе и вносят существенный вклад в развитие двигательной дисфункции. Диффузионно-тензорная томография (ДТИ) – относительно новый метод магнитно-резонансной томографии (МРТ), который в основном использовался для оценки микроструктурных изменений в головном мозге путем измерения подвижности молекул воды в тканях. Его возможности визуализации основаны на способности определять ориентацию и характеристики диффузии белого вещества [1].
Недавние достижения в работе с ДТИ позволили обнаружить специфические для патологии детали, такие как микроструктурные изменения в аксонах и миелине белого вещества головного мозга [2]. В настоящее время основным направлением исследований ДТИ является отслеживание проводящих путей нервных волокон в центральной нервной системе [3] для определения их целостности. Полученные результаты можно использовать для составления программ медико-социальной реабилитации для каждого пациента персонифицированно на основании полученного после обозначенного выше анализа прогноза [4, 5].
Хотя ДТИ широко применяется в исследованиях различных клинических состояний [6], полуколичественный характер анализа данных ДТИ остается существенным ограничением [7]. Протокол измерений и обработка данных изображения должны быть стандартизированы для получения более точных количественных результатов. Передовые методы ДТИ позволили визуализировать потенциальные изменения в различных нервных путях, связанные с травмой головного мозга и лечением пациентов [8, 9].
Цель исследования: познакомить врачей и ученых с основными понятиями ДТИ и описать собственное наблюдение.
Фракционная анизотропия (ФА), которая является наиболее широко используемой величиной в ДТИ, рассчитывается путем деления квадратного корня из суммы квадратов (ККСК) разностей коэффициентов диффузии на ККСК коэффициентов диффузии [10]. Значения ФА 0 и 1 соответствуют бесконечной изотропии (т.е. эллипсоид представляет собой сферу) и бесконечной анизотропии (т.е. эллипсоид сильно вытянут) соответственно. Сам эллипсоид имеет три оси, называемые собственными векторами, которые обычно представляют собой длинную ось (λ1) и две малые оси (λ2 и λ3), представляющие ширину и глубину соответственно. Все три оси перпендикулярны друг другу и пересекаются в центральной точке эллипсоида. Измеренные длины трех осей являются собственными значениями. Коэффициент диффузии вдоль главной оси нервного тракта, которая является самой длинной (λ1), называется аксиальной диффузией (АД), или параллельной диффузией. Коэффициент диффузии среднего значения двух малых осей (λ2 и λ3) называется радиальным коэффициентом диффузии (РД), или перпендикулярным коэффициентом диффузии. Среднее значение трех ортогональных коэффициентов диффузии (λ1, λ2 и λ3) (рис. 1) известно как средний коэффициент диффузии (СД), а суммарный общий коэффициент диффузии трех собственных значений называется следом. Мода (MO) – это недавно разработанный тензорный индекс, который можно использовать в качестве вероятностной меры в трактографии перекрестных волокон. MO определяет тип анизотропии как непрерывную меру, которая указывает на различия в форме тензора диффузии и варьирует от плоской (плоский цилиндр) до линейной (трубка).
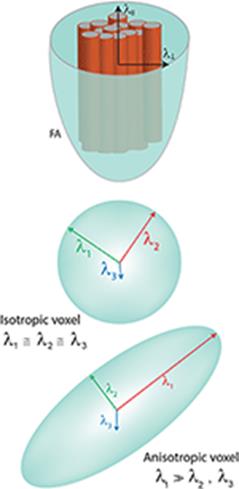
Рис. 1. Модель тензора, показывающая собственные значения. Коэффициенты диффузии изображены в представлении ФА (λll – коэффициент параллельной, или осевой, диффузии, λ⊥ – перпендикулярный, или радиальный, коэффициент диффузии)
(L.M. Moura et al., 2019)
В то время как ФА является наиболее часто используемой шкалой ДТИ, АД, РД, СД и MO также с недавнего времени используются в клинических работах. ФА является маркером целостности аксонов, который предполагает, что дегенерация может изменить форму диффузионного эллипсоида, что делает его высокочувствительным к микроструктурной целостности волокон. РД является предполагаемым миелиновым маркером, который увеличивается при повреждении миелина в ткани белого вещества. На него также могут влиять диаметр и плотность аксонов. Величина СД является обратной мерой плотности мембраны и не зависит от направления, но служит чувствительным показателем для определения отека и некроза [11]. Хотя ФА обладает высокой чувствительностью для обнаружения микроструктурных изменений, она не очень специфична для определения конкретного типа изменений. Теоретически ФА может уменьшаться в связи со снижением AД, увеличением РД или комбинацией этих двух факторов, поэтому для лучшей характеристики микроструктуры белого цвета рекомендуется использовать несколько скаляров ДТИ, таких как АД, РД, МД и MO. Известно, что снижение значений кажущегося коэффициента диффузии (ККД) связано с опухолями, инфильтрацией иммунных клеток, цитотоксическим отеком и кровоизлиянием, тогда как увеличение ККД связано с вазогенным отеком [11].
Обработка снимков
DTI Studio – это интегрированная программа обработки ДТИ [12], которая может работать в системах Microsoft Windows. Она был разработана для вычисления ДТИ и отслеживания волокон белого вещества. Различные форматы сканеров МРТ могут вводить данные ДТИ непосредственно в DTI Studio. Программное обеспечение может применять различные методы обработки, такие как вихретоковая коррекция, расчет тензора, отображение цветов и отслеживание волокон с быстрым назначением волокон с помощью алгоритма непрерывного отслеживания. Кроме того, он позволяет визуализировать отслеживаемые волокна как в двухмерном, так и в трехмерном (3D) режимах. Большинство операций этого программного обеспечения можно выполнить с помощью нескольких простых щелчков мыши.
Анализ диффузионного МРТ-изображения можно выполнить с помощью программного обеспечения DSI Studio [13]. Основные функции этого программного обеспечения включают реконструкцию ДТИ, визуализацию Q-ball, обобщенную визуализацию q-выборки, диффеоморфную реконструкцию Q-пространства, детерминированное отслеживание волокон и трехмерную визуализацию с использованием техники высокого уровня. DТI Studio не только поддерживает интерфейс на базе Windows, но еще может работать в системах macOS и Linux. Основным преимуществом этого программного обеспечения является то, что оно поддерживает статистический анализ как групповой, так и индивидуальной коннектометрии.
Инструмент Tracts Constrained by Underlying Anatomy (TRACULA) программного обеспечения FreeSurfer [13] представляет собой полностью автоматизированный метод обработки ДТИ для реконструкции длинных путей основных трактов белого вещества на основе глобального вероятностного подхода. Он использует априорную анатомическую информацию о проводящих путях от группы обучающихся [13]. Инструмент TRACULA может отслеживать 18 основных путей белого вещества в заранее определенных областях интереса на анатомических Т1-взвешенных МРТ-изображениях человека и работать со значениями ФА, АД, РД и СД для этих путей. Основными проблемами использования инструмента TRACULA являются длительное время постобработки одного исследования (порядка 6–8 часов), сложное управление консольными командами, которое требует достаточно много времени для изучения.
Вышеперечисленные показатели меняются у пациентов с церебральным инсультом, причем по-разному в разных его периодах вследствие структурной дезорганизации ишемизированного белого вещества. Хотя ККД оставался повышенным и после завершения острого периода инсульта, ФА продолжала снижаться в течение 6 месяцев после инсульта. Таким образом, анализ как ККД, так и ФА может быть полезен для оценки тяжести инсульта и прогнозирования его отдаленных исходов. Хотя ФА была снижена в областях с лейкоареозом, с увеличением Т2-взвешенных сигналов на обычной МРТ величина увеличения СД была значительно меньше, чем в области инфаркта [14]. Эти данные показывают, что ДТИ может надежно дифференцировать клинически значимый инфаркт от ишемического лейкоареоза.
Кортикоспинальный тракт (КСТ) является основным нервным трактом в головном мозге человека, ответственным за функцию произвольных двигательных актов в конечностях [15], поэтому сохранение или восстановление целостности КСТ имеет важное значение для эффективной двигательной реабилитации пациентов с инсультом. ДТИ можно использовать для оценки анатомической ориентации и целостности КСТ при инсульте. Два недавних метаанализа обнаружили сильную корреляционную связь между значениями ФА и восстановлением моторики верхних конечностей как при ишемическом, так и при геморрагическом инсультах [16, 17]. Снижение значений ФА обратно пропорционально улучшению неврологических исходов после церебрального инсульта в целом и двигательных функций пациента в частности [18]. Было показано, что значение ФА в ножке мозга можно использовать для прогнозирования потребности в ортезировании у пациентов с гемиплегическим инсультом. Когда оценочное значение ФА на пораженной стороне было >0,59, расчетная вероятность передвижения без ортеза составляла примерно 80% [19]. Кроме того, данные анализа ДТИ успешно использовались для оценки эффективности реабилитационных программ, таких как двигательная терапия, вызванная ограничениями [19]. Волюметрический анализ данных показал, что количество и длина волокон КСТ значительно увеличились после 8 недель тренировки рук. Толщина коры вентральной постцентральной извилины также значительно увеличилась, демонстрируя пластичность, вызванную тренировками с роботизированными устройствами [20].
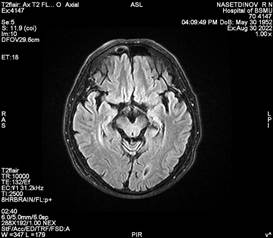
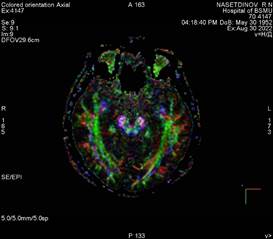
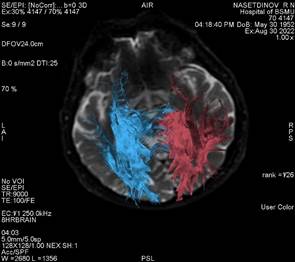
Нами наблюдается пациент Н., перенесший острое нарушение мозгового кровообращения по ишемическому типу в бассейне левой средней мозговой артерии в 2018 г., с глубоким центральным правосторонним гемипарезом (сила мышц – 2 балла) и мышечной спастичностью большого пальца правой нижней конечности (3 балла по Эшворту). Из анамнеза пациента известно, что у пациента гипертоническая болезнь 3-й стадии, 2-й степени, риск 3. До 2018 г. не было острых нарушений мозгового кровообращения по ишемическому типу, первая церебральная катастрофа произошла в 2018 г. При госпитализации в 2018 г. в неврологическом статусе отмечался правосторонний центральный гемипарез до 2 баллов, в течение 1 месяца парез из вялого трансформировался в спастический с эквинусной установкой стоп и проксимальной и дистальной спастичностью верхней конечности, в остальном в неврологическом статусе без особенностей. После проведения первого этапа реабилитации пациент неоднократно госпитализировался для проведения второго этапа реабилитации в стационар по месту жительства, но преодолеть спатичность мышц так и не удавалось. Пациент пришел на отбор на госпитализацию с целью проведения ботулинотерапии в мышцы-мишени. Пациент госпитализирован в Клинику БГМУ спустя 4 года после церебрального инсульта с целью проведения ботулинотерапии, с последующим проведением реабилитационных мероприятий в стационаре по месту жительства через 2–4 недели после введения ботулинического токсина типа А. Перед введением препарата нами проведено МРТ-исследование головного мозга данному пациенту в режиме Т2 (рис. 2) с построением КСТ (рис. 3, 4, 5).


|
Рис. 2. Магнитно-резонансно-томографическое изображение головного мозга (аксиальная проекция) пациента Н. в режиме Т2 |
Рис. 3 Карта диффузии, полученная при анализе магнитно-резонансно-томографического изображения головного мозга пациента Н |


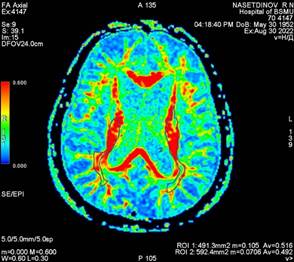
|
Рис. 4. Проводящие пути головного мозга пациента Н., построенные с помощью описанного в статье программного обеспечения |
Рис. 5. Выделены «зоны интереса», соотносящиеся с проекциями КСТ, целостность которых может влиять на эффективность реабилитационных мероприятий пациента Н |
По результатам проведенной дМРТ пациента Н. мы визуально можем отметить схожие показатели кортикоспинального тракта как слева, так и справа. Более того, показатели фракционной анизотропии подтверждают наше предположение о восстановлении проводящих путей слева и справа. Cредние показатели фракционной анизотропии были относительно равны и составили 0,535 и 0,543 соответственно. Это косвенно говорит нам о том, что реабилитационные мероприятия, проводимые пациенту Н., прошли успешно. На момент осмотра сила в конечностях составила 5 баллов, однако оставалась спастичность в конечностях. Реабилитационный потенциал данного пациента мы оцениваем как высокий, однако реабилитационные мероприятия следует направить на снижение спастичности пораженных конечностей и тренировку баланса, и во время восстановления не следует уделять много времени увеличению силы мышц. Также стоит учесть не только фракционную анизотропию, но и площадь КСТ. В случае пациента Н. она составила 169 и 145 мм2, что указывает на то, что поражение КСТ имело место во время острейшего периода церебрального инсульта. Данный пациент был осмотрен через 45 недель после введения ботулотоксина типа А и соответственно после проведения дМРТ и второго этапа реабилитации. Спастичность в большом пальце левой нижней конечности составила 1 балл по Эшворту, что указывает на то, что все мероприятия в отношении данного пациента были проведены верно. К сожалению, данная методика не используется в остром периоде церебрального инсульта и требует разработки золотого стандарта. Следует указать, что наиболее чувствительным инструментом в ранней диагностике зоны поражения является дМРТ. И, поскольку дМРТ восприимчива к перераспределению молекул воды во внутриклеточном и межклеточном пространстве, острые нарушения мозгового кровообращения в определенный временной промежуток выглядят при данном виде томографии как гиперинтенсивные участки, отражающие уменьшение коэффициента диффузии молекул воды. Существенным преимуществом дМРТ является возможность ранней и точной локализации повреждения с последующим проведением своевременной и эффективной реперфузионной терапии, что, в конечном счете, уменьшает степень инвалидизации пациентов, перенесших инсульт. Причем размер поля визуализации при МРТ значительно превышает таковой для перфузионной компьютерной томографии, тем самым создавая предпосылки для получения более полной картины поражения.
Заключение. ДТИ – новый метод нейровизуализации для выявления микроструктурных изменений. Различные скаляры ДТИ, такие как ФА, АД, РД, СД и MO, могут быть сопоставлены с клинической информацией для выявления аномалий, связанных с неврологическими заболеваниями. Усовершенствованные надежные методы постобработки позволили получить новую информацию об анатомических и структурных путях мозга, показанную нами в данной статье на описанном клиническом примере. Полученная при данном нейровизуализационном исследовании информация об анатомической целостности КСТ пациента Н. и продолжающееся восстановление его двигательных функций, несмотря на формальное завершение восстановительного периода инсульта, наблюдаемое нами клинически, дают нам основание не прекращать реабилитационные мероприятия, в том числе с применением дорогостоящей ботулинотерапии для уменьшения спастичности, прогнозируя эффективность наших действий и продолжение восстановления двигательной функции, столь необходимой нашему мотивированному пациенту как для работы, так и в быту.
Визуализация и измерение цифровых значений количества и плотности проводящих путей головного мозга с помощью ДТИ в течение первых часов и до 3 месяцев после инсульта стали потенциальными биомаркерами восстановления моторики. Таким образом, дальнейшее исследование метода ДТИ с определением четких стандартов сбора, анализа и обработки данных имеет большой потенциал в совершенствовании тактики лечения пациентов, что ведет к снижению риска и степени инвалидизации пациентов, перенесших инсульт головного мозга. Также медицинскому сообществу необходимо разработать золотой стандарт для проведения исследования с целью осуществления большого мультицентрового исследования. Данное направление является одним из наиболее важных направлений нашей дальнейшей научной деятельности.
Улучшения в методах получения ДТИ изображений, такие как более короткое время сканирования (чтобы уменьшить влияние движения головы во время проведения СРТ-исследования), высокое пространственное разрешение и разрешение в направлении градиента, более высокое отношение сигнал/шум и стандартизация методов постобработки, позволяют предлагать использование ДТИ в клинических исследованиях [21] как биомаркер потенциала восстановления и как ответ пациента на проводимые ему медико-социальные реабилитационные мероприятия. В результате проведения СРТ на ДТИ могут быть получены изображения, которые не требуют дополнительного окрашивания, что позволяет проводить исследование на большом количестве пациентов и сократить время исследования. Возможность получения изображений в режиме реального времени и возможность оценки динамики восстановления при проведении реабилитационных мероприятий делают необходимым применение ДТИ для мониторинга эффективности реабилитации.
Библиографическая ссылка
Гизатуллин Р.Р., Ахмадеева Л.Р., Байков Д.Э., Хафизов М.М., Ахмадеева Э.Н. ДИФФУЗИОННО – ТЕНЗОРНАЯ МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ ДЛЯ ПРОГНОЗИРОВАНИЯ ИСХОДОВ ПОСЛЕ ЦЕРЕБРАЛЬНОГО ИНСУЛЬТА // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32271 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.32271



