Анапластический рак (АР) – это высокозлокачественная эпителиальная опухоль щитовидной железы (ЩЖ) с крайне неблагоприятным прогнозом. АР является одним из самых редких злокачественных новообразований (ЗНО) ЩЖ, частота встречаемости АР составляет 1–2 случая на 1 млн первичных опухолей ЩЖ, а его доля обычно не превышает 1,6% от всех ЗНО ЩЖ [1].
На данный момент в мировой литературе описано множество морфологических вариантов АРЩЖ, некоторые из которых представлены крайне редкими формами. С учетом агрессивного течения АРЩЖ необходимо в кратчайшие сроки установить правильный диагноз. Гипердиагностика АРЩЖ повлечет за собой излишне агрессивное лечение пациента и, наиболее вероятно, существенное ухудшение качества его жизни. В свою очередь, гиподиагностика АРЩЖ приведет к неадекватному объему лечения и летальному исходу.
Однако поставить правильный диагноз часто представляется непростой задачей. Существенно влияет на постановку диагноза разнообразие гистологических и иммуногистохимических параметров, которые могут ввести в заблуждение даже опытных морфологов. АР отличается большим количеством паттернов строения и утратой опухолевыми клетками экспрессии органоспецифичных маркеров. В нашей статье мы рассмотрим отличительные гистологические параметры АРЩЖ и его редкие формы.
Материалы и методы исследования. Для работы был использован операционный материал пациентов со ЗНО ЩЖ, находившихся на лечении в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина». Операционный материал опухолей щитовидной железы фиксировался в нейтральном забуференном формалине и заключался в парафин. Срезы с парафиновых блоков окрашивались гематоксилином и эозином в соответствии со стандартной методикой для проведения рутинного гистологического исследования.
Иммуногистохимическое (ИГХ) исследование выполнялось на автоматизированной платформе Dako Link48 (система детекции EnVision Flex). Были использованы антитела к цитокератинам (СК8, CK18, CK19), vimentin, carcinoembryonic antigen (CEA), epithelial membrane antigen (EMA), thyroid transcription factor 1 (TTF-1), paired box gene (PAX5 и PAX8), cluster of differentiation (CD5, CD20, CD117), B cell lymphoma 2 (BCL2), SRY-related HMG-box 10 (SOX10), solubility in 100% saturated ammonium sulfate at neutral pH (S100), Marker of cell proliferation (Ki-67), Tumor suppressor gene at 17p13 (p53). С парафиновых блоков готовились срезы толщиной 3–4 мкм. Окрашивание подготовленных срезов проводилось в соответствии с рекомендациями производителя антител. Ядра клеток докрашивали гематоксилином Майера.
Гистологические характеристики опухоли
К гистологическим признакам злокачественности опухоли традиционно относятся высокая митотическая активность опухолевых клеток, наличие атипичных митотических фигур, очаги некроза, признаки инвазивного роста, в том числе сосудистая и периневральная инвазия. Все вышеперечисленные параметры также относятся и к АРЩЖ, что позволяет на светооптическом уровне отличить данную опухоль от высокодифференцированных первичных карцином ЩЖ. Еще одной отличительной особенностью АРЩЖ является наличие очагов гетерологичной дифференцировки, таких как костный и хрящевой матрикс [2]. Стоит обратить особое внимание на неопухолевый характер гетерологичных элементов, так как в мировой литературе описаны и первичные саркомы щитовидной железы: фибросаркома, лейомиосаркома, хондросаркома, остеосаркома и ангиосаркома (включая эпителиоидный вариант) [3, 4, 5] (рис. 1). Также возможно появление интратиреоидных метастазов сарком других локализаций [6], в связи с чем при постановке диагноза необходим тщательный анализ анамнестических данных.
Участки более дифференцированной опухоли щитовидной железы. В настоящий момент до конца не изучено, может ли АРЩЖ возникать de novo. Однако множество описанных случаев сосуществования АРЩЖ с более дифференцированными ЗНО ЩЖ не оставляют сомнений, что АРЩЖ может возникать вторично, путем дедифференцировки клеток опухоли. Наличие очагов более дифференцированной опухоли ЩЖ среди АРЩЖ является надежным маркером вторичного АРЩЖ.
Важное значение имеет объем исследованной опухолевой ткани: при тотальном исследовании опухоли возрастает вероятность обнаружения очагов опухоли-предшественника в случаях вторичного АР. В исследовании 42 случаев АР с тотальным забором операционного материала M.L. Ibanez с соавт. [7] обнаружили фокусы ВДР во всех 42 случаях. Таким образом, адекватный объем исследованного материала позволяет более точно установить диагноз.
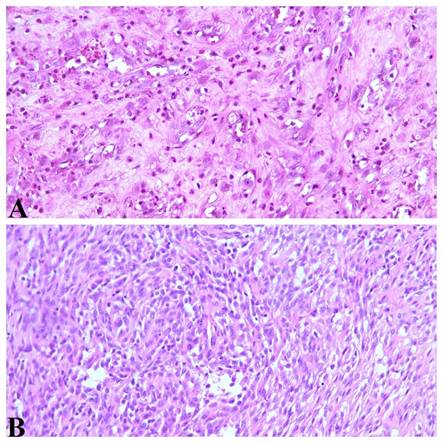
Рис. 1. Саркоматоидные варианты анапластического рака. А – пациент М., 69 лет, опухоль имитирует ангиосаркому. Окраска гематоксилином и эозином, увеличение х200. Б – пациент О., 72 года, опухоль имитирует синовиальную саркому. Окраска гематоксилином и эозином, увеличение х200
Очаги плоскоклеточной дифференцировки. АР с плоскоклеточной дифференцировкой представляет собой подтип опухоли с наличием плоскоклеточных зон, содержащих фокусы ороговения. Изначально он был описан M.P. Bronner и V.A. LiVolsi как уникальный подтип АР, связанный с вариантом папиллярного рака ЩЖ из высоких клеток [8].
В щитовидной железе плоскоклеточная дифференцировка может наблюдаться и в других новообразованиях. Описаны фокусы плоскоклеточной дифференцировки клеток опухоли как результат метапластического процесса при папиллярной карциноме (чаще всего при диффузном склерозирующем варианте), при медуллярной карциноме, мукоэпидермоидном раке и склерозирующей мукоэпидермоидной карциноме с эозинофилией [9]. Плоскоклеточная дифференцировка также присутствует в большинстве случаев интрагландулярной тимической карциномы. Отсутствие очагов некроза в сочетании с экспрессией опухолевыми клетками CD5 и CD117 помогает дифференцировать последнюю от АР [9] (рис. 2).
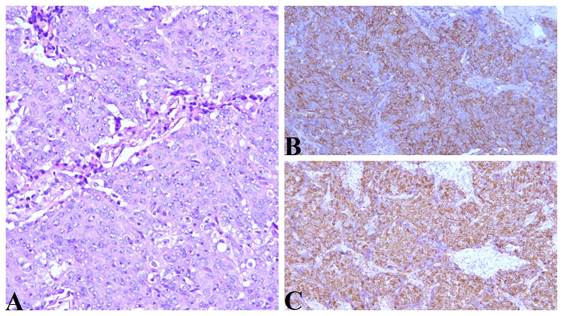
Рис. 2. Интратиреоидная тимическая карцинома, удаленная у пациента Б., 40 лет.
А – опухоль представлена пластами эпителиоидных клеток со светооптическими признаками плоскоклеточной дифференцировки. Окраска гематоксилином и эозином, увеличение х200. В – реакция с антителом к CD5, отмечается мембранная экспрессия маркера клетками опухоли. Увеличение Х100. C – реакция с антителом к CD117, отмечается мембранная экспрессия маркера клетками опухоли. Увеличение х100
В тех случаях, когда опухоль ЩЖ почти полностью состоит из сквамоидных элементов, в первую очередь необходимо исключить врастание опухоли из верхних дыхательно-пищеварительных путей и метастаз плоскоклеточного рака других локализаций, в первую очередь рака легкого (рис. 3). Так, вторичное вовлечение и метастатическое поражение щитовидной железы встречаются чаще, чем это обычно считается, и встречаются примерно в 10 раз чаще, чем первичный плоскоклеточный рак ЩЖ [10]. В связи с вышеизложенным очаги плоскоклеточной дифференцировки не являются достоверными признаками АРЩЖ.
Редкие варианты анапластического рака щитовидной железы
Рабдоидный вариант анапластического рака. Одним из редких вариантов АР считается рабдоидный, по гистологическому строению схожий с рабдоидными новообразованиями других локализаций. Впервые опухоль с рабдоидной морфологией была впервые описана J.B. Beckwith и N.F. Palmer в 1978 г. как вариант опухоли Вильмса у детей [11]. Она состоит из крупных плеоморфных клеток с обильной цитоплазмой, парануклеарными эозинофильными включениями, эксцентрично расположенным ядром с различимым ядрышком (рис. 4). Иммунофенотип может варьироваться от случая к случаю: в мировой литературе встречаются описания экспрессии опухолевыми клетками виментина, миогенина, маркеров эпителиальной и гладкомышечной дифференцировки, нейрон-специфических маркеров и S100 [12]. Подтверждением принадлежности этой опухоли к АРЩЖ являются и схожая клиническая картина заболевания, и описанные в литературе интратуморальные фокусы фолликулярного или папиллярного рака ЩЖ [7].
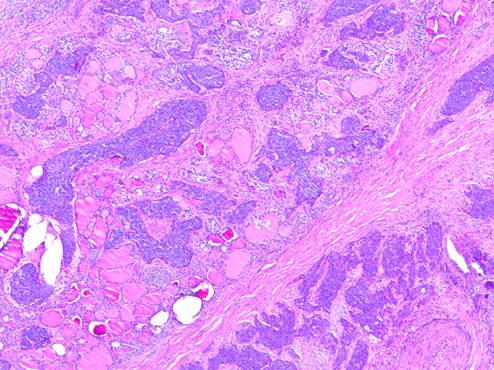
Рис. 3. Интратиреоидный метастаз низкодифференцированного плоскоклеточного рака носоглотки, удаленный у пациента Р., 60 лет. Многочисленные разнокалиберные фокусы роста опухоли без формирования единого узла. Окрашивание гематоксилином и эозином, увеличение х50
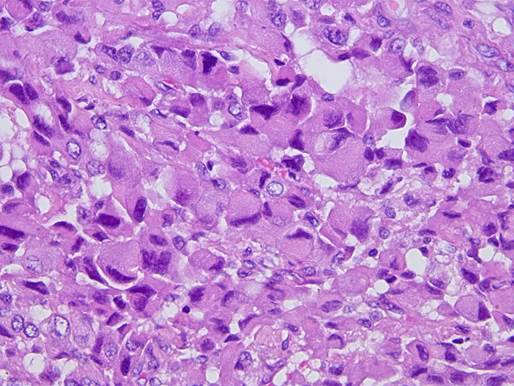
Рис. 4. Рабдоидный вариант анапластического рака, удаленный у пациента Я., 70 лет. Выраженное преобладание опухолевых клеток с рабдоидной морфологией. Окрашивание гематоксилином и эозином, увеличение х400
Лимфоэпителиомоподобный вариант анапластического рака. Лимфоэпителиомоподобный вариант АР гистологически имитирует лимфоэпителиому носоглотки и лимфоэпителиомоподобную карциному других локализаций [13]. Этот вариант состоит из пластов крупных низкодифференцированных клеток с плотным воспалительным инфильтратом, включающим преимущественно лимфоциты и плазматические клетки. Примечательно, что этот вариант АР не ассоциирован с инфицированием вирусом Эпштейна–Барр, как в случаях с лимфоэпителиомоподобной карциномой других локализаций.
Бедноклеточный вариант анапластического рака. Наиболее часто встречающийся саркоматоидный вариант АРЩЖ построен из веретеновидных клеток, имеет пучковое строение, неотличимое от веретеноклеточных сарком. Одним из редких вариантов АР является бедноклеточный вариант, относящийся к подтипу саркоматоидного варианта АРЩЖ. Он был впервые описан S.K. Wan с соавт. в 1995 г. как подтип АР, макро- и микроскопически имитирующий тиреоидит Ридделя [14]. Бедноклеточный вариант характеризуется низкой клеточностью, высокой степенью фиброза и гиалинизации, наличием веретеновидных клеток, напоминающих фибробласты или миофибробласты, отсутствием выраженной ядерной атипии и скудной лимфоцитарной инфильтрацией. К морфологическим особенностям, позволяющим диагностировать бедноклеточный вариант АР, относят наличие очагов коагуляционного некроза с «тенями» ранее существовавших кровеносных сосудов; слабая клеточная атипия; наличие митозов в наиболее клеточных областях и на периферии полей фиброза.
При диагностике бедноклеточного варианта АРЩЖ особо важны данные анамнеза. Характерная клиническая картина в виде быстрого увеличения опухоли в объеме, данные о вовлечении соседних структур указывают на злокачественный характер процесса. В противном случае, при длительно существующем процессе, имеется больше оснований думать о тиреоидите Ридделя. Интерпретировать гистологическую картину без данных анамнеза в таких случаях не рекомендуется [14].
Карциносаркома. Особое положение в классификации опухолей ЩЖ в настоящее время занимает карциносаркома ЩЖ. Хотя в настоящее время эта опухоль также признана вариантом АР [15], некоторые авторы выделяют эту опухоль как самостоятельную нозологическую единицу. Карциносаркома является диморфной опухолью, сочетающей в себе два структурных компонента: карциноматозный и саркоматозный. Карциноматозный компонент наиболее часто представлен высокодифференцированным (папиллярным или фолликулярным) раком ЩЖ, а саркоматозный компонент может быть представлен остеосаркомой, хондросаркомой, фибросаркомой или недифференцированной саркомой. В большинстве случаев структурные компоненты карциносаркомы располагаются в опухолевом узле обособленно, с нерезко выраженной линией соприкосновения или образованием переходных зон с взаимопроникновением компонентов [16].
Опухоли с мелкоклеточной морфологией. Стоить отметить, что на данный момент в литературе не описан мелкоклеточный вариант АРЩЖ. Часто опухоли ЩЖ мелкоклеточного строения являются интратиреоидными метастазами ЗНО других локализаций. Некоторые случаи, ранее диагностированные как мелкоклеточный вариант АР, с помощью иммуногистохимического исследования были редиагностированы как лимфома или медуллярный рак ЩЖ. Так, например, B.C. Wolf с соавт. проанализировали 68 случаев АР с помощью иммуногистохимических методов и обнаружили, что 65 из них на самом деле являлись лимфомой и только 3 случая имели эпителиальное происхождение [17].
Крупноклеточные лимфомы, в частности В-крупноклеточная лимфома, может являться первичной опухолью ЩЖ. Экспрессия опухолевыми клетками CD20 и PAX-5 на фоне выраженной экспрессии других В-клеточных маркеров (BCL-2) указывает на лимфому (рис. 5). Лимфомы не демонстрируют такого явного клеточного плеоморфизма, как АР, и имеют более благоприятный прогноз [17]. Медуллярный рак ЩЖ может быть также выявлен с помощью ИГХ-исследования, в частности опухолевые клетки будут экспрессировать нейрон-специфическую энолазу, хромогранин и кальцитонин.
Еще одним ЗНО, с которым необходимо проводить дифференциальную диагностику АР, является меланома. Во многих случаях пациенты уже имеют соответствующий анамнез. Такие препараты содержат популяцию крупных эпителиоидных или веретеновидных клеток, реже встречаются плеоморфные клетки. Клетки опухоли содержат эксцентрично расположенное округло-овальное ядро с хорошо различимым ядрышком, случайные ядерные псевдовключения и зеркальные ядра — все это можно встретить и в АР. Количество цитоплазмы варьируется; нередко встречаются мелкие цитоплазматические вакуоли. Отложения меланина, как правило, отсутствуют. Для ИГХ-диагностики в таких случаях рекомендуется использовать S100 м SOX10. Экспрессия S100 отсутствует во всех видах первичной карциномы ЩЖ. SOX-10 является положительным в 78–100% случаев метастазов веретеноклеточных и десмопластических меланом, что делает его более чувствительным и специфичным маркером для труднодиагностируемых случаев [18].
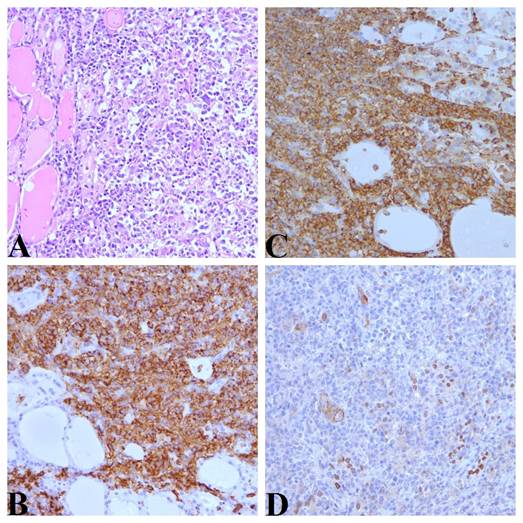
Рис. 5. Диффузная В-крупноклеточная лимфома щитовидной железы, удаленная у пациента Г., 56 лет. А – опухоль с мелкоклеточной морфологией, окрашивание гематоксилином и эозином, увеличение х200. В – реакция с антителом к CD45, отмечается мембранная экспрессия маркера клетками опухоли. Увеличение х200. C – реакция с антителом к CD20, отмечается мембранная экспрессия маркера клетками опухоли. Увеличение х200. D – реакция с антителом к TTF-1. Отмечается ядерная экспрессия маркера «замурованными» тиреоцитами, экспрессии маркера клетками опухоли не обнаружено. Увеличение х200
Иммуногистохимическая диагностика
Ввиду выраженной дедифференцировки клеток АРЩЖ иммуногистохимическая диагностика этой опухоли вызывает значительные трудности. Клетки АРЩЖ демонстрируют довольно скудный иммунофенотип, как правило, утрачивают экспрессию органоспецифичных, а в ряде случаев и эпителиальных маркеров. Экспрессия опухолевыми клетками панцитокератина присутствует в 45–91% случаев. Наиболее часто обнаруживается экспрессия низкомолекулярных цитокератинов, например CK8, CK18 и CK19 [1, 2, 17, 19]. Экспрессия виментина, как правило, постоянно присутствует в веретеновидных клетках саркоматоидного варианта, тогда как экспрессия EMA и CEA особенно характерна для клеток эпителиоидно-сквамоидного варианта [1, 2, 17, 19]. Тем не менее, отсутствие экспрессии опухолевыми клетками эпителиальных маркеров не исключает диагноз АР.
Наиболее часто описанным органоспецифичным маркером АРЩЖ является PAX8. По данным литературы, лишь 20% случаев АР не экспрессируют PAX8 [19]. Вторым наиболее часто встречающимся маркером тиреоидной дифференцировки, экспрессируемым клетками АРЩЖ, является TTF-1. Экспрессия TGB клетками АР является спорной, она находится в диапазоне от 0% до 50% и часто имеет слабое или неоднозначное окрашивание. При этом необходимо помнить, что интенсивная экспрессия TGB в отдельных группах клеток может быть связана с замурованными в опухоли нормальными фолликулярными структурами ЩЖ [20].
Отличительными особенностями АР являются высокая митотическая активность и высокий индекс Ki-67. Так, митотическая активность клеток опухоли может превышать 20 митозов в 10 РПЗ, а индекс Ki-67 в АР в среднем составляет 32,6–52,6% [1, 2, 17, 19]. Еще одним из иммуногистохимических маркеров, качественно выделяющих АР из группы карцином щитовидной железы, является р53. Гиперэкспрессия р53 в ядрах опухолевых клеток или ее полное отсутствие значимо коррелируют с наличием в опухоли мутации гена TP53, характерной для АР. По разным данным, мутация гена ТЗ53 выявляется в 30–70% случаев АР [1, 2, 17, 19].
Заключение. Для постановки АРЩЖ необходимо в первую очередь тщательное исследование операционного материала. Выявление участков более дифференцированной опухоли-предшественника достоверно указывает на вторичный АР. При постановке диагноза необходимо учитывать все участки строения опухоли. АР лишь в редких случаях представлен одним паттерном роста, наличие нескольких паттернов будет указывать на АР. Гистологическую картину следует интерпретировать совместно с данными анамнеза и данными обследования пациента.
Для окончательного суждения о гистогенезе опухоли и подтверждения АРЩЖ необходимо ИГХ-исследование. Диагностическая панель должна составляться индивидуально для каждого случая, маркеры должны подбираться в зависимости от гистологического строения опухоли и особенности иммуногистохимических признаков тех новообразований, с которыми проводится дифференциальная диагностика.
Библиографическая ссылка
Вилкова А.С., Козлов Н.А., Бржезовский В.Ж. МОРФОЛОГИЧЕСКОЕ РАЗНООБРАЗИЕ И ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА АНАПЛАСТИЧЕСКОГО РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32264 (дата обращения: 15.02.2026).
DOI: https://doi.org/10.17513/spno.32264



