Современная терапия гемобластозов у детей предполагает использование высокодозной химиотерапии согласно принятым протоколам. Многие препараты этой категории являются потенциально гепатотоксичными, вызывая различные повреждения печени с развитием центролобулярных некрозов, мелкокапельной жировой дистрофии, интрагепатоцеллюлярного холестаза и др. [1-3]. Механизм печеночного повреждения цитостатиками известен. Так, для метотрексата характерен антиметаболический эффект, с индуцированием клеточного оксидативного стресса, при длительном приеме описаны развитие фиброза и цирроза печени. Для многих других препаратов, использующихся в протоколах терапии гемобластозов, также установлены их гепатотоксические свойства: меркаптопурин и его производное азатиоприн индуцируют внутриклеточный холестаз, L-аспарагиназа в 42–78% случаев вызывает жировую дистрофию органа. Антрациклиновые антибиотики, циклофосфамид - обладают прооксидантными свойствами и, как следствие, гепатотоксичностью [4; 5].
Считается, что не менее чем у 30-60% этого профиля развивается цитолитический синдром и гипербилирубинемия, а в 100% случаев будут наблюдаться при использовании высокодозной химиотерапии [4].
Кроме того, развивающийся миелодепрессивный синдром требует также адекватной медикаментозной поддержки. Назначаемые с целью его коррекции лекарственные средства (флуконазол, ампициллины, макролиды, сульфаниламиды, фторхинолоны и др.) вызывают митохондриальные повреждения, апоптоз гепатоцитов, нарушения секреции желчи, повреждения холангиоцитов [5].
В известной мере потенциальное поражение печени усугубляется и основным заболеванием (лейкоз, лимфома). В этих условиях развитие гепатотоксического эффекта возрастает и зачастую требует временной медикаментозной паузы или снижения дозы цитостатического препарата, что также нежелательно в условиях терапии по протоколу [1].
В связи с этим обоснованной является «сопроводительная» терапия гепатопротекторными препаратами. Известно, что препараты данной группы обладают мембраностабилизирующими, антиоксидантными, антифибротическими эффектами, необходимыми пациентам этого нозологического профиля. Одним из препаратов с доказанной эффективностью является урсодезоксихолевая кислота. Кроме доказанного антифибротического, гипохолестеринемического и литолитического эффектов, описаны противовоспалительный и иммуносупрессивный эффекты [2; 6; 7]. Установлено, что урсодезоксихолевая кислота уменьшает экспрессию молекул HLA на холангиоцитах и гепатоцитах, предотвращая активацию цитотоксичных Т-лимфоцитов, снижает продукцию провоспалительных цитокинов (фактор некроза опухоли альфа, интерлейкины -1, -2, -4, -6) и продукцию аутоантител [8-10]. Также установлена способность урсодезоксихолевой кислоты (в эксперименте) активировать цитохром р450 [11; 12].
Существенным фактом в условиях современной страховой медицины является необходимость обоснования всех медикаментозных назначений, особенно с превентивной целью, даже у такой категории пациентов.
Цель исследования: установить эффективность терапии гепатопротекторами в различных сроках от своего назначения в составе сопроводительной терапии протоколов лечения гемобластозов у детей.
Материал и методы исследования
Нами было проанализировано 52 истории болезни детей с гемобластозами (лейкозы и лимфомы). Все дети находились на обследовании и лечении в онкологическом отделении Иркутской областной детской клинической больницы в период с 2000 по 2007 год.
Критерием выбора именно этих клинических случаев послужили следующие обязательные факторы: острый лейкоз, лимфомы (ходжкинские и неходжкинские), впервые выявленные у детей; отсутствие отягощенного преморбидного фона у данной группы детей с хроническими заболеваниями печени (в том числе отсутствие на момент обследования и в анамнезе вирусных гепатитов В и С; отсутствие репликативной активности других вирусных инфекций (из определяемых методами ИФА и ПЦР: цитомегаловирусной, Эпштейна-Барр и герпетических инфекций, токсоплазмоз).
Все дети были обследованы согласно принятым стандартам, включая биохимический профиль печеночных проб: билирубин и фракции, АлТ, АсТ, ЛДГ, щелочная фосфатаза, белковые фракции (включая альбумин), щелочная фосфатаза, гаммаглутамилтрансфераза, коагулограмма на старте обследования и динамически и др.
Оценка основных биохимических изменений нами анализировалась в первые 10-14 дней от момента лечения гемобластоза, поскольку в дальнейшем дети имели различные осложнения и течение миелосупрессивного синдрома, и на данном числе наблюдений делать выводы не представляется корректным.
Основным протоколом лечения лейкозов были ALL BFM-90, лимфом – DAL-2002.
Средний возраст составил 4,5+1,3 года, всего мальчиков – 32, девочек – 20.
Статистическая обработка показателей проводилась в программе Statistica 10.0, с использованием параметрического критерия Стьюдента. Статистически значимыми считали различия между двумя выборками при р<0,05.
Результаты исследования и их обсуждение
В процессе анализа полученных данных мы выделили две основные группы: 1-я группа – 25 детей, которым назначались гепатопротекторы только при появлении показаний (нарушение функционального состояния печени биохимически, в печеночных пробах), и 2-я группа – 27 человек, которым гепатопротекторы (препараты урсодезоксихолевой кислоты) назначались одновременно со стартом полихимиотерапии основного заболевания. Выбор группы детей, получающих именно урсодезоксихолевую кислоту, связан с возрастными ограничениями в использовании гепатопротекторов других групп, наличием ее жидкой формы, допустимостью приема с раннего возраста.
В данной работе приведен анализ биохимических данных в первые 10-14 дней проведения блока индукции (для лейкозов) и 1 курса терапии (для лимфом).
Известно, что одним из ключевых показателей, отражающих состояние печени, являются биохимические пробы, с выделением четырех основных: цитолитический, гепатопривный, холестаза, мезенхимально-воспалительный. При этом отмечается прямая корреляция между уровнем гипертрансаминаземии (преимущественно аланиновой аминотрансферазы - АлТ) и степенью разрушения, что принято отражать в степени повышения от принятой верхней границы нормы (ВГН). Цитолитический синдром рассматривается и как нежелательное побочное действие цитостатических препаратов, и как лекарственно индуцированный гепатит (лекарственное повреждение печени). Анализ уровня лактатдегидрогеназы мы не проводили ввиду ее специфичности для лейкозов.
При анализе полученных результатов оказалось, что в дебюте гемобластоза уровни билирубина у большинства были в пределах референсных значений.
В процессе химиотерапии повышение общего билирубина наблюдалось в единичных случаях (уровни 20-30 мкмоль/л) и тоже не имело статистически достоверной разницы между группами. При анализе клинических проявлений в данные сроки желтушный синдром не был зафиксирован ни в одном случае.
Показатели щелочной фосфатазы, гаммаглутамилтрансферазы повышались умеренно только у 15% детей и по группам сравнения на этом числе наблюдений также не показали существенной разницы. В дебюте гемобластозов эти показатели были также не изменены.
Однако в отношении трансаминаз (АлТ и АсТ) мы получили значимые различия. На рис. 1 представлены показатели АлТ (%, от верхней границы нормы).
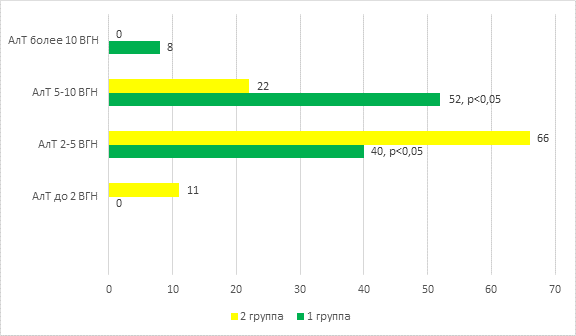
Рис. 1. Показатели АлТ (%, от верхней границы нормы)
В дебюте гемобластоза, еще до назначения специфической терапии, у большинства детей показатели трансаминаз были в пределах референсных значений и значимых отличий не показали.
Для пациентов второй группы было характерно повышение АлТ, в основных случаях (66%) в 2-5 раз; повышение в 5-10 раз – всего в 22% случаев.
Показатели АлТ у детей первой группы были преимущественно в пределах от 5 до 10 норм (52%), повышение в 2-5 раз от верхней границы нормы – только в 40%, в то время как для второй группы это было преобладающим достоверно (р<0,05).
Цитолиз высокой степени активности (более 10 раз от верхней границы референсного показателя) был зарегистрирован в небольшом числе наблюдений, но все эти случаи относились к детям первой группы.
Таким образом, пациенты, которым назначалась урсодезоксихолевая кислота в ранние сроки, одновременно со стартом полихимиотерапии, еще до наступления биохимических изменений, имели преимущественно умеренный (в 2-5 раз) подъем аланиновой трансаминазы (t=2,00), нежели высокий.
Схожие изменения отмечались и для показателей аспартатаминотрансферазы (АсТ) (рис. 2).
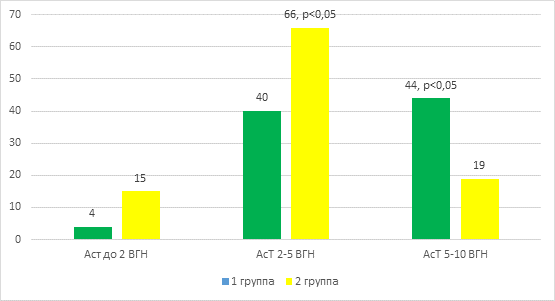
Рис. 2. Показатели АсТ (%, от верхней границы нормы)
По нашим данным, у детей, не получавших гепатопротекторы на старте химиотерапии, достоверно чаще регистрировались более высокие значения АсТ, нежели в группе сравнения.
Достоверных различий в группах по показателям коагулограммы и сывороточного альбумина на данном числе наблюдений мы не получили. Так, гипоальбуминемия была зафиксирована в 72% и 58% для 1-й и 2-й группы соответственно, и наблюдалась в основном в группе детей, имеющих повышение трансаминаз в 5-10 раз от верхней границы нормы (рис. 3). Сроки развития коагулопатии и гипоальбуминемии – от 10-14 дня; степень выраженности их изменений на данном числе наблюдений мы не изучали.
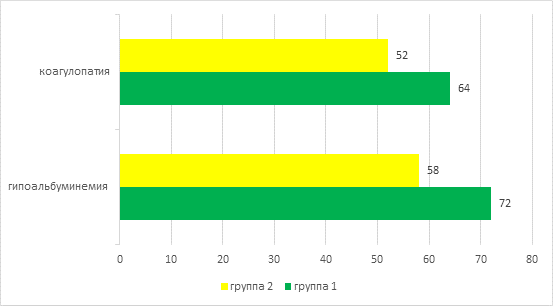
Рис. 3. Характеристика некоторых показателей белкового обмена, %
Не исключаем, что временной интервал от момента назначения до появления клинического эффекта (в данном случае биохимических изменений) имеет определенное значение. По литературным данным, время достижения максимальной концентрации цитостатиков в крови после их введения составляет от 40 мин. до 4 часов (для метотрексата и других цитостатиков). Доступность урсодезоксихолевой кислоты составляет только 60-80% от принятой дозы, но терапевтический эффект зависит от концентрации урсодезоксихолевой кислоты в желчи.
В связи с этим для реализации эффекта любого гепатопротекторного препарата, особенно в условиях агрессивной цитостатической терапии, требуется временной интервал. Таким образом, превентивное назначение гепатопротекторов в условиях ожидаемой гепатотоксичности и миелосупрессии представляется целесообразным.
Заключение
Развитие цитолитического синдрома при полихимиотерапии гемобластозов у детей является частым проявлением; степень биохимической активности отличается в зависимости от сроков назначения сопроводительной терапии.
Использование препаратов группы гепатопротекторов (урсодезоксихолевая кислота) в качестве сопроводительной терапии гемобластозов у детей целесообразно с момента старта полихимиотерапии. Данные сроки оптимальны и препятствуют развитию тяжелого цитолитического синдрома.
Библиографическая ссылка
Съемщикова Ю.П., Толмачева О.П., Козлов Ю.А., Астафьев Г.И., Ованесян С.В., Биляк Ю.С. СРОКИ НАЗНАЧЕНИЯ ГЕПАТОПРОТЕКТОРНЫХ ПРЕПАРАТОВ У ДЕТЕЙ С ГЕМОБЛАСТОЗАМИ // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32243 (дата обращения: 19.12.2025).
DOI: https://doi.org/10.17513/spno.32243



