Грыжесечения – вторая по частоте причина проводимых операций в общей хирургии. Послеоперационные вентральные грыжи (ПОВГ) получили наибольшее распространение, что можно объяснить нарушением способности брюшной стенки противодействовать внутрибрюшному давлению после оперативных вмешательств [1]. Несмотря на широкий выбор материала для пластики грыжевых дефектов, способов их лечения, возникают трудности с профилактикой рецидивов и осложнений вентральных грыж [2]. ПОВГ снижают качество жизни больных, часто рецидивируют, могут ущемляться и малигнизироваться. Встречаемость ПОВГ можно снизить внедрением герниэндопротезов с покрытием, оказывающим влияние на раневой процесс, а также на процесс метаболизма коллагена [1, 3].
Послеоперационные раны склонны к заживлению первичным натяжением, так как края раны четко сопоставлены, натяжение кожи незначительное, рана чистая. На процесс репарации влияют несколько факторов: возраст, соотношение коллагенов I–III типов, метаболизм коллагена, объем оперативного вмешательства. При установке герниоэндопротезов ранозаживление протекает последовательно через все этапы развития раневого процесса. Тем не менее реакция тканей на эндопротез как на инородное тело может спровоцировать некоторые трудности репарации, например удлинение экссудативной фазы воспаления и усиление экссудации [4].
Раннее выявление больных, склонных к вентральным грыжам, выбор адекватной пластики грыжевого дефекта, использование оптимального герниоэндопротеза позволят снизить частоту развития ПОВГ [3]. Улучшение качества эндопротезов – перспективное направление [1, 2]. Материалы, из которых изготавливают эндопротезы, различны, наиболее популярны полипропиленовые эндопротезы. Перспективно использование 3D-моделей герниоэндопротезов: можно создать индивидуальный протез по размеру, форме, гибкости, толщине, с усилением в нескольких точках фиксации [2, 5]. 3D-принтинг также позволяет наносить различные лекарственные средства на поверхность протеза, что может повлиять на метаболизм коллагена и ранозаживление [6, 7].
Существуют различные способы влияния на процесс регенерации: дренирование ран, применение гипертонических растворов, мазей, энзимотерапии, антисептиков, физических методов лечения, лазера. Идея внутреннего влияния на ранозаживление связана с нанесением на эндопротезы различных покрытий, таких как антибиотики, гормоны, альгинаты, хитозан, желатин, фибрин, коллаген и др. [8-12]. На современном этапе использование эндопротезов с покрытием, в основу которого входит вещество, оказывающее влияние на процесс коллагенообразования и ускоряющее процесс ранозаживления, является наиболее перспективным [4].
Таким образом, использование коллагенстимулирующих покрытий позволит влиять на репаративные процессы местно, снижая экссудацию, увеличивая пролиферацию и образование зрелых коллагеновых волокон [4, 13, 14].
Цель исследования: провести цитоморфологический анализ в зоне размещения синтетического полипропиленового импланта для эндопротезирования передней брюшной стенки с различными вариантами покрытия, обладающими коллагенстимулирующими свойствами.
Материалы и методы исследования
Экспериментальное исследование проводилось на лабораторных белых мышах мужского пола породы Вистар. Всего в эксперименте участвовало 180 особей. Перед экспериментом животные прошли полный карантин в условиях экспериментально-биологической клиники Курского государственного медицинского университета.
Экспериментальное исследование было выполнено в соответствии с Конвенцией Совета Европы от 1986 г. (Страсбург). Кроме того, мы придерживались всех Директив Совета 86/609/EEC от 24.11.1986 г. по согласованию правил, законов и административных распоряжений стран-участниц в отношении защиты животных, используемых в экспериментальных исследованиях.
В начале эксперимента животные были поделены на три группы, в каждой группе по 60 особей. Первой группе животных (контрольной группе) имплантировался полипропиленовый эндопротез (Эсфил, фирма «Линтекс», Россия) без нанесения коллагенстимулирующего покрытия. Животным во второй группе имплантировали эндопротез с нанесенным на него покрытием, содержащим раствор витамина С, третьей группе животных – эндопротез с покрытием, содержащим раствор препарата «Солкосерил».
Разработка состава коллагенстимулирующих покрытий и способа его нанесения на эндопротез осуществлялась сотрудниками кафедры фармацевтической технологии Курского государственного медицинского университета на основе результатов предыдущих исследований (патент РФ на изобретение № 2740132 / 12.01.2021 г. Способ нанесения коллагенстимулирующего покрытия на эндопротез). Состав покрытия включал следующие компоненты: витамин С в первом варианте покрытия и препарат «Солкосерил» во втором. В качестве загустителя использовалась метилцеллюлоза, ее объем составлял 2,0 г на 98 г препарата. Способ изготовления: в асептических условиях использовали стерильную емкость, в которой растворяли 2,0 г метилцеллюлозы, в качестве растворителя использовали 98 мл раствора для инъекций, затем раствор перемешивали до полного растворения и получения гомогенной массы. Полученный раствор помещали в холодильную камеру с температурным режимом 4оС на 24 часа. После извлечения из холодильной камеры приготовленную массу гомогенезировали, далее переливали в стерильную чашку Петри, а затем оставляли в шкафу с температурой 20оС на 2 часа для аэрации раствора. После извлечения из шкафа чашки Петри эндопротез для пластики передней брюшной стенки погружали в приготовленный раствор на 60 минут. Для того чтобы обеспечить иммобилизацию покрытия на эндопротезе, его извлекли и высушивали на воздухе в течение 5 часов при температуре 20оС. После дальнейшей стерилизации эндопротез имплантировали экспериментальным животным.
Эксперимент проводился на базе НИИ экологической медицины ФГБОУ ВО «Курский государственный медицинский университет» в условиях операционного блока. Хирургические вмешательства осуществлялись в асептических условиях. Перед вживлением эндопротеза экспериментальные особи помещали в отдельную камеру, где им выполнялась ингаляция эфиром, на момент операции наркоз поступал через «эфирную маску». Предварительно операционное поле – выбритый участок брюшной стенки – обрабатывалось 70%-ным раствором этилового спирта. Выполнялся разрез по переднебоковой поверхности кожи протяженностью 1,5 см, далее выполнялась сепарация кожи и подкожно-жировой клетчатки тупым путем с помощью зажима от нижележащих мышц брюшной стенки. В результате образовывалось пространство, в котором разместили эндопротез размером 10х5 мм, подобное расположение эндопротеза позволило смоделировать пластику «on-lay». По завершении внедрения эндопротеза операционная рана ушивалась 4 отдельными узловыми швами. Животные выводились из эксперимента на 10-е, 30-е, 60-е и 90-е сутки, такие сроки были детерминированы соответствующей этапностью раневых процессов.
Животные выводились из эксперимента посредством передозировки эфира, после чего участок брюшной стенки, содержащий кожу, мышцы и эндопротез, иссекался. Извлеченный участок 10х10 мм погружали в пробирку с 10%-ным раствором формалина. Материал крепили в парафиновые блоки, из которых в последующем делали срезы толщиной 4–5 мкм. Для определения данных о характере и количестве клеточных элементов полученные срезы окрашивали по методике гемотоксилин+эозин (Г+Э). При помощи светового микроскопа (увеличение окуляра х10, увеличение объективов х25, х40) выполняли подсчет клеточных элементов. Ограничение полей зрения обеспечивалось за счет окуляра со вставкой размером 1х1 мм. Фотографии гистологических препаратов были выполнены посредством цифровой окулярной камеры Altami 3 Mpx. Анализ каждого гистологического среза включал исследование «10 стандартных полей зрения». При оценке морфологической картины в области эндопротезирования выполняли подсчет фибробластов, лимфоцитов, макрофагов и нейтрофилов. Данный подсчет позволял установить характер воспаления и его интенсивность, что характеризовало воздействие нанесенного покрытия на процесс воспаления и регенерации. Статистический анализ включал расчет средней величины количественных показателей (M), стандартного отклонения (m), коэффициента корреляции Пирсона (r), критерия достоверности Стьюдента, критерия Манна–Уитни для двух независимых групп.
Результаты исследования и их обсуждение
Особенности клеточного состава в месте имплантации эндопротеза Эсфил без нанесения коллагенстимулирующего покрытия представлены в таблице 1.
Таблица 1
Клеточный состав в месте имплантации эндопротеза Эсфил без нанесенного коллагенстимулирующего покрытия
|
Клетки, % |
Фибробласты и фиброциты |
Макрофаги |
Лимфоциты |
Нейтрофилы |
|
Срок, суток
|
||||
|
10-е |
60,1±1,14b |
6,0±0,6b |
17,5±1,07b |
18,4±1,62 |
|
30-е |
64,2±1,1аb |
5,8±0,73 |
15,5±0,64аb |
14,5±0,75аb |
|
60-е |
69,9±1,44аb |
5,8±0,47 |
16,0±0,72b |
8,3±0,39аb |
|
90-е |
71,7±1,49b |
5,5±0,55 |
16,6±0,54b |
6,2±0,6аb |
Примечание: а – критерий достоверности р≤0,05 при сравнении c предшествующим сроком при сравнении одного и того же типа клеток в первой группе; b – критерий достоверности р≤0,05 при сравнении c аналогичным сроком одного и того же типа клеток между группами.
На 10-е сутки эксперимента отмечается значительное количество аморфного вещества соединительной ткани в области имплантации эндопротеза (рис. 1-А). При цитологическом анализе отмечается преобладание клеток фибробластического ряда, преимущественно представленных фибробластами (60,1%). Экссудативная стадия воспаления умеренно выражена (нейтрофилов 18,4%, а лимфоцитов 17,5%). Фибробласты являются основным веществом соединительной ткани, вокруг нитей эндопротеза и в стенках ячеек образуются тонкие соединительнотканные волокна. Пространство между волокнами эндопротеза постепенно заполняет образующаяся соединительная ткань.
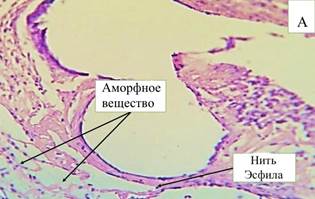
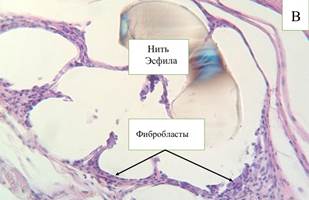
Рис. 1. Микроскопическая картина в зоне расположения эндопротеза Эсфил на 10-е сутки (А) и 30-е сутки (В). Окр. Г+Э. Световая микроскопия. х250
К 30-м суткам объем нейтрофилов и лимфоцитов достоверно (р≤0,05) снижается (14,5% и 15,5% соответственно), в то же время количество зрелых фибробластов увеличивается (64,2%). Экссудативная фаза воспаления затухает, а процессы пролиферации и заживления усиливаются в местах внедрения эндопротеза. При анализе гистологического среза в основном в стенках ячеек образуются волокна соединительной ткани и фиброциты (рис. 1-В). Также отмечаются обособленные очаги воспалительно-клеточной инфильтрации и скопления клеток инородных тел. Пространства между ячейками заполнены рыхлой соединительной тканью.
К 60-м суткам в большинстве клеточного состава вокруг нитей эндопротеза отмечаются зрелые фибробласты (69,9%), количество которых достоверно (р≤0,05) увеличивается в сравнении с предыдущими сроками эксперимента, также достоверно (р≤0,05) уменьшается количество нейтрофилов (8,3%), снижается количество гигантских клеток инородных тел (рис. 2-А). Между нитями эндопротеза располагается рыхлая соединительная ткань с большим количеством фибробластов разной степени зрелости, что показывает продолжающийся процесс заживления в месте внедрения эндопротеза. Наиболее зрелые и плотные волокна находятся во внешнем слое парапротезной капсулы.
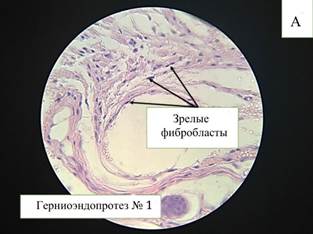
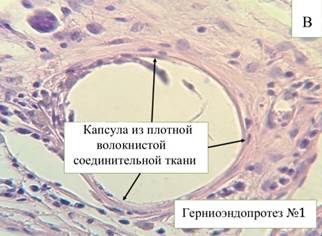
Рис. 2. Микроскопическая картина в зоне расположения эндопротеза Эсфил на 60-е сутки (А) и 90-е сутки (В). Окр. Г+Э. Световая микроскопия. х400
На 90-е сутки эксперимента клеточный состав изменился в сторону увеличения количества соединительнотканных структур и уменьшения количества воспалительных структур (рис. 2-В). Воспалительный процесс в зоне парапротезной капсулы представлен следующими клеточными элементами: нейтрофилами (6,2%), объем лимфоцитов достоверно (р≤0,05) не изменяется (16,6%), что наряду с присутствием гигантских клеток инородных тел говорит о продолжающейся реакции на внедренный эндопротез. Гистологическая картина в зоне имплантации эндопротеза 90-е сутки характеризуется наличием плотной волокнистой соединительной ткани и незначительным количеством фиброцитов, расположенных в стенках ячеек. Волокна соединительной ткани более плотные по сравнению с предыдущими сроками, некоторые из них гомогенны. В стенках парапротезных капсул отмечаются очаговые скопления фибробластов, врастающих внутрь ячеек фиброзных септ, что, в свою очередь, указывает на продолжающийся процесс формирования соединительнотканного каркаса нитей эндопротеза. Вокруг парапротезных капсул соединительная ткань более волокнистая и содержит большее количество фиброцитов, фибробластов и новообразованные сосуды.
Использование покрытия с витамином С
На 10-е сутки после операции эндопротезирования и при использовании покрытия, содержащего витамин С, обнаружены формирующиеся капсулы с ровными стенками, инфильтрированные воспалительными клеточными элементами (рис. 3-А). Фибробласты являются преобладающими клеточными элементами. В стенках капсул имеются небольшие очаговые кровоизлияния и скопления сидерофагов. По внутренней стороне стенок капсул выявляются мелкие скопления эозинофилов, единичные многоядерные макрофаги (клетки инородных тел), тучные и плазматические клетки. Некоторые капсулы не изолированы, объединены в крупные ячейки, содержащие несколько нитей эндопротеза. 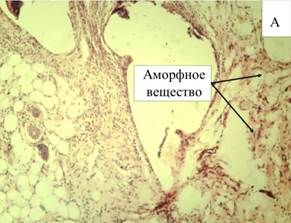
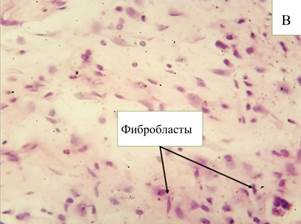
Рис. 3. Микроскопическая картина в зоне расположения эндопротеза Эсфил с покрытием «Витамин С» на 10-е сутки (А) и 30-е сутки (В). Окр. Г+Э. Световая микроскопия. Х100 (А) и х400 (В)
К 30-м суткам в данной группе стенки капсул представлены рыхлой соединительной тканью, соединительнотканные волокна местами расслоены. Воспалительный клеточный инфильтрат скудный, представлен макрофагами, единичными эозинофилами и тучными клетками. Преобладающими клеточными элементами являются фибробласты (73,25%) (рис. 3-В). Среди воспалительных клеточных элементов доля макрофагов и лимфоцитов увеличивается, а нейтрофилов снижается в 2 раза. Во внутренних слоях стенок капсул много фиброцитов, имеются единичные тучные клетки и многоядерные клетки инородных тел. К 30-м суткам в стенках капсул выявляются плотные изоморфные соединительнотканные волокна, скопления эритроцитов не обнаруживаются, на их месте остаются очаговые скопления сидерофагов.
К 60-м суткам капсулы полностью сформированы (рис. 4-А). Нити эндопротеза Эсфил отделены друг от друга фиброзными тяжами – септами между стенками капсул. Отдельные перемычки очень тонкие с небольшими участками надрывов и разрывов. В стенках капсул – изоморфная волокнистая соединительная ткань. Между капсулами располагается зрелая соединительная ткань. В клеточном составе еще в большей мере преобладают фибробласты (82,85%). Тенденция к снижению доли нейтрофилов сохраняется и достигает 4,9% (табл. 2). Очаговые мелкие скопления макрофагов, единичных лимфоцитов и нейтрофилов имеются во внутреннем слое капсул в непосредственном контакте с нитями эндопротеза. В соединительной ткани между капсулами новообразованные сосуды формируют «пакеты», отмечается гиперемия.
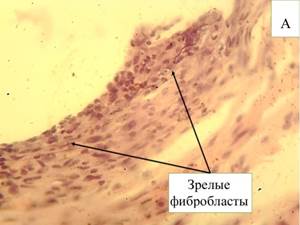
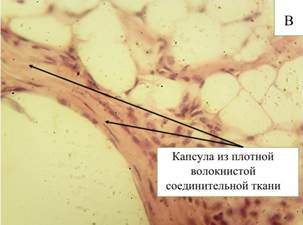
Рис. 4. Микроскопическая картина в зоне расположения эндопротеза Эсфил с покрытием «Витамин С» на 10-е сутки (А) и 30-е сутки (В). Окр. Г+Э. Световая микроскопия. х400
Таблица 2
Клеточный состав области расположения эндопротеза Эсфил с покрытием, содержащим витамин С
|
Клетки, % |
Фибробласты |
Макрофаги |
Лимфоциты |
Нейтрофилы |
|
Сутки |
||||
|
10-е |
66,89±2,34 |
7,53±0,74 |
4,45±0,61 |
21,13±2,03 |
|
30-е |
73,25±1,9аb |
10,84±0,87аb |
6,13±1,09 |
9,78±0,78ab |
|
60-е |
82,85±1,91аb |
4,66±0,74а |
7,60±1,21 |
4,89±0,92ab |
|
90-е |
86,63±1,89b |
4,51±0,81 |
6,29±0,63 |
2,57±0,44ab |
Примечание: а – критерий достоверности р≤0,05 при сравнении c предшествующим сроком при сравнении одного и того же типа клеток во второй группе; b – критерий достоверности р≤0,05 при сравнении c аналогичным сроком одного и того же типа клеток между группами.
К 90-м суткам стенки капсул толстые, представлены плотной изоморфной волокнистой соединительной тканью (рис. 4-В). Клеточный состав представлен в основном фибробластами (86,63%), воспалительные клеточные элементы малочисленные, доля макрофагов и лимфоцитов несколько увеличилась, в то время как нейтрофилов снизилась вдвое – до 2,57% (табл. 2).
Использование покрытия с Солкосерилом
На 10-е сутки после эндопротезирования при использовании покрытия, содержащего препарат «Солкосерил», обнаружены формирующиеся капсулы с ровными стенками, инфильтрированные воспалительными клеточными элементами. Стенки капсул вокруг нитей эндопротеза представлены богатой клетками незрелой соединительной тканью. Формирующиеся соединительнотканные волокна тонкие, имеются очаги расслоения волокон. Вокруг капсул рыхлая соединительная ткань богата клетками и сосудами. На внутренней поверхности капсул располагаются воспалительно-клеточные инфильтраты, в которых половина клеточного состава представлена нейтрофилами (15,98%), их доля достоверно (р≤0,05) ниже, чем в группе, где покрытие не наносилось (табл. 3). Доля макрофагов выше (8,17%), чем лимфоцитов (5,71%). В то же время количество фибробластов достоверно (р≤0,05) выше (71,14%) в сравнении с показателями в группе без использования покрытия (60,1%). Кроме этого, определяются тучные клетки. Стенки капсул рыхло связаны с окружающими тканями, имеются участки отслоения. Внутри капсул не все нити эндопротеза отделены соединительнотканными тяжами, располагаются в виде «пакетов» в больших полостях (рис. 5-А). Однако уже на этом сроке исследования имеются капсулы, полностью разделяющие отдельные нити эндопротеза.
Таблица 3
Клеточный состав области расположения эндопротеза Эсфил с покрытием, содержащим Солкосерил
|
Клетки, % |
Фибробласты и фиброциты |
Макрофаги |
Лимфоциты |
Нейтрофилы |
|
Срок |
||||
|
10-е |
71,14±2,97 |
8,17±0,94 |
5,71±0,78 |
15,98±1,13 |
|
30-е |
79,98±2,54аb |
5,88±0,87аb |
8,52±1,27а |
5,61±0,53аb |
|
60-е |
87,99±1,79аb |
3,36±0,61а |
6,09±1,18 |
2,56±0,87аb |
|
90-е |
92,68±2,31аb |
2,14±0,65b |
4,01±0,76аb |
1,16±0,57b |
Примечание: а – критерий достоверности р≤0,05 при сравнении c предшествующим сроком при сравнении одного и того же типа клеток в третьей группе. b – критерий достоверности р≤0,05 при сравнении c аналогичным сроком одного и того же типа клеток между группами.
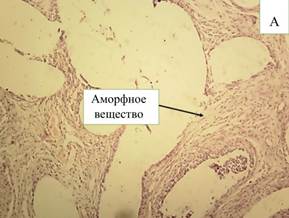
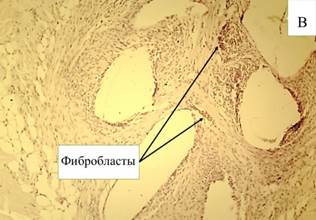
Рис. 5. Микроскопическая картина в зоне расположения эндопротеза Эсфил с покрытием «Солкосерил» на 10-е сутки (А) и 30-е сутки (В). Окр. Г+Э. Световая микроскопия. х100
К 30-м суткам стенки капсул утолщаются, представлены соединительнотканными волокнами, клеточный инфильтрат скудный. Доля нейтрофилов снижается по сравнению с 10-ми сутками до 3 раз (5,61%), соотношение лимфоцитов и макрофагов меняется в сторону преобладания лимфоцитов (8,52%). Вдоль внутреннего слоя стенок капсул выявляются многоядерные макрофаги и тучные клетки. Все нити эндопротеза располагаются в капсулах (рис. 5-Б), окружены разделены фиброзными септами, однако имеются очаговые разрывы. Стенки капсул по-прежнему рыхло связаны с окружающими тканями, имеются небольшие участки их отслоения. Рыхлая соединительная ткань между капсулами богата клетками и сосудами.
К 60-м суткам появляются единичные капсулы с очень толстыми и плотными стенками, состоящими из изоморфных соединительнотканных волокон, плотно облегающих нити эндопротеза. Капсулы связаны между собой плотными тяжами волокнистой соединительной ткани. Вся конструкция из соединительнотканного каркаса плотно сращена с окружающими тканями. Однако по-прежнему сохраняются участки рыхлой соединительной ткани, богатой клетками и сосудами, между капсулами и в стенках отдельных капсул, капсулы с тонкими стенками, неплотно охватывающими нити эндопротеза, а также мелкие участки разрыва фиброзных септ, разделяющих нити, что подтверждает продолжающийся процесс организации в области протеза. В стенках капсул выявляются мелкие скопления лимфоцитов, макрофагов, а также единичные нейтрофилы (рис. 6-А). На их внутренней стороне встречаются гигантские клетки инородных тел и тучные клетки. В клеточном составе сохраняется тенденция к снижению количества нейтрофилов в 2 раза (2,56%), также снижается доля макрофагов и лимфоцитов, что отражает снижение выраженности воспалительной реакции (табл. 3).
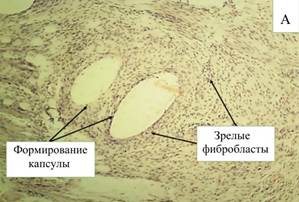
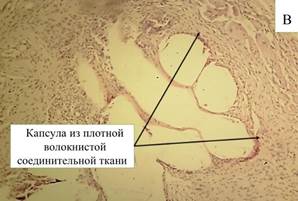
Рис. 6. Микроскопическая картина в зоне расположения эндопротеза Эсфил с покрытием «Солкосерил» на 60-е сутки (А) и 90-е сутки (В). Окр. Г+Э. Световая микроскопия. Х100 (А) и х200 (В)
К 90-м суткам толстые изоморфные соединительнотканные волокна плотно охватывают все нити эндопротеза (рис. 6-В). Внутри капсул с толстыми фиброзными стенками все нити отделены плотными фиброзными тяжами. По внутренней стороне стенок капсул преобладают фиброциты с узкими вытянутыми ядрами, кнаружи от них обнаруживаются множественные фибробласты с овальными объемными ядрами. Имеются лишь единичные участки рыхлой новообразованной соединительной ткани, богатой клетками и сосудами. В клеточном составе превалируют фибробласты (92,68%). Количество нейтрофилов снижается до 1,16%. Это подтверждает отсутствие острых воспалительных процессов и максимальный уровень репаративных процессов.
Заключение
При цитологическом и гистологическом анализе в области имплантации эндопротеза Эсфил без использования покрытия отмечалось последовательное уменьшение экссудативной фазы воспалительной реакции. Это проявлялось прежде всего значительным снижением числа нейтрофилов в области имплантации – с 18,4% на 10-е сутки до 6,2% к 90-м суткам. Помимо этого, отмечалось увеличение клеток фибробластического ряда на 11,6%. Однако достоверного (р≤0,05) уменьшения количества лимфоцитов и макрофагов на протяжении всех сроков эксперимента установлено не было.
Цитологический анализ в группах с нанесенным коллагенстимулирующим покрытием характеризовался достоверным (р≤0,05) уменьшением количества нейтрофилов уже к 30-м суткам эксперимента при сравнении с группой без использования покрытия. В группе с использованием покрытия «Солкосерил» при сравнении с группой с покрытием, содержащим витамин С, достоверно (р≤0,05) снижалось количество лейкоцитов на всех сроках эксперимента, что свидетельствовало о более быстром протекании экссудативной фазы воспаления.
В группе, где использовалось покрытие, содержащее «Солкосерил», отмечена достоверно (р≤0,05) менее интенсивная воспалительная реакция на всех сроках эксперимента. В этой группе зафиксировано стойкое возрастание числа фибробластов на всех сроках исследования (р≤0,05): на 10-е сутки количество фибробластов было на 15,5% больше в той группе, где не наносилось покрытие, и на 6% – в группе, где использовалось покрытие с витамином С. К 90-м суткам данная зависимость сохранялась, так, количество клеток фибробластического ряда в группе без покрытия было меньше на 22,64%, а в группе с витамином С было меньше на 6,53%. Эти изменения свидетельствуют о значительной биологической инертности эндопротеза с препаратом «Солкосерил», его лучшем противовоспалительном и коллагенстимулирующем эффекте.
Таким образом, во время экспериментального исследования по моделированию пластики on-lay у экспериментальных животных эндопротезами с различными вариантами коллагенстимулирующего покрытия и без него было установлено более быстрое протекание стадий воспалительного процесса в группах, где использовались коллагенстимулирующие покрытия. Помимо этого, в группах с нанесенным покрытием отмечено достоверное (р≤0,05) увеличение скорости пролиферации клеток фибробластического ряда с формированием плотной соединительной капсулы вокруг нитей эндопротеза, в то время как парапротезная капсула у животных контрольной группы представлена рыхлыми соединительнотканными волокнами. Данные изменения свидетельствуют о более высокой прочности парапротезной капсулы в группах, где использовалось покрытие, и, соответственно, о лучшей адаптации эндопротеза в тканях живого организма.
Библиографическая ссылка
Лазаренко В.А., Иванов И.С., Объедков Е.Г., Горяинова Г.Н., Панкрушева Т.А., Бобровская Е.А., Чекмарева М.С., Квачахия Л.Л., Иванова И.А., Костин В.С., Слав А.Ф. ОЦЕНКА ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ И ПРОЛИФЕРАЦИИ КЛЕТОК ФИБРОБЛАСТИЧЕСКОГО РЯДА В ОБЛАСТИ ИМПЛАНТАЦИИ ПОЛИПРОПИЛЕНОВОГО ЭНДОПРОТЕЗА В ЗАВИСИМОСТИ ОТ НАНЕСЕНИЯ КОЛЛАГЕНОСТИМУЛИРУЮЩЕГО ПОКРЫТИЯ (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ) // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32227 (дата обращения: 15.02.2026).
DOI: https://doi.org/10.17513/spno.32227



