Основную долю злокачественных новообразований полости рта занимают опухоли языка [1], которые сохраняют лидирующие позиции в общей структуре заболеваемости и смертности среди злокачественных опухолей головы и шеи (более 135000 летальных случаев в 2021 году) [2]. Рак языка имеет клинически непредсказуемый прогноз, учитывая повышенную частоту скрытых метастазов у пациентов с небольшими первичными опухолями и отсутствием клинических признаков метастатического заболевания [3].
Гистопатологически наиболее частым вариантом является обычный тип плоскоклеточного рака языка (частота 54%) без казуистики. Вторым по частоте встречающимся гистопатологическим подтипом является акантолитический, диагностируется у 26% больных. Базалоидный подтип диагностируется в 13% случаев [4].
Выявление новых прогностических факторов является актуальным направлением исследований. Развитие и прогрессирование предраковых заболеваний языка обусловлено не только необратимыми изменениями в последовательности ДНК, но также и изменениями в экспрессии генов [5-8]. К таким факторам относят транскриптомные характеристики опухолей, определяющие особенности патогенеза в каждом конкретном гистологическом подтипе [9].
Поэтому целью исследования стало изучение особенностей транскрипционной активности генов в различных гистологических подтипах плоскоклеточного рака языка с применением биоинформационных и молекулярных подходов.
Материалы и методы исследования
Работа выполнена в ФГБУ «НМИЦ онкологии» Минздрава России в 2019-2022 гг. В работе использовали биологический материал 300 пациентов с местнораспространенными злокачественными опухолями языка.
Для этого этапа исследования использовали интерактивный веб-сервер анализа данных по экспрессии мРНК 9736 опухолей и 8587 нормальных образцов из проектов TCGA и GTEx с применением стандартного конвейера обработки (GEPIA) [10].
Тотальную РНК выделяли и очищали с помощью набора RNeasy Plus Universal Kits (QIAGEN) согласно протоколу производителя. Препараты РНК обрабатывали ДНКазой I для устранения следов геномной ДНК [11]. Для наработки кДНК готовили реакционный микс, содержащий рандомные праймеры, RT-буфер, dNTP, ингибитор РНКаз и ММLV-ревертазу. Проводили инкубацию при 44°С в течение 1 часа, далее обратную транскриптазу инактивировали нагреванием при 92°С в течение 10 минут. Полученные препараты использовали для количественной ПЦР в режиме реального времени (RT-qPCR) [11].
Методом RT-qPCR определяли величины относительной экспрессии генов, выявленных на этапе биоинформационного анализа. При выборе референсного гена использовали алгоритм, описанный в работе [12]. В качестве референсных выбрали 2 гена: GAPDH и ACTB. ПЦР в реальном времени (в 3 технических повторах для каждого образца) проводили на термоциклере Bio-Rad CFX96 (Bio-Rad, США) по следующей программе: первичная денатурация при 94ºС в течение 2 мин.; 35 циклов: 10 с при 94ºС, 30 с при 56ºС, 30 с при 70ºС. Относительную экспрессию (RЕ) рассчитывали по формуле RЕ = Е-ΔΔCt, где Е ‒ эффективность амплификации, равная 10-1/k , где k ‒ коэффициент из уравнения прямой C(T) = k∙lgP0 + b, полученного путем линейной аппроксимации экспериментальных данных [13].
Статистическую обработку результатов выполняли с помощью программы Statistica 10.0. Для проведения кластерного анализа (Hierarchical Clustering, Euclidean distance) использовали скрипты на языке R. Нормальность распределения показателей оценивали с помощью критерия Колмогорова-Смирнова. Оценку различий проводили с использованием критерия Манна-Уитни для порогового уровня статистической значимости р<0,05, для учета множественного сравнения использовали поправку Бонферрони [14].
Результаты исследования и их обсуждение
Проведенный биоинформационный анализ с использованием GEPIA [10] выделил 1488 генов, увеличивающих экспрессию, и 589 генов, снижающих экспрессию при плоскоклеточном раке языка. Из этих 2077 генов было выбрано 10 генетических локусов, наиболее сильно увеличивающих экспрессию, и 13 генетических локусов, наиболее сильно снижающих экспрессию в опухолевой ткани относительно нормальной ткани языка (табл.).
Генетические локусы с наибольшими отклонениями транскрипционной активности от нормы
|
Символ гена |
Кратность отличий |
Символ гена |
Кратность отличий |
|
Гиперэкспрессированные гены |
Гипоэкспрессированные гены |
||
|
MMP1 |
6.2 |
KRT13 |
-6.4 |
|
MMP11 |
4.4 |
SPRR3 |
-5.6 |
|
CA9 |
4.3 |
KRT4 |
-9.1 |
|
PTHLH |
4.1 |
ANXA1 |
-2.2 |
|
MMP9 |
4.0 |
MT-ND6 |
-1.2 |
|
COL1A1 |
4.0 |
CNFN |
-2.8 |
|
LAMC2 |
3.8 |
SLPI |
-1.1 |
|
ISG15 |
3.8 |
CRNN |
-8.8 |
|
MMP3 |
3.8 |
MAL |
-7.5 |
|
SPP1 |
3.7 |
TGM3 |
-6.8 |
|
|
IL1RN |
-2.2 |
|
|
|
CLU |
-2.5 |
|
|
|
CD24 |
-1.5 |
|
Выявленные в ходе биоинформационного анализа аномальные показатели транскрипционной активности генетических локусов были валидированы на тканях 300 больных плоскоклеточным раком языка методом RT-qPCR.
Из 23 генетических локусов, выявленных в ходе биоинформационного анализа, только 14 изменяли свой транскрипционный профиль в опухолевой ткани относительно нормальной (рис. 1). Так, было обнаружено статистически значимое (p<0,005) увеличение экспрессии генов MMP-1, MMP-11, CA-9, PTHLH, MMP-9, LAMC-2 и MMP-3 в 4,8 раза, 2,4, 2,1, 4,0, 2,1, 2,0 и 3,5 раза соответственно в опухолевой ткани относительно нормальной языка. Также было выявлено статистически значимое (p<0,005) снижение экспрессии генов ANXA-1, MT-ND6, CRNN, MAL, TGM-3, IL1RN и CLU в 2,2 раза, 1,3, 5,2, 7,5, 2,2, 2,3 и 2,6 раза соответственно в опухолевой ткани относительно нормальной языка (рис. 1).
При анализе данных ПЦР была выявлена гетерогенность данных в ряду исследованных биологических образцов. Был проведен кластерный анализ, который позволил разделить общую выборку из 300 пациентов на 3 группы, отличающиеся по экспрессии генов: кластер 1 (n=90), кластер 2 (n=101) и кластер 3 (n=109).
У пациентов кластера 1 в опухолевой ткани языка была повышена транскрипция MMP-1, CA-9, PTHLH и ISG-15 в 2,2 раза (p<0,005), 2,1 раза (p<0,001), 8,8 раза (p<0,001) и 6,9 раза (p<0,05) соответственно, и снижена транскрипция ANXA-1, MT-ND6 и MAL в 6,5 раза (p<0,005), 5,9 раза (p<0,001) и 9,8 раза (p<0,005) соответственно относительно нормальной ткани (рис. 2).
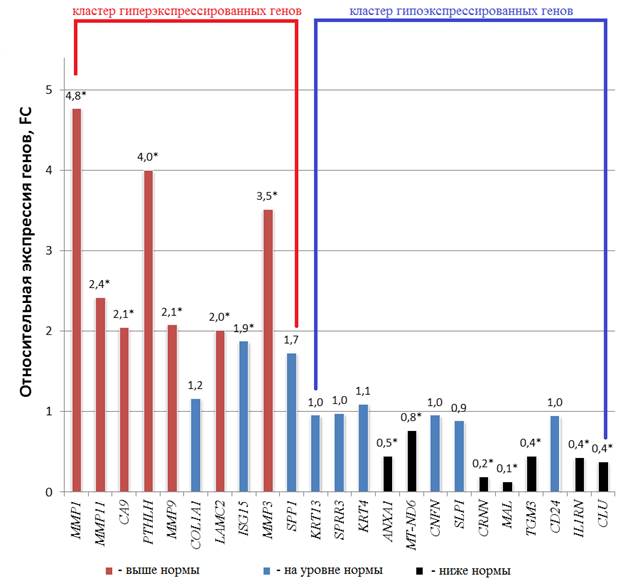
Рис. 1. Относительная экспрессия 23 генов в опухолевой ткани больных плоскоклеточным раком языка. * - статистически значимые отличия от нормальной ткани языка (p<0,005)
У пациентов кластера 2 в опухолевой ткани языка была повышена транскрипция MMP-1, MMP-11, CA-9, PTHLH, MMP-9, COL1-A1, LAMC-2, MMP-3 и SPP-1 в 4,8 раза (p<0,05), 2,4 раза (p<0,001), 2,4 раза (p<0,01), 4,0 раза (p<0,05), 2,1 раза (p<0,005), 3,2 раза (p<0,005), 3,5 раза (p<0,001) и 2,7 раза (p<0,05) соответственно, и снижена транскрипция KRT-13, SPRR-3, KRT-4, ANXA-1, MT-ND6, CNFN, CRNN, MAL, TGM-3, IL1RN и CLU в 6,4 раза (p<0,005), 5,6 раза (p<0,001), 9,2 раза (p<0,005), 1,3 раза (p<0,05), 2,9 раза (p<0,05), 8,9 раза (p<0,005), 7,6 раза (p<0,005), 6,8 раза (p<0,05), 2,3 раза (p<0,05) и 2,6 раза (p<0,01) соответственно относительно нормальной ткани (рис. 2).
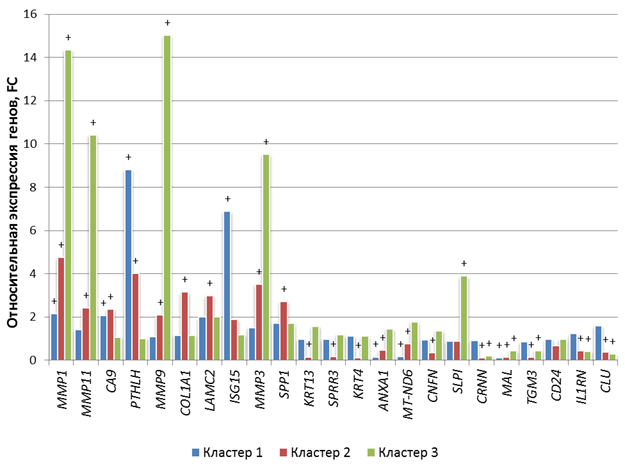
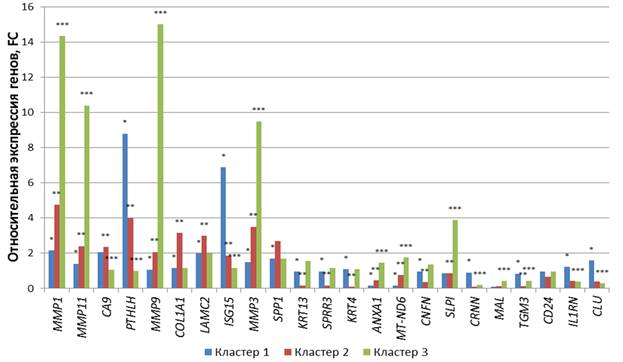
Рис. 2. Транскрипция 23 генетических локусов в операционном материале в разных группах (кластерах) больных плоскоклеточным раком языка. + - статистически значимые отличия относительно нормальной ткани (p<0,0005); * - статистически значимые отличия относительно кластера 2 (p<0,001); ** - статистически значимые отличия относительно кластера 3 (p<0,001); *** - статистически значимые отличия относительно кластера 1 (p<0,005)
У пациентов кластера 3 в опухолевой ткани языка была обнаружена повышенная транскрипция генов MMP-1, MMP-11, MMP-9, MMP-3 и SLPI в 14,4 раза (p<0,005), 10,4 раза (p<0,001), 15,0 раза (p<0,001), 9,5 раза (p<0,005) и 3,9 раза (p<0,05) соответственно, и снижена транскрипция генов CRNN, MAL, TGM-3, IL1RN и CLU в 5,2 раза (p<0,05), 2,3 раза (p<0,01), 2,2 раза (p<0,05), 2,5 раза (p<0,05) и 3,5 раза (p<0,01) соответственно относительно нормальной ткани (рис. 2).
Между кластерами выявлено наличие дифференциальной экспрессии рассматриваемых генетических локусов. Так, в кластерах 1 и 2 статистически значимо (p<0,001) отличается экспрессия MMP-1, MMP-11, PTHLH, MMP-9 и COL1-A1 в 2,2, 1,7, 2,2, 1,9 и 2,7 раза соответственно, а также экспрессия LAMC-2, ISG-15, MMP-3, SPP1, KRT-13 и SPRR-3 в 1,5, 3,7, 2,3, 1,6, 6,1 и 5,5 раза соответственно и генов KR-T4, ANX-A1, MT-ND6, CNFN, CRNN, MAL, TGM-3, IL1RN и CLU в 10,2, 3,0 4,5, 2,7, 8,1, 5,8, 2,8 и 4,1 раза соответственно. Между кластерами 2 и 3 статистически значимо (p<0,001) отличается экспрессия генов MMP-1, MMP-11, CA-9, PTHLH, MMP-9, COL1-A1, LAMC-2, ISG-15, MMP-3, KRT-13, SPRR-3, KRT-4, ANXA-1, MT-ND6, CNFN, SLPI и TGM3 в 3,0, 4,3, 2,2, 4,0, 7,2, 2,7, 1,5, 1,6, 2,7, 10,0, 6,6, 10,2, 3,2, 2,3, 3,9, 4,4 и 3,0 раза соответственно.
Между кластерами 1 и 3 статистически значимо (p<0,001) отличается экспрессия генов MMP-1, MMP-11, CA-9, PTHLH, MMP-9, ISG-15, MMP-3, ANX-A1, MT-ND6, SLPI, CRNN, MAL, TGM-3, IL1RN и CLU в 6,7, 7,4, 1,9, 8,7, 13,9, 5,8, 6,3, 9,5, 10,4, 4,4, 4,7, 4,2, 1,9, 3,0 и 5,6 раза соответственно.
Выявленная при валидации данных биоинформационного анализа дифференциальная экспрессия 14 генов в опухолевой и нормальной ткани языка (MMP-1, MMP-11, CA-9, PTHLH, MMP-9, LAMC-2, MMP-3, ANX-A1, MT-ND6, CRNN, MAL, TGM-3, IL1RN и CLU) приводит к изменению ключевых сигнальных каскадов, ответственных за развитие кожи, дифференцировку клеток эпидермиса, метаболизм коллагена, чувствительность к УФ и активность металлопептидаз. Развитие рака языка представляет собой сложный многоэтапный процесс, в ходе которого генетические события в путях передачи сигналов, управляющих нормальной клеточной физиологией, изменяются количественно или качественно. В нормальных тканях языка клетки эпителия жестко контролируются различными сигнальными путями, регулирующими деление, дифференцировку и старение клеток. Сигнальные пути кератиноцитов могут быть разнообразными и одновременно содержать одни и те же ключевые функциональные элементы [15].
Стремительное развитие технологии полногеномного секвенирования и баз данных TCGA и GEO позволило создать мощные ресурсы для выявления биомаркеров ранней диагностики, стратификации пациентов, а также мишеней для персонализированной терапии [16]. Так, в работе Zhang H. и коллег [17] был проведен биоинформационный анализ базы данных GEO и выявлено 1752 дифференциально экспрессирующихся гена, из которых 1050 было гиперэкспрессировано и 702 гипоэкспрессировано. Эти гены в основном были задействованы в регуляции клеточной пролиферации, адгезии и апоптоза. Результаты нашего биоинформационного анализа с использованием GEPIA несколько отличаются от данных Zhang H. и соавторов [17]. Нами выявлено 2077 дифференциально экспрессирующихся генов, из которых 1488 генов, увеличивающих экспрессию, и 589 генов, снижающих экспрессию при плоскоклеточном раке языка относительно нормальной ткани.
К тому же в нашем исследовании выявлены 3 транскрипционных кластера в образцах рака языка. Проведенный гистологический анализ позволил сопоставить эти кластеры и гистологические подтипы плоскоклеточного рака языка. Так, кластер 1 соответствовал базалоидному подтипу рака языка и характеризовался повышенной экспрессией генов MMP-1, CA-9, PTHLH и ISG-15 и сниженной экспрессией генов ANX-A1, MT-ND6 и MAL относительно нормальной ткани. Кластер 2 соответствовал акантолитическому подтипу рака языка и характеризовался повышенной экспрессией генов MMP-1, MMP-11, CA-9, PTHLH, MMP-9, COL1-A1, LAMC-2, MMP-3 и SPP-1 и сниженной экспрессией генов KRT-13, SPRR-3, KRT-4, ANX-A1, MT-ND6, CNFN, CRNN, MAL, TGM-3, IL1RN и CLU относительно нормальной ткани. Часть выявленных дифференциально экспрессирующихся генов в кластере 2 совпадала с таковыми в кластере 1: MMP-1, CA-9, PTHLH (гиперэкспрессия) и ANX-A1, MT-ND6, MAL (гипоэкспрессия). Отличия в перечне дифференциально экспрессирующихся генов (MMP-11, MMP-9, COL1-A1, LAMC-2, ISG-15, MMP-3, SPP-1, KRT-13, SPRR-3 и других) в двух группах пациентов, очевидно, обеспечивают различия в гистологии и течении акантолитического и базалоидного подтипа рака языка. Кластер 3 соответствовал обычному типу плоскоклеточного рака языка и характеризовался повышенной экспрессией генов MMP-1, MMP-11, MMP-9, MMP-3, SLPI и сниженной экспрессией генов CRNN, MAL, TGM3, IL1RN и CLU. По количеству дифференциально экспрессирующихся генов этот подтип (10 генов) занимает промежуточное место между базалоидным подтипом (7 генов) и акантолитическим подтипом (20 генов). При этом направления изменения экспрессии 2 генетических локусов (MMP-1, MAL) совпадают во всех 3 группах.
Заключение
Таким образом, проведенное исследование позволило установить как общие для всех подтипов плоскоклеточного языка паттерны экспрессии генов (MMP-1, MMP-11, CA-9, PTHLH, MMP-9, LAMC-2, MMP-3, ANX-A1, MT-ND6, CRNN, MAL, TGM-3, IL1RN), так и уникальные транскрипционные особенности каждого гистологического подтипа. Данные особенности могут обеспечивать различное клиническое течение и ответ на терапию этих заболеваний.
Библиографическая ссылка
Данилова А.Э., Максимов А.Ю., Снежко А.В., Енгибарян М.А. ПРОФИЛЬ ЭКСПРЕССИИ ГЕНОВ В РАЗЛИЧНЫХ ГИСТОЛОГИЧЕСКИХ ПОДТИПАХ ПЛОСКОКЛЕТОЧНОГО РАКА ЯЗЫКА // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32218 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.32218



