Назначение нестероидных противовоспалительных препаратов (НПВП) длительным курсом достаточно часто сопровождается побочными реакциями в органах пищеварительной системы. Тем не менее НПВП, как традиционные, так и селективные ингибиторы фермента циклооксигеназы-2 (ЦОГ-2), до настоящего времени являются главными средствами выбора при лечении воспаления и боли [1], в том числе у животных. Животным НПВП назначают при травмах, сопровождающихся болевым синдромом, болезнях костной и мышечной систем, после оперативного вмешательства [2].
По имеющейся статистике, препараты, в состав которых включен карпрофен, назначаются животным чаще по сравнению с другими аналогами [2]. Карпрофен является селективным НПВП – влияет преимущественно на ЦОГ-2, которая индуцируется в ответ на развитие воспаления [3]. По данным авторов, этот препарат чаще всего вызывает побочные эффекты. При использовании карпрофена в терапевтических дозировках формирование нежелательных реакций у животных наблюдается в 17,7% случаев, в том числе – развитие токсического гепатита [2]. Чаще всего гепатопатия развивается в первые три недели приема препаратов, продолжение приема может привести к прогрессированию поражения печени [4].
В современных научных источниках содержится мало информации о том, что НПВП могут провоцировать патологические изменения поджелудочной железы и быть причиной острого панкреатита [5]. Эта проблема представляет бесспорный интерес, так как препараты данной группы назначают как средство для снятия боли при панкреатите.
По настоящее время механизм развития панкреатопатии, вызванной применением НПВП, до конца не изучен. Работы, посвященные изучению патогенеза панкреатитов, обнаруживают, что развитие воспаления происходит при участии цитокинов. Под влиянием различных факторов в панкреацитах активируются ферменты, приводящие к высвобождению провоспалительных цитокинов (в том числе фактора некроза опухоли, TNFα), а затем формируется местная воспалительная реакция [6, 7].
Первоначально TNFα был описан как фактор, который может вызывать некроз опухолей, в дальнейшем он предопределяется как основной регулятор воспалительной реакции. Многочисленные исследования, направленные на изучение биологических функций TNFα, установили, что данный цитокин играет основную роль в иммунопатогенезе многих заболеваний [8, 9]. Несмотря на сведения, накопленные в области изучения различных функций TNFα, исследования этого цитокина являются актуальными.
Цель исследований. В условиях эксперимента с использованием иммуногистохимических методов исследовать роль фактора некроза опухоли альфа (TNFα) в развитии панкреатопатии, модель которой была получена в результате длительного применения карпрофена лабораторным крысам.
Материалы и методы исследования. Для моделирования патологии поджелудочной железы использовали препарат ветеринарного назначения «Римадил Р» (некоммерческое название – карпрофен) производства «Pfizer Animal Health» (США) курсом 21 день. Опытные группы формировали из взрослых нелинейных (гетерозиготных) белых крыс. Для изучения полной картины патогенеза экспериментальным животным вводили разные дозировки препарата – терапевтическую и дозы, превышающие ее в два, пять и десять раз. Представлена схема эксперимента (рис. 1).
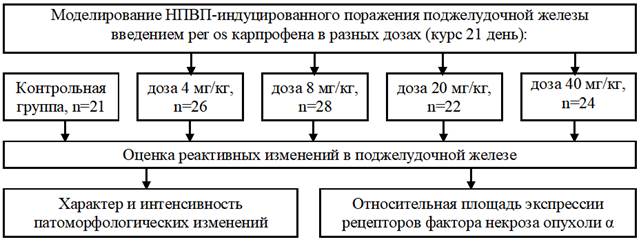
Рис. 1. Схема эксперимента
Эвтаназию экспериментальных животных проводили на 22-й день опыта путем перерезки спинного мозга с применением эфирного наркоза. После эвтаназии для гистологических исследований отбирали кусочки поджелудочной железы, которые фиксировали в 10%-ном забуференном растворе формалина (pH 7,2), затем обезвоживали и обезжиривали в соответствии со стандартными гистологическими методиками, после чего осуществляли их заливку в парафин (HISTOMIX®). Для оценки патоморфологических изменений паренхимы органа использовали метод окрашивания депарафинированных срезов гематоксилином и эозином.
Проведение иммуногистохимических исследований. Участие TNFα в развитии панкреатопатии изучали по проявлению экспрессии рецепторов цитокина – TNFαR1, локализующихся на клеточной мембране. Применяли непрямой иммуногистохимический метод. Для выявления рецепторов использовали антитела TNFR1 (poly) RabbitAnti-TNF Receptor I PolyclonalAntibody (Bioss) производства компании «Santa Cruz Biotechnology» (США). Для обнаружения антител применяли системы детекции UnoVue detection system.
Гистологические препараты изготавливали на стеклах с адгезивным покрытием Menzel (Германия). Гистологические срезы получали из ранее исследованных фрагментов поджелудочной железы, в которых находили характерные патоморфологические нарушения. Для восстановления антигенных детерминант после формалиновой фиксации тканей железы использовали способ теплового демаскирования антигенов. После экспозиции с антителами гистологические срезы окрашивали DAB (3,3'-диаминобензидином) и докрашивали гематоксилином Майера.
Экспрессию рецепторов на мембране клеток выявляли по коричневой окраске при просмотре препаратов. При изучении гистологических препаратов выявили, что антигенпозитивные окрашенные клетки распределялись только в эндокринной части поджелудочной железы, при этом экспрессия TNFαR1 имела локализованный характер (преимущественно по краям эндокринных островков). По этой причине для количественной оценки экспрессии определяли относительную площадь (в процентах), которую занимали окрашенные клетки, по отношению к площади островка. Для измерения площади экспрессии рецепторов использовали программное обеспечение «измерение произвольной площади» (программа ImageJ, Bio Vision 4.0, Австрия) (рис. 2).
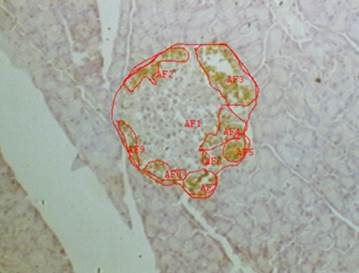
Рис. 2. Измерение произвольной площади экспрессии рецепторов (программное обеспечение Bio Vision), х 150
Для фотосъемки использовали светооптический микроскоп Micros и программу ScopePhoto (CamV 200, Австрия). Для статистической обработки результатов исследования применяли критерий Стьюдента.
Эксперименты проводили в соответствии с «Правилами лабораторной практики в Российской Федерации» (приказ Министерства здравоохранения РФ №708н от 23 августа 2010 г.) и «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18 марта 1986 г.
Результаты исследования и их обсуждение. Гистологические исследования. В соответствии с целью исследования, вначале изучали характер и интенсивность патоморфологических изменений паренхимы поджелудочной железы у животных опытных групп. В результате обнаружили, что длительное применение карпрофена приводит к развитию повреждений в тканях железы, характерных для токсического поражения. В экзокринной части железы наблюдали патоморфологические изменения, такие как отеки межацинарной и междольковой соединительной ткани, белковая и жировая дистрофия, некрозы, появление двуядерных клеток. Нарушения выявляли у животных всех четырех опытных групп, получавших различные дозировки карпрофена (в том числе терапевтическую дозу). Выявили, что при повышении дозы препарата степень нарушений возрастала, таким образом, мы наблюдали дозозависимый эффект. Со стороны эндокринных островков видимых нарушений морфологической структуры при просмотре препаратов не выявлялось [10].
Иммуногистохимические исследования. Изучение гистологических препаратов показало, что проявления экспрессии рецепторов TNFαR1 в эндокринных островках поджелудочной железы наблюдались у животных всех экспериментальных групп, в том числе у интактных (контроль). При этом у животных контрольной группы относительная площадь экспрессии TNFαR1 составляла 8,49±2,23%. Обнаружение экспрессии TNFαR1 у интактных животных можно объяснить тем, что TNFα рассматривается не только как медиатор воспалительных процессов при различных заболеваниях, но и как цитокин, играющий важную роль в регуляции физиологической дифференцировки, роста и метаболизма различных клеток [8]. Научная информация о действии TNFα в эндокринной части поджелудочной железы крайне немногочисленна. Например, имеется предположение, что в границах физиологической нормы инсулин образуется путем активации ядерного фактора NF-kB (NF-kB контролирует различные клеточные реакции, в том числе экспрессию генов апоптоза). Активация ядерного фактора NF-kB выполняется через рецепторы TNFα [11].
Представлены результаты измерения относительной площади экспрессии TNFαR1 у животных опытных групп, которым применяли карпрофен в разных дозах, по сравнению с группой контроля (рис. 3).
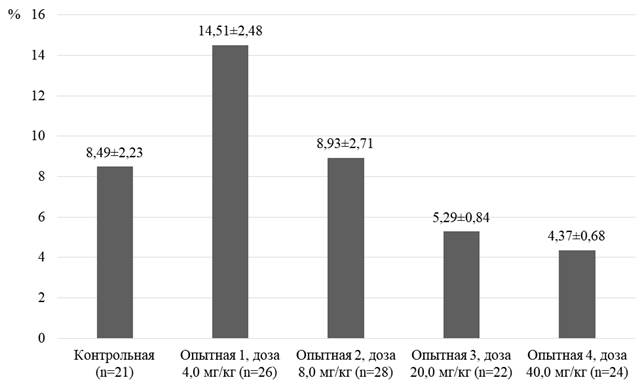
Рис. 3. Относительная площадь экспрессии TNFαR1 (в % от площади островка). Примечания: р – по отношению к результатам контрольной группы: опытная 1 – р=0,084; опытная 2 – р=0,905; опытная 3 – р=0,179; опытная 4 – р=0,069
Оценка размеров экспрессии рецепторов выявила определенную зависимость от дозировки препарата. Из полученных результатов видно, что максимальная площадь экспрессии – 14,51±2,48% – наблюдалась у крыс, получавших 4,0 мг/кг карпрофена, то есть минимальную дозу. В опытных группах, получавших высокие дозы препарата (20,0 и 40 мг/кг), относительная площадь экспрессии была меньше, чем в контроле.
Приведены примеры проявления экспрессии TNFαR1 у животных, получавших терапевтическую (рис. 4) и пятикратную (рис. 5) дозировки карпрофена.
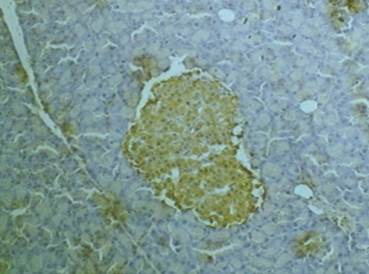
Рис. 4. Экспрессия TNFαR1 в эндокринных островках (поджелудочная железа). Крыса, опытная группа (карпрофен в дозе 4,0 мг/кг, в течение 21 дня). Окраска 3,3'-диаминобензидином и гематоксилином Майера. Увеличение х150
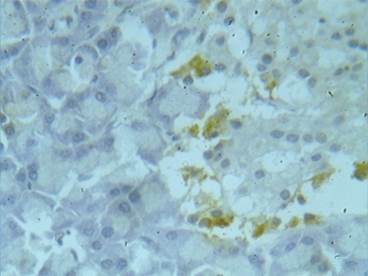
Рис. 5. Экспрессия TNFαR1 в эндокринных островках (поджелудочная железа). Крыса, опытная группа (карпрофен в дозе 20,0 мг/кг, в течение 21 дня). Окраска 3,3'-диаминобензидином и гематоксилином Майера. Увеличение х600
По нашему мнению, изменения площади экспрессии TNFαR1 в эндокринных островках железы у животных опытных групп связаны с действием препарата. В своей работе G.D. Kalliolias, L.B. Ivashkiv (2016) указывают, что сигнальные пути и биологические клеточные эффекты TNFα осуществляются через рецепторы, которые экспрессируются на клетках и обеспечивают различные пути передачи сигналов. Воздействие TNFα на клетку запускает разнообразные сигнальные каскады, которые приводят к целому ряду клеточных реакций, они включают апоптоз клеток, их дифференцировку или пролиферацию [12]. Экспериментально выявленное нами увеличение площади экспрессии TNFaR1 у животных, которым применяли терапевтическую (минимальную) дозу препарата, вероятно, вызвано готовностью эндокринных клеток к апоптозу.
Можно допустить, что уменьшение площади экспрессии рецепторов в островках железы у животных, которым применяли высокие дозы, связано как со снижением количества рецепторов TNFαR1 на мембране клеток, так и с изменением их структуры вследствие развития дистрофических и воспалительных процессов в паренхиме железы. Этот факт подтверждается тем, что деструкция и формирование фиброза ткани поджелудочной железы приводят к поражениям ее островковой части [13].
Представленные результаты эксперимента, целью которого было изучить влияние карпрофена на экспрессию рецепторов TNFα в поджелудочной железе, согласуются с результатами, полученными в экспериментальной серии, проведенной нами ранее, где в аналогичных условиях изучали побочное действие нимесулида [14]. Согласованность результатов, полученных в двух сериях опытов, обнаруживает определенную закономерность, которая проявляется влиянием TNFα на патогенез панкреатопатии, индуцированной длительным приемом НПВП.
Заключение. В результате исследований установлено, что экспрессия рецепторов TNFα (TNFαR1) обнаруживается только лишь в эндокринных островках и имеет ограниченный характер. Проявления экспрессии TNFαR1 были обнаружены у животных всех экспериментальных групп, в том числе у интактных. Установлено, что у животных опытных групп размер площади экспрессии рецепторов в эндокринных островках зависел от дозировки препарата. Максимальная площадь экспрессии отмечалась у животных, которым давали карпрофен в терапевтической дозе 4,0 мг/кг. У животных, которым давали увеличенные дозировки препарата (пятикратную и десятикратную), площадь экспрессии была меньше по сравнению с контрольной группой.
Библиографическая ссылка
Лазаренко Л.В. ФАКТОР НЕКРОЗА ОПУХОЛИ В ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЕ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ПРИМЕНЕНИИ КАРПРОФЕНА // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32204 (дата обращения: 07.01.2026).
DOI: https://doi.org/10.17513/spno.32204



