В наши дни ВИЧ-инфекция превратилась в пандемию и является одной из основных глобальных проблем общественного здравоохранения. Несмотря на предпринимаемые усилия, эпидемия продолжает развиваться без признаков к замедлению и к настоящему времени унесла почти 36,3 млн человеческих жизней [1]. По данным Роспотребнадзора, на 2021 г. число граждан Российской Федерации (РФ), заразившихся ВИЧ-инфекцией, составляет более 1,5 млн человек [2]. За 10 лет коэффициент заболеваемости вырос в 3 раза, а число смертельных случаев – в 13 раз [3].
В настоящее время прилагаются колоссальные усилия, направленные на предупреждение, профилактику и подавление ВИЧ-инфекции.
Высокоактивная антиретровирусная терапия − метод терапии ВИЧ-инфекции (ВИЧ относят к семейству ретровирусов), состоящий в регулярном приеме двух и более противовирусных препаратов. Ключевым компонентом современных протоколов высокоактивной антиретровирусной терапии являются ненуклеозидные ингибиторы обратной транскриптазы ВИЧ.
ННИОТ являются неконкурентными ингибиторами фермента, которые связываются с аллостерическим центром ОТ, влияющим на мобильность и гибкость центра полимеризации, приводя к резкому снижению эффективности фермента. Центр связывания ННИОТ расположен на расстоянии 10 Å от полимеразного центра в p66-субъединице и образован преимущественно гидрофобными аминокислотными остатками (L100, K101, K103, V106, T107, V108, V179, Y181, Y188, V189, G190, F227, W229, L234, Y318 p66 субъединицы и E138 p51 субъединицы [4]).
Цель исследования. Важнейшей причиной неэффективности лекарственных средств при длительном применении является развитие резистентности вируса, что делает актуальной разработку новых препаратов [5]. Поэтому изучение имеющихся литературных данных по дизайну и конструированию новых ННИОТ на основе базовых структур, анализ фармакологически активных веществ, а также исследование зависимости «структура–активность» являются целью данного обзора.
Материал и методы исследования. Анализ репрезентативной литературы в наукометрических базах данных, таких как РИНЦ, ISI, SCOPUS. Критериями отбора, в первую очередь, являлись издания, подходящие по тематике ННИОТ. Затем рассматривались высокий импакт-фактор журнала и его востребованность в научном мире.
Результаты исследования и их обсуждение. Одними из важнейших варьируемых фрагментов в структуре исследуемых ННИОТ, влияющих на противовирусную активность, являются модификации линкеров. Обозначим их в структурах DAPY, HEPT и DABO соответственно (рис. 1).
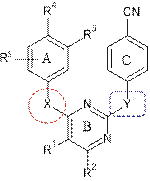
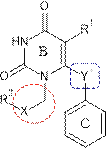
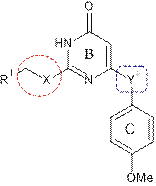
Рис. 1. Варьируемые линкеры производных пиримидинов
 Новые производные DAPY 1, включая S-DAPY, NH-DAPY и O-DAPY, были идентифицированы как ННИОТ с сильным действием против дикого и клинически мутантного штамма вируса иммунодефицита человека (ВИЧ).
Новые производные DAPY 1, включая S-DAPY, NH-DAPY и O-DAPY, были идентифицированы как ННИОТ с сильным действием против дикого и клинически мутантного штамма вируса иммунодефицита человека (ВИЧ).
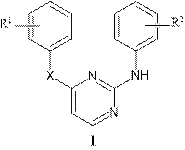
Наличие между кольцами А и В атома кислорода, серы, аминогруппы или метиленового фрагмента предпочтительнее для высокой анти-ВИЧ активности соединений, как в отношении вируса дикого типа, так и в отношении резистентных мутантных штаммов.
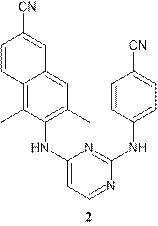
В ходе исследований по разработке новых ННИОТ был синтезирован ряд 4-(4-(замещенный-нафталин-1 или 2-илокси)пиримидин-2-иламино)бензонитрилов, в которых фенильное крыло А заменено нафталиновым кольцом, связанным с аминогруппой. Эта серия соединений проявляла высокую активность и очень низкую цитотоксичность в отношении ВИЧ-1 [6, 7].
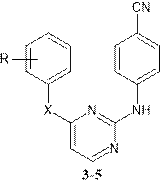
Были получены соединения 3-5 с линкером между ароматическим фрагментом и пиримидиновым кольцом для усиления связывания с аминокислотным остатком W229 [8] (табл. 1).
Таблица 1
Ингибирующая активность соединений 3-5 в отношении ОТ ВИЧ
|
Вещество |
R |
X |
IC50/EC50*(нМ) |
|||
|
WT |
K103N |
Y181C |
K103N+Y181C |
|||
|
3 |
2,4,6-СН3 |
NH |
1 |
4.3 |
7.5 |
44 |
|
4 |
2,6-СН3, 4-CN |
NH |
0.4 |
1.9 |
7.1 |
37 |
|
5 |
2,6-СН3, 4-CN |
O |
1.1 |
2.7 |
37 |
94 |
|
NVP* |
40 |
6300 |
10000 |
>10000 |
||
|
DLV* |
63 |
2500 |
2000 |
>10000 |
||
|
EFV* |
1 |
40 |
2 |
40 |
||
Примечание. * − испытания проводились на линии клеток MT-4
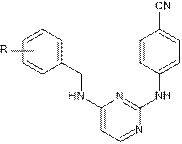
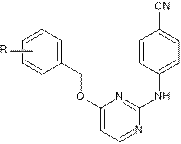
Группой Гу и Джу были синтезированы новые диарилпиримидины 6 (рис. 2) с двухатомным линкером между левым крылом А и центральным пиримидином В для улучшения конформационной гибкости. Большинство соединений проявили высокую активность против ВИЧ-1 дикого типа. Однако им не хватало активности против двойного мутанта ВИЧ-1 K103N/Y181C [9]. Биоизостеры 7 продемонстрировали аналогичную активность против ВИЧ-1 дикого типа, среди которых 7а также показал высокую активность против мутанта ВИЧ-1 E138K [10]. Общей проблемой 6 и 7 является отсутствие активности против двойного мутанта ВИЧ-1 K103N/Y181C.
6, ЕС50=0.0026-1.0559 мкМ 7, ЕС50=0.0058-4.7 мкМ
6а, R=2-F, ЕС50=2.6 нМ 7а, R=2-F, ЕС50=5.8 нМ
ЕС50(Е138К)=0.3 мкМ
Рис. 2. Структура производных DAPY 6, 7 и их активность против ВИЧ
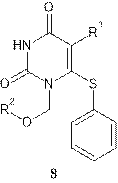
Замена линкера между пиримидиндионовым кольцом В и ароматическим С на серу, метиленовый фрагмент и кетогруппу в производных HEPT также приводит к повышению ингибирующей активности в соединении 8. Повышенная активность ввиду наличия атома кислорода в составе линкера между фенильным фрагментом в N-1 положении и пиримидиновым циклом обусловлена образованием водородной связи с боковой группой Y318, располагающейся вблизи «входа» в гидрофобный карман ОТ ВИЧ.
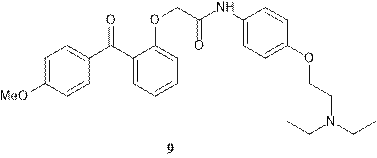
Усилия по поиску новых ННИОТ, эффективных против резистентных вирусных штаммов, привели к разработке новых ингибиторов, содержащих бензофеноновый фрагмент 9 [11].
При сравнении анти-ВИЧ-1 активности ранее опубликованных соединений с метиленовым или карбонильным линкером было выявлено, что их активность сильно зависит от положения заместителей в арильном кольце А. Наличие заместителей как в C-2, так и в C-6 положениях фенильного кольца А имеет решающее значение для биологической активности ННИОТ, как и случай 2,6-диметилфенильной части Этравирина и Рилпивирина. Два орто-заместителя дают почти перпендикулярную геометрию арильного кольца А к плоскости пиримидина и модуляции в обоих орто-положениях кольца B привели к значительному увеличению активности анти-ВИЧ-1. Такие структурные признаки ранее сочетались в соединениях, содержащих арильное кольцо А, замещенное хлором, бромом либо фтором в обоих орто-положениях. В частности, полученная серия, основанная на сочетании структурных особенностей DAPY и DABO аналогов с кольцом 2,6-дифторфенила, проявляла наномолярную анти-ВИЧ-1 активность против дикого типа, а также клинически значимых мутантных штаммов [12]. На основании вышеуказанных данных была разработана новая серия ННИОТ (рис. 3) [13].
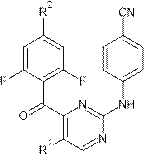
Рис. 3. Строение молекул-мишеней с карбонильным линкером и кольцом 2,6-дифторфенила
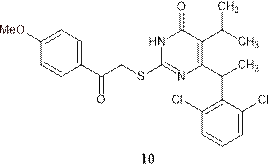
Такер и иные [14] получили соединение 11, содержащее кислород в линкере между кольцами А и В, которое обладало высокой эффективностью по сравнению с большинством проверенных мутаций (табл. 2).
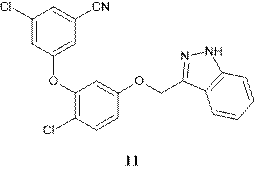
Таблица 2
Анализ зависимости «структура–активность» для гетероциклического производного 11
|
Ингибирование ОТ, IC50 (нM)a |
Противовирусная активность в культуре клеток, CIC95 (нM)b |
||||
|
WT |
K103N |
Y181C |
WT (10% FBS) |
K103N (10% FBS) |
Y181C (10% FBS) |
|
1.35 |
1.12 |
2.62 |
22.57 |
33.44 |
101.5 |
Примечание.a Соединения оценивали в стандартном анализе SPA; значения представляют собой среднее геометрическое нескольких определений.
b CIC95 (концентрация, ингибирующая культуру клеток) определяется как концентрация, при которой распространение вируса подавляется >95% в Т-лимфоидных клетках человека MT-4, поддерживаемых в среде RPMI 1640, содержащей 10% FBS. Значения представляют собой среднее геометрическое значение нескольких определений. Отсутствие цитотоксичности не наблюдалось вплоть до верхнего предела анализа (8,3 мкМ).
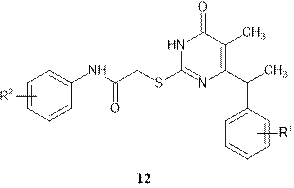
Известно, что образование пептидной связи в линкере между кольцами А и В в соединении 12 предположительно способствует образованию новых водородных связей с аминокислотами гидрофобного кармана и компенсирует утрату взаимодействия с Y181 и Y188 в случае мутации последних. По отдельности водородные связи очень слабы, но за счет того, что в белке они образуются в огромных количествах, суммарно их вклад очень велик.
Нафтилзамещенные диарилпиримидины (наномолярная активность) являются сильнодействующими ННИОТ, но у этих соединений наблюдалась плохая растворимость. Кроме того, QSAR исследования показывают, что гибкость положения линкера благоприятна для усиления активности. Однако диариловые эфиры (DPE) – еще один класс
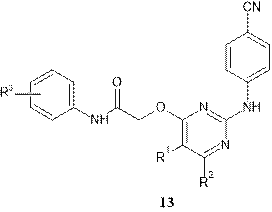
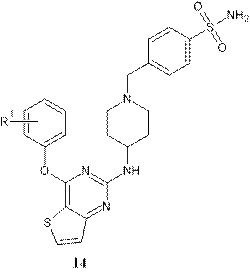
В 2019 г. были разработаны и синтезированы эффективные производные дигидрофуро[3,4-d]пиримидина в качестве ННИОТ. Некоторые соединения оказались эффективными против широкого спектра штаммов ВИЧ-1, несущих единичные мутации, устойчивые к ННИОТ (EC50=0,9–8,4 нМ), и проявляли сравнимую активность с ETV в отношении вируса с двойными мутациями F227L + V106A и K103N + Y181C. Это дало толчок к последующей структурной оптимизации, которая привела к созданию соединений с вариацией пиперидинового линкера, обладающих мощной противовирусной активностью [16, 17]. Кроме того, открытый атом кислорода дигидрофуро[3,4-d]пиримидина способен образовывать дополнительную водородную связь, взаимодействуя с аминокислотными остатками в кармане связывания, что может способствовать улучшению профилей стойкости соединений. Лучшими оказались пиперидинзамещенные производные тиофена[3,2-d]пиримидина 14, которые продемонстрировали более сильную анти-ВИЧ-1 активность в сравнении с Этравирином, а также повышенную растворимость и биодоступность [18, 19, 20].
Заключение. Работа по созданию новых соединений-лидеров, основанная на совокупности знаний химических закономерностей и прогнозировании свойств на качественном уровне, позволяет значительно сохранить время и ресурсы и открывает широкие возможности для более целенаправленного синтеза соединений. Так, было установлено, для некоторых ННИОТ наличие в линкере атома кислорода, серы, аминогруппы, метиленового или пиперидинового фрагмента предпочтительнее для высокой анти-ВИЧ активности соединений как в отношении вируса дикого типа, так и в отношении резистентных мутантных штаммов. На улучшение конформационной гибкости влияет наличие двухатомного линкера, содержащего атом кислорода и аминогруппу. Введение кетогруппы в линкер способствует увеличению активности до нано- и субнаномолярной в отношении ВИЧ-1 дикого типа. Представленные структуры представляют большой интерес для дальнейших изучений, дизайна и конструирования потенциальных лекарственных средств.
Библиографическая ссылка
Захарова Е.К. ЗАВИСИМОСТЬ «СТРУКТУРА-АКТИВНОСТЬ» НОВЫХ НЕНУКЛЕОЗИДНЫХ ИНГИБИТОРОВ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИЧ-1, ОСНОВАННАЯ НА МОДИФИКАЦИИ ЛИНКЕРОВ // Современные проблемы науки и образования. 2022. № 6-2. ;URL: https://science-education.ru/ru/article/view?id=32203 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.32203



