Проблема временной остановки массивного наружного кровотечения при оказании догоспитальной помощи раненым и пострадавшим издавна является одной из важнейших не только в военной медицине, но и в медицине чрезвычайных ситуаций мирного времени [1–3], и, несмотря на значительный арсенал существующих средств и появление новых способов и методов, вопрос сохранения жизни и конечности при повреждениях магистральных сосудов требует постоянного изучения [2, 4].
Поиск эффективных и безопасных средств гемостаза на передовых этапах медицинской эвакуации, возможности их применения начиная с оказания первой помощи в очаге катастрофы или в условиях ведения боевых действия, а также в процессе транспортировки раненых и пострадавших для оказания квалифицированной и специализированной помощи не прекращается и по сей день [5–7].
В последние тридцать лет одним из ведущих направлений создания средств временной остановки наружного кровотечения является разработка локальных гемостатических препаратов [8–10]. И, если изначально проблемой возможности использования в данном направлении неорганических соединений и полисахаридов занимались в основном за рубежом, то в последнее десятилетие отечественный производитель ежегодно расширяет список местных гемостатических средств (МГС), что, в свою очередь, заставляет задуматься о выборе наиболее эффективных и безопасных среди них [11–13].
Несмотря на то что основное предназначение МГС – остановка массивных наружных кровотечений [9], их применение также возможно и при незначительных кровотечениях [14]. Необходимо отметить, что работы по изучению действия МГС в большинстве исследований связаны только с оценкой их гемостатической эффективности, основным критерием которой является результативность первичной и вторичной остановки кровотечения [7, 9].
В то же время, учитывая возможное применение данных средств при колото-резаных и резаных ранениях, в большинстве своем требующих только туалета раны, возникает вполне резонный вопрос о влиянии используемого вещества на мягкие ткани раневой поверхности с целью возможности наложения первичного шва.
Целью настоящего экспериментального исследования является изучение влияния местных гемостатических средств на стенку раневого канала при резаных ранениях мягких тканей.
Материалы и методы исследования
Практически все виды ранений мягких тканей, которые можно произвести в эксперименте, имеющие в своей составляющей раневой канал (рваные, рубленые, огнестрельные), сопровождаются изменениями различной степени выраженности в стенке раневого канала. Исключение составляет колото-резаная рана, при этом, чем тоньше режущая кромка, тем меньше патологических изменений возникает в стенке канала непосредственно в месте нанесения раны, а скальпели с шириной режущей кромки 0,8 мкм оказывают минимальное повреждающее воздействие на ткани при их рассечении [15]. Данный вид раны и был выбран в качестве модели эксперимента.
Экспериментальные исследования проводились на белых беспородных свиньях-самцах массой 51±5,3 кг. Содержание животных и проводимые с ними манипуляции осуществляли в соответствии с требованиями «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург, 1986), нормативными документами, представленными в руководстве «Guide for care and use of laboratory animals ILAR publication, 1996, National Academy Press» и требованиями приказа Минздрава России № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики в Российской Федерации». Все животные после десятидневного карантина за сутки до эксперимента помещались в отдельные клетки и содержались в соответствии с правилами ухода за лабораторными животными без доступа к пище, свободным доступом к воде.
Эксперимент выполнялся следующим образом.
За 20 минут до начала основной части эксперимента животному проводилась премедикация внутримышечным введением атропина в дозировке 0,1 мг на 10 кг массы тела и димедрола. Неингаляционная анестезия на спонтанном дыхании с контролем проходимости верхних дыхательных путей проводилась внутримышечным введением препарата «Золетил 100» в дозировке 10 мг/кг массы тела. При необходимости восстановление проходимости верхних дыхательных путей осуществлялось фиксацией языка или постановкой воздуховода «I-Gel». После наступления анестезии катетеризировали ушную вену, дальнейшее введение препарата «Золетил 100» осуществляли внутривенно в дозировке 2 мг/кг массы тела каждые 20 минут.
После наступления анестезии животному наносили резаную рану в области медиальной поверхности средней трети бедра в поперечной плоскости с полным пересечением бедренной артерии и вены и после 30 секунд свободного кровотечения осуществляли пальцевое прижатие сосудов выше уровня повреждения, осушали рану с помощью марлевых салфеток и выполняли тугое тампонирование МГС, начиная с участка поврежденных сосудов, постепенно заполняя весь объем раневого канала, с последующей компрессией в течение 5 минут. По истечении указанного времени компрессию прекращали и наблюдали за эффективностью остановки кровотечения. В случаях, если кровотечение возобновлялось, осуществляли повторное тампонирование тем же гемостатиком, с последующей компрессией на 2 часа. В любом случае, независимо от того, было остановлено кровотечение после повторного тампонирования или нет, переходили на второе бедро с выполнением тех же мероприятий в той же последовательности, тем же МГС.
Изучению подверглись 7 МГС российского и зарубежного производства на основе цеолита и хитозана. Всего в эксперименте было задействовано 14 животных, по 2 в каждой группе (4 серии), в соответствии с исследуемым препаратом.
I группа – тампонада раны проводилась с использованием порошка «Гемоспас» на основе цеолита (производитель ООО «МДК Медика», г. Москва) и стандартного пакета перевязочного индивидуального медицинского стерильного в прорезиненной оболочке.
II группа – тампонада раны проводилась с использованием бинта «Гемоспас био» на основе хитозана (производитель ООО «МДК Медика», г. Москва).
III группа – тампонада раны проводилась с использованием «Гемофлекс Комбат» на основе хитозана (производитель ООО «Инмед», г. Санкт-Петербург).
IV группа – тампонада раны проводилась с использованием «Celoxтм Rapid» на основе хитозана (производство США);
V группа – тампонада раны проводилась с использованием бинта «Гепоглос» на основе хитозана (производитель ООО «Люми», г. Санкт-Петербург); 8х100 см.
VI группа – тампонада раны проводилась с использованием гелеобразного средства «Тектум» на основе хитозана (производитель ООО «Тектум», г. Нижний Новгород) и стандартного пакета перевязочного индивидуального медицинского стерильного в прорезиненной оболочке.
VII группа – тампонада раны проводилась с использованием бинта «Элларга» на основе хитозана (производитель ООО «НОБР», г. Москва); 7,5х150 см.
По истечении 2 часов с начала тампонирования в соответствии с последовательностью тампонирования ран производился забор стенки раневого канала с прилегающими мышечными тканями на глубину 1 см. Материал помещался в 10%-ный раствор нейтрального формалин, и только после этого животное выводили из эксперимента внутривенным струйным введением KCl 4% – 50 мл. Общая фиксация продолжалась 72–96 часов, подготовленный материал заключали в парафин. Для обзорного просмотра производили окрашивание срезов, приготовленных на санном микротоме МС-2, гематоксилин-эозином. Толщина срезов составляла 7 мкм. Просмотр и фотографирование препаратов осуществляли с помощью микровизора Vizo 101.
В качестве контрольной группы брали стандартный гистологический материал неповрежденной поперечнополосатой скелетной мышцы, представленный в учебниках и руководствах по гистологии.
Результаты исследования и их обсуждение
При проведении эксперимента повторное тампонирование раны потребовалось в группах I–III и VI–VII (табл. 1). При этом «Гемоспас био», «Гемофлекс Комбат» и «Тектум» повторно применялись в 3 из 4 серий (т.е. в 75%), «Гемоспас» – в 2 из 4 серий (50%) и «Элларга» – в 1 из 4 серий (25%). При применении «Celoxтм Rapid» (группа IV) и «Гепоглос» (группа V) оказалось достаточным однократного тампонирования. Кроме того, вызвало затруднение использование вещества «Тектум», так как гелеобразное МГС превращается в осклизлую массу, с которой практически невозможно работать на глубоких ранах с поврежденными сосудами.
В результате проведенных экспериментальных исследований и полученных данных гистологического исследования было выявлено следующее.
При гистологическом исследовании в I группе (тампонада раны проводилась с использованием порошка «Гемоспас») определяются признаки устойчивого гемостаза: массивное скопление фибрина с эритроцитами с формированием красного тромба (рис. 1). Вместе с тем отмечается разрушение элементов сосудистой стенки и периваскулярных тканей с развитием сильно выраженного периваскулярного отека.
Кроме того, отсутствие ядер в мышечных волокнах на протяжении гистологического среза говорит о гибели мышечных волокон на глубину до 1 см от стенки раневого канала, что, по-видимому, связано с химической реакцией, сопровождающейся выделением тепла при контакте цеолита и тканей организма. В пользу данного предположения свидетельствует массивное скопление фибрина в области стенки раневого канала.
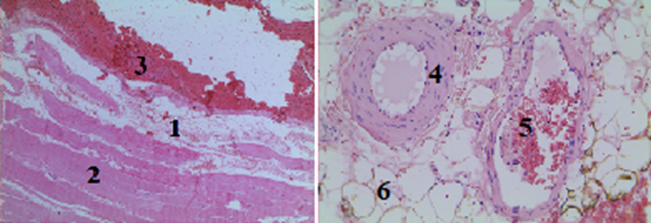
Рис. 1. Гистологический срез мышечного участка стенки раневого канала в I группе (увеличение об. 7х10): 1 – сильно выраженный перицеллюлярный отек с наличием в нем эритроцитов; 2 – мышечные волокна расположены параллельными пучками, ядра отсутствуют; 3 – массивное скопление фибрина с эритроцитами (место контакта МГС с тканями); 4 – стенка артериолы и эндотелий с умеренно выраженным отеком; 5 – сформированные красные тромбы; 6 – разрушенные жировые клетки в периваскулярном пространстве
Во II группе (тампонада раны с использованием бинта «Гемоспас био») определяется формирование пристеночного красного тромба. Процесс гемостаза сопровождался разрушением элементов сосудистой стенки и периваскулярных тканей с развитием сильно выраженного периваскулярного отека (рис. 2). Так же как и в первой группе, отмечаются гибель мышечных волокон и наличие фибрина на раневой поверхности, а дополнительно обнаруживаются разрушенные эритроциты (рис. 3).
Учитывая, что в состав данного средства входит йодопивидон, который является антисептическим средством, его применение возможно только на неповрежденных поверхностных тканях. Гибель мышечных клеток и разрушение эритроцитов, по нашему мнению, связаны с химическим действием данного вещества на подлежащие к месту контакта образования с разрушением белковых структур, вызывающим в последующем некроз тканей.
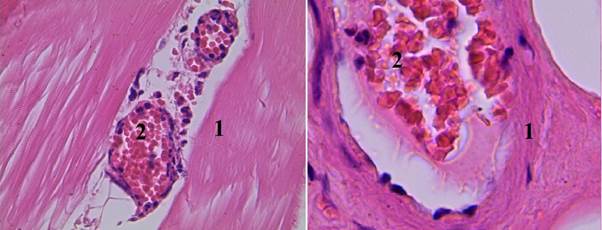
Рис. 2. Гистологический срез мышечного участка стенки раневого канала в II группе (увеличение об. 7х40): 1 – стенка артериолы с умеренно выраженным отеком; 2 – эндотелий с сильно выраженным отеком, в просвете определяется формирование пристеночного красного тромба
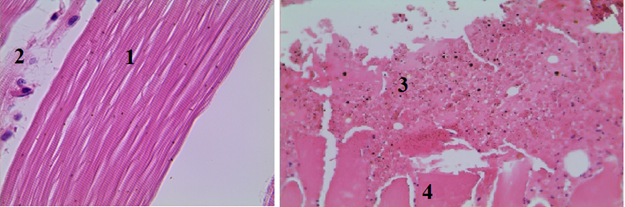
Рис. 3. Гистологический срез мышечного участка стенки раневого канала во II группе (увеличение об. 7х20): 1 – мышечные волокна расположены параллельными пучками, ядра отсутствуют, сильно выраженный перицеллюлярный отек; 2 – в пространстве между мышечными волокнами определяются венулы с заполненными просветами эритроцитами, без сладжирования, в периваскулярном пространстве – единичные эритроциты; 3 – раневая поверхность покрыта фибрином с примесью разрушенных эритроцитов; 4 – мышечные волокна с отсутствием ядер
В III группе (тампонада раны с использованием «Гемофлекс Комбат» отмечается слабо выраженный процесс формирования тромба, но с сохранением периваскулярных тканей и умеренно выраженным периваскулярным отеком (рис. 4).
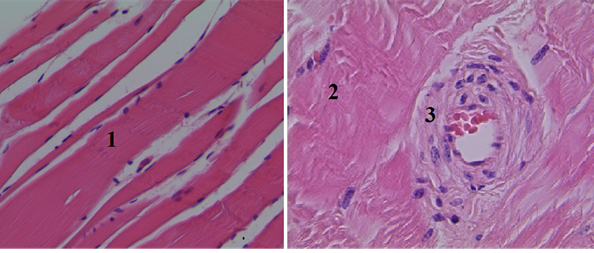
Рис. 4. Гистологический срез мышечного участка стенки раневого канала в III группе (увеличение об. 7х10): 1 – мышечные волокна расположены в основном параллельно, в большинстве из них ядра сохранены, сильно выраженный перицеллюлярный отек; 2 – слабовыраженный периваскулярный отек; 3 – стенка артериолы и эндотелий с умеренно выраженным отеком, в просвете свободнолежащие эритроциты
При использовании «Celoxтм Rapid» (IV группа) отмечается хороший гемостаз. На гистологических срезах имеется умеренно выраженный периваскулярный отек без дополнительного повреждения тканей раны, что подтверждается сохранением ядер в мышечных волокнах (рис. 5).
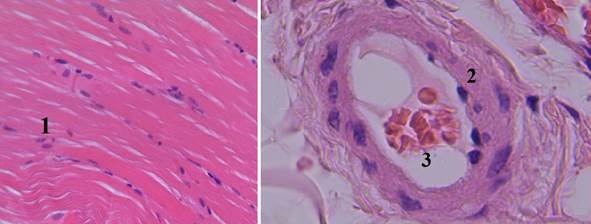
Рис. 5. Гистологический срез мышечного участка стенки раневого канала в IV группе (увеличение об. 7х10): 1 – мышечные волокна с сохраненными ядрами, расположены параллельными пучками (местами параллельность хода волокон нарушена); 2 – стенка и эндотелий с умеренно выраженным отеком; 3 – в просвете артериолы образование монетных столбиков из эритроцитов (сладжирование)
По сравнению с предыдущими группами в группе V (тампонада раны с использованием бинта «Гепоглос») качество гемостаза составляет 100%. При гистологическом исследовании отмечается хорошее тромбообразование с сохранением периваскулярных тканей и со слабо выраженным отеком стенки артериолы, сохранением мышечных волокон на всем протяжении среза. Признаков гибели тканей не выявляется, как и в группе IV (рис. 6).
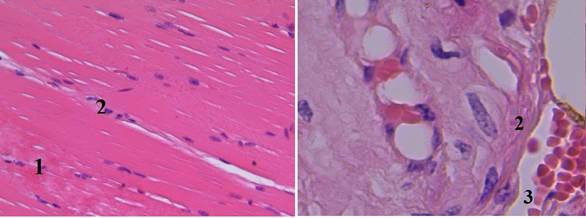
Рис. 6. Гистологический срез мышечного участка стенки раневого канала в V группе (увеличение об. 7х10): 1 – мышечные волокна с сохраненными ядрами, расположены параллельными пучками (местами параллельность хода волокон нарушена); 2 – стенка артериолы со слабо выраженным отеком; 3 – артериола с формирующимися пристеночными красными тромбами
В VI группе (тампонада раны с использованием гелеобразного средства «Тектум»): применение МГС сохраняло периваскулярные ткани, но вызывало сильный перицеллюлярный отек, также отсутствовали признаки тромбообразования (рис. 7).
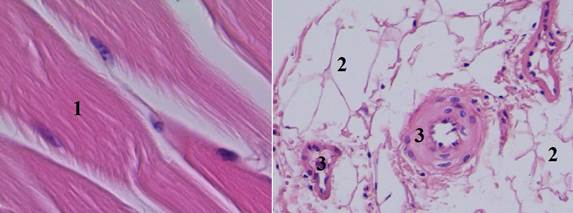
Рис. 7. Гистологический срез мышечного участка стенки раневого канала в VI группе (увеличение об. 7х20): 1 – мышечные волокна с сохраненными ядрами, расположены параллельными пучками, и сильно выраженный перицеллюлярный отек; 2 – сильно выраженный перицеллюлярный отек; 3 – стенка артериолы и эндотелий с умеренно выраженным отеком, просвет свободен от форменных элементов крови
Гистологические исследования в VII группе (тампонада раны с использованием бинта «Элларга») показали, что МГС способствует тромбообразованию, не вызывая повреждения здоровой ткани раневого канала (рис. 8).
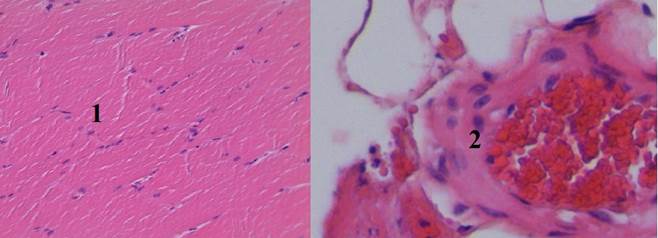
Рис. 8. Гистологический срез мышечного участка стенки раневого канала в VII группе (увеличение об. 7х10): 1 – мышечные волокна расположены непараллельными пучками, ядра в них сохранены, слабо выраженный перицеллюлярный отек; 2 – артериола с умеренно выраженным отеком стенки и эндотелия, в просвете определяется образование пристеночного красного тромба
Безопасность применения МГС является серьезным поводом для научных исследований. Гистологическое исследование мышечной ткани, контактирующей с местными гемостатическими средствами, позволило выявить образцы, оказывающие наиболее агрессивное и небезопасное воздействие на живую ткань (таблица). «Отрицательными» лидерами оказались «Гемоспас» и «Гемоспас Био»: при гистологических исследованиях выявлены выраженные признаки разрушения живой ткани стенки раны с выраженным периваскулярным отеком. При этом повторное тампонирование говорит об их низких гемостатических свойствах. В то же время гелеобразное средство «Тектум» сохраняло периваскулярные ткани, но при гистологическом исследовании отсутствовали признаки тромбообразования, что приводило к необходимости повторного тампонирования во время эксперимента.
Сравнительная характеристика результатов действия МГС в эксперименте
|
№ группы |
Коммерческое название МГС |
Действующее вещество |
Повторное тампонирование |
Формирование тромба |
Степень выраженности периваскулярного отека |
Признаки разрушения живой ткани стенки раны |
|
I |
Гемоспас |
цеолит |
50% |
+ |
сильный |
+ |
|
II |
Гемоспас Био |
хитозан + йодоповидон |
75% |
+ |
сильный |
+ |
|
III |
Гемофлекс Комбат |
хитозан |
75% |
– |
умеренный |
– |
|
IV |
Celoxтм Rapid |
хитозан |
0 |
+ |
умеренный |
– |
|
V |
Гепоглос |
хитозан |
0 |
+ |
слабо |
– |
|
VI |
Тектум |
хитозан |
75% |
– |
сильный |
– |
|
VII |
Элларга |
хитозан |
25% |
+ |
слабо |
– |
Выводы
1. Гистологическое исследование мягких тканей стенки раневого канала, контактирующей с местными гемостатическими средствами, позволяет выявить образцы, оказывающие наиболее агрессивное и небезопасное воздействие на живую ткань.
2. По качеству гемостаза из отечественных средств лидирующие позиции занимают «Гепоглос» (100%) и «Элларга» (75%).
3. Наиболее агрессивное воздействие на подлежащие к ране мягкие ткани оказывают местные гемостатические средства «Гемоспас» и «Гемоспас Био».
3. Несмотря на то что основным действующим веществом МГС «Гемоспас Био» является хитозан, наличие в его составе местного антисептического средства йодоповидона при длительном контакте с раневой поверхностью приводит к гибели подлежащих к стенке раневого канала тканей на глубину до 1 см.
4. Дополнительного повреждения мягких тканей при контакте не вызывают средства «Celoxтм Rapid», «Гепоглос» и «Элларга», в состав которых производитель, согласно описанию, не включает антисептические препараты местного применения.
Таким образом, на основании морфологической оценки стенки раневого канала после применения локальных гемостатических средств наиболее безопасными и эффективными являются «Гепоглос», «Celoxтм Rapid», что позволяет в случаях их применения при колото-резаных и резаных ранениях в сроки до 2 часов после получения травмы накладывать глухой первичный шов непосредственно после туалета раны или частичной первичной хирургической обработки. В случаях использования в аналогичных ситуациях препаратов «Гемоспас» и «Гемоспас Био» наложение первичного шва возможно только после радикальной первичной хирургической обработки раны с иссечением ее краев, стенок и дна, даже при отсутствии косвенных признаков некроза.
Библиографическая ссылка
Логинов В.И., Сморкалов А.Ю., Никольский В.О., Ботяков А.Г., Шпагин М.В., Гречко В.Н. ГИСТОЛОГИЧЕСКАЯ ОЦЕНКА ВОЗДЕЙСТВИЯ МЕСТНЫХ ГЕМОСТАТИЧЕСКИХ СРЕДСТВ НА СТЕНКУ РАНЕВОГО КАНАЛА ПРИ РАНЕНИЯХ МЯГКИХ ТКАНЕЙ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32185 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.32185



