Пункция бедренной артерии наряду с пункцией радиальной артерии является наиболее частым и удобным методом обеспечения внутрисосудистого доступа в интервенционной хирургии [1]. Однако, несмотря на относительную малотравматичность доступа и совершенствование методов послеоперационного гемостаза, до сих пор нередко встречаются осложнения, связанные непосредственно с пункцией. Частота их формирования колеблется в пределах 0,3–1% при диагностической ангиографии и может достигать 15% при проведении оперативного вмешательства [2]. По мнению M. Tavakol с соавт. (2012), проведение процедуры опытными специалистами позволяет минимизировать риски, но полностью их исключить не представляется возможным [3].
Ретроперитонеальное кровотечение с формированием забрюшинной гематомы является одним из относительно редких осложнений трансфеморального доступа [4], которое, тем не менее, может приводить к развитию геморрагического шока, что, в свою очередь, является стремительно развивающимся жизнеугрожающим состоянием [5, 6]. Частота его развития составляет, по разным данным, от 0,025% [7, 8] до 0,9% [9, 10]. Развитие забрюшинного кровотечения с формированием массивной забрюшинной гематомы неразрывно связано с повышением рисков как летального исхода, так и грубых нарушений жизнедеятельности [11] в связи с тем, что оно ведет к быстрому снижению объема циркулирующей крови и, как следствие, к резкому уменьшению кровоснабжения жизненно важных органов и далее – к смерти [12]. Некоторые исследования показали, что забрюшинное пространство может секвестрировать большой объем жидкости. Следовательно, парентеральное введение жидкости при продолжающемся кровотечении не сможет полностью восполнить объем циркулирующей крови в связи с ее депонированием в забрюшинном пространстве [13, 14].
Геморрагические осложнения, помимо риска развития острой постгеморрагической анемии и геморрагического шока, могут опосредованно приводить также к усилению тромбообразующей функции крови, что в условиях нейроинтервенции часто грозит тромбозом ранее имплантированного в прецеребральные или мозговые сосуды стента и, как следствие, развитием ишемического повреждения головного мозга. Существует несколько механизмов, объясняющих данный феномен. Во-первых, применение с гемостатической целью антитромботических агентов, в том числе переливание тромбоконцентрата, может приводить к возобновлению тромбообразующей функции тромбоцитов, ранее угнетенной на фоне использования дезагрегантной терапии. Во-вторых, развитие острой анемии способствует стимуляции выброса в кровеносное русло протромботических факторов, таких как эритропоэтин и ингибитор активатора плазминогена, что также может в конечном итоге привести к формированию тромботических явлений [15–17].
Описаны и достаточно хорошо известны случаи спонтанного формирования забрюшинной гематомы [5, 6, 12], которые могут быть связаны с такими причинами, как опухоли различной локализации [18, 19, 20], гематологические проблемы, инфекция, сосудистые мальформации, повреждение печени и почек, вызванное травмой или их биопсией [21, 22, 23]. Также в литературе были описаны спонтанные разрывы псевдоаневризмы яичниковой артерии [24–26].
Согласно имеющимся исследованиям, к группе риска относятся пациенты женского пола, пациенты с механическим повреждением верхней или нижней эпигастральной артерии [5, 6, 12], низкой массой тела, малой площадью поверхности тела [20, 21, 22]. Факторами, способствующими развитию данного осложнения, являются постоянный прием дезагрегантов, таких как ингибиторы IIb/IIIa рецепторов гликопротеина [13, 18, 19], а также использование для доступа интродьюсеров большого диаметра [23, 27].
Описан ряд факторов, которые способны влиять на формирование постпункционных осложнений [28, 29, 30]; их можно разделить на модифицируемые, т.е. те, на которые возможно оказать влияние, и немодифицируемые [31, 32] (табл. 1–2).
Таблица 1
Основные модифицируемые факторы риска
|
Применение медикаментов |
Назначение антикоагулянтов и дезагрегантов обязательно при остром коронарном синдроме и препятствует появлению тромбоэмболических осложнений. В то же время данные препараты повышают риск развития геморрагических осложнений, поэтому их прием должен проводиться в условиях клинического и лабораторного мониторинга |
|
Артериальный доступ |
Радиальный доступ по сравнению с трансфеморальным ассоциируется с меньшим риском локальных сосудистых осложнений. При феморальном доступе высокое или низкое место пункции, неоднократные попытки пункции, а также большой размер применяемых катетеров повышают риск сосудистых осложнений |
|
Метод гемостаза |
При использовании феморального доступа эффективная компрессия места пункции снижает риск васкулярных осложнений. При этом мануальная компрессия требует применения физической силы и навыка удерживать хороший уровень сдавления артерии на протяжении 20 минут. Пневматическая компрессия так же эффективна, как и мануальная, а применение ушивающих устройств может значительно уменьшить сроки пребывания пациента в постели |
Таблица 2
Основные немодифицируемые факторы риска
|
Пол |
Женщины, которым проводят пункцию, обычно старше мужчин и имеют больше сопутствующих заболеваний (артериальная гипертензия, сахарный диабет, гиперхолестеринемия) |
|
Возраст |
Возраст пациентов старше 70 лет ассоциируется с повышенным риском осложнений (преимущественно геморрагических) из-за выраженного атеросклероза и большего числа сопутствующих заболеваний |
|
Масса тела |
Несмотря на то что пациенты с ожирением имеют больше сопутствующих заболеваний и кардиоваскулярных факторов риска, количество геморрагических осложнений у них ниже, чем у пациентов с нормальной или сниженной массой тела |
|
Отягощенный аллергологический анамнез |
Отягощенный анамнез повышает риск аллергических реакций на препараты для анестезии и контрастное вещество |
|
Артериальная гипертензия |
Повышенное артериальное давление предрасполагает к сосудистым осложнениям |
|
Выраженный атеросклероз |
Атеросклеротическое поражение сердечно-сосудистой системы предрасполагает к холестериновой эмболии и диссекциям артерий |
|
Почечная недостаточность |
Снижение скорости клубочковой фильтрации менее 60 мл/мин повышает риск кровотечений и контраст-индуцированной нефропатии, часто наблюдается у пациентов старшего возраста, имеющих несколько сопутствующих заболеваний |
|
Сахарный диабет или сердечная недостаточность |
Данные заболевания предрасполагают к аритмиям и нарушениям проводимости, гипотонии, инфаркту миокарда, инсульту |
Наиболее часто забрюшинное кровотечение развивается при выполнении так называемой высокой пункции бедренной артерии [33]. Это объясняется анатомическими особенностями, в частности тем, что при выполнении «высокой» пункции, т.е. на уровне паховой связки, непосредственное место пункции находится выше связки, что приводит к трудностям в механическом прижатии артерии [34].
Пункция значительно ниже паховой складки также может привести к распространению крови в забрюшинное пространство по анатомическим межфасциальным пространствам [33].
Для предотвращения формирования подобного кровоизлияния многие авторы призывают использовать трансрадиальный доступ, что, по их данным, позволяет резко снизить риски развития этого грозного осложнения [8, 10, 35]. S. K. Kwok с соавт. (2018) сообщают, что переход на трансрадиальный доступ позволил достоверно снизить частоту формирования забрюшинных гематом, при этом авторы отмечают, что, по их данным, развитие этого грозного осложнения независимо ассоциируется с 3-кратным увеличением летальности и 5-кратным увеличением частоты развития сердечно-сосудистых осложнений в 30-дневный срок [36]. Другие авторы считают рутинное использование УЗИ-навигации при пункции артерии, использование 21G игл для пункции, а также проведение пункции в «безопасной зоне» достаточными для снижения частоты встречаемости постпункционных проблем [37, 38].
На наш взгляд, феморальный доступ является более предпочтительным для нейрорадиологических процедур, особенно в случаях необходимости проксимальной поддержки, при использовании коаксиальных систем при проведении по проводниковому катетеру «жесткого» инструментария, такого как потокотклоняющие стенты, что не противоречит данным литературы. Также доступ через бедренную артерию имеет в большинстве случаев более прямую и удобную для хирурга траекторию.
Ряд авторов относят к предикторам развития осложнений такие параметры, как возраст [39], прием антитромботических препаратов [13], а также женский пол. Женский пол являлся определяющим фактором, по данным нескольких исследований [13, 14]. Авторы связывают это с тем, что женщины являются более коморбидными [40], а также имеют ряд анатомических отличий, таких как более короткая общая бедренная артерия, сосуды меньшего диаметра и меньшая площадь для проведения безопасной пункции артерии [41, 42].
Одним из открытий стал факт, что пациенты с гиперхолестеринемией имеют большую предрасположенность к формированию ретроперитонеального кровотечения [36]. Ряд данных свидетельствует о наличии прямой корреляции риска формирования геморрагических осложнений с большим диаметром используемого для обеспечения сосудистого доступа интродьюсера [13, 43].
В обзоре британских авторов (2018) сообщается о 8% летальности в течение 30 дней после развития ретроперитонеального кровотечения, при этом в представленных данных 47% пациентов получали переливание компонентов крови, а 7% потребовали хирургического вмешательства для остановки продолжающегося кровотечения [36].
Материал и методы исследования
Нами были проанализированы истории болезни пациентов, получавших лечение в РНХИ им. проф. А.Л. Поленова в 2020 г. Всем этим пациентам выполнялась пункция бедренной артерии для проведения оперативного вмешательства или диагностической и контрольной церебральной и спинальной ангиографии.
Результаты исследования и их обсуждение
Среди 1025 пролеченных пациентов в раннем послеоперационном периоде было выявлено только два случая формирования забрюшинной гематомы. В обоих случаях формирование гематомы было заподозрено по клинической картине и подтверждалось экстренным проведением спиральной компьютерной томографии брюшной полости и забрюшинного пространства (без введения контрастного вещества). Исследование выполнялось на спиральном компьютерном томографе Philips Ingenuity, 126 срезов. Ширина первичного среза составила 1,5 мм, ширина после обработки — 18 мм. При проведении ангиографии использовалось контрастное вещество Омнипак 300.
В качестве демонстрации приводим два клинических наблюдения, иллюстрирующих формирование данного осложнения, а также разные варианты лечебной тактики.
Клинический пример 1
Пациентка 66 лет поступила в РНХИ для лечения аневризмы правой средней мозговой артерии (СМА). При анализе предоперационных ангиографий выявлено, что при данной архитектонике аневризмы, а именно при наличии ранней лобной ветви, отходящей от основания аневризмы (рис. 1), более предпочтительным для минимизации возможных ишемических осложнений будет являться проведение внутрисосудистого вмешательства – имплантация потокперенаправляющего стента.
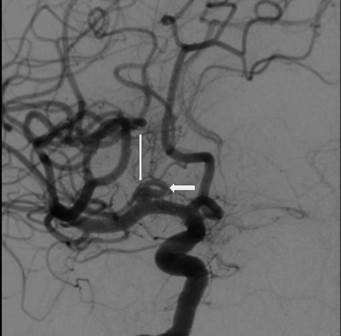
Рис. 1. Дооперационная правосторонняя каротидная ангиография в косой проекции, ранняя артериальная фаза. Тонкой стрелкой указана аневризма М1-сегмента правой СМА, толстой стрелкой указана ранняя лобная ветвь, отходящая от основания аневризмы
После проведения предоперационной подготовки (т. Клопидогрель 75 мг 1 раз в день – 5 дней, т. Ацетилсалициловой кислоты 100 мг 1 раз в день – 5 дней), а также контроля функциональной активности тромбоцитов выполнено оперативное вмешательство.
Операция проведена под общей анестезией, пункция артерии выполнялась на 2 см ниже паховой складки, использовался интродьюсер размера 7F. В М1-сегмент правой СМА был имплантирован потокперенаправляющий стент P64 (Phenox), вмешательство проведено без технических особенностей и интраоперационных осложнений, также интраоперационно производилось интраартериальное введение Гепарина 10000 ЕД. Пациентка была экстубирована на столе, нарастания неврологической симптоматики не выявлено, в дальнейшем больная переведена в отделение реанимации для динамического наблюдения.
Течение раннего послеоперационного периода (через 2 часа после операции) осложнилось клиническими проявлениями острой кровопотери (остро развились бледность кожных покровов, тахикардия 130 уд. в минуту, артериальная гипотензия до 70/40 мм рт. ст., снижение уровня гемоглобина со 124 г/л до 98 г/л), интродьюсер не удалялся, область пункции артерии без патологических изменений. Пациентке в экстренном порядке была выполнена СКТ брюшной полости, по данным которой выявлены имбибиция кровью правой поясничной мышцы, а также забрюшинной клетчатки (рис. 2).
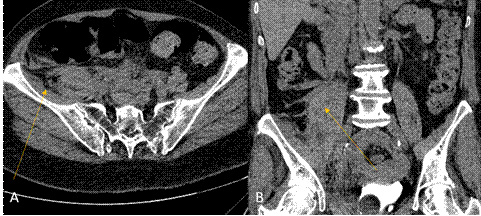
Рис. 2. СКТ брюшной полости после операции, без контрастного усиления. А – аксиальная проекция, В – коронарная. Стрелками указаны имбибиция поясничной мышцы и ретроперитонеальной клетчатки
В последующем, для исключения продолжающегося кровотечения из области пункции пациентка была доставлена в рентгеноперационную, ей выполнена субтракционная ангиография правой бедренной, подвздошных артерий, которая признаков экстравазации контрастного вещества не выявила (рис. 3).
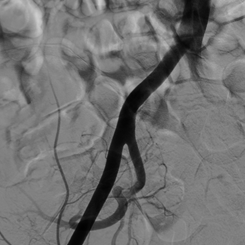
Рис. 3. Субтракционная ангиография правых бедренной, подвздошных артерий, ранняя артериальная фаза, данных за экстравазацию контрастного вещества не выявлено
С учетом отсутствия данных за продолжающееся кровотечение, стабилизацию лабораторных показателей и показателей гемодинамики было решено проводить консервативное лечение в виде инфузионной терапии. На этом фоне состояние пациентки улучшилось, больная была вертикализирована и выписана на амбулаторное наблюдение без неврологической симптоматики.
Клинический пример 2
Пациентка 56 лет поступила в отделение в плановом порядке с целью оперативного вмешательства по поводу сочетания стенотического поражения левой внутренней сонной артерии – ВСА (60%), а также множественных аневризм левой внутренней сонной артерии (офтальмического и коммуникантного сегментов) (рис. 4).
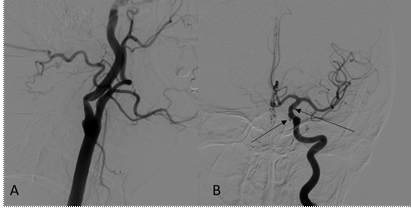
Рис. 4. Левосторонняя каротидная ангиография (А – боковая проекция, В – прямая проекция), ранняя артериальная фаза, демонстрирует сочетание каротидного стеноза и множественных аневризм (аневризмы указаны стрелками)
Сочетание симультанного поражения каротидного бассейна, а также «низкое» расположение аневризм делают пациентку «неудобной» для проведения открытого вмешательства, в связи с чем принято решение о проведении внутрисосудистой операции – стентирования области стеноза и установки потокперенаправляющего стента в левую ВСА.
Проведена плановая предоперационная дезагрегантная подготовка, после чего выполнено оперативное вмешательство – имплантация стента Casper (Microvention) в область стеноза ВСА и имплантация потокперенаправляющего стента Р64 (Phenox) в левую ВСА. Операция была проведена под общей анестезией, пункция артерии на 2 см ниже паховой складки, использовался аналогичный интродьюсер размера 7F.
В раннем послеоперационном периоде у пациентки также развилась клиническая картина геморрагического шока в виде снижения АД до уровня 60/30 мм рт. ст., тахикардия 140 уд. в минуту, профузная потливость; проведенная в экстренном порядке СКТ брюшной полости выявила формирование массивной забрюшинной гематомы (рис. 5), а снижение показателей гемоглобина в динамике (со 127 г/л до 70 г/л) вынудило заподозрить продолжающееся кровотечение, в связи с чем были выполнены ревизия области пункции, ушивание дефекта стенки поверхностной бедренной артерии, в дальнейшем произведена гемотрансфузия.
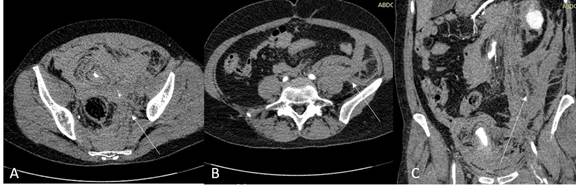
Рис. 5. СКТ брюшной полости, без контрастного усиления. А, В – аксиальные проекции, С – коронарная проекция, белыми стрелками указаны имбибированные кровью мягкие ткани и забрюшинная клетчатка
На этом фоне отмечалась положительная динамика состояния пациентки по лабораторным и клиническим показателям, пациентка была вертикализирована и выписана на амбулаторное лечение на 5-е сутки послеоперационного периода.
Заключение
Наши наблюдения, несмотря на малый объем выборки, подтверждают все вышеперечисленные причины формирования подобного осложнения. Обе наши пациентки имели женский пол и коморбидную патологию. Также характер поражения делал невозможными отмену дезагрегантной терапии, уменьшение размера используемого интродьюсера, применение радиального доступа, а также выбор иной тактики лечения в связи с более высокими рисками как интра-, так и постоперационных осложнений, которые в итоге могли привести как к грубой инвалидизации, так и к летальному исходу. В одном из описанных случаев нам успешно удалось придерживаться консервативного ведения, во втором продолжающееся кровотечение потребовало более агрессивной тактики.
Несмотря на возможность развития грозных осложнений, вышеописанная тактика продолжает оставаться общепринятой в нейрорадиологических центрах. Возможно рутинное применение интраоперационной УЗИ-навигации при пункции артерии, а, что более вероятно, использование ушивающих устройств для выполнения гемостаза поможет снизить частоту возникновения постпункционных осложнений, что, в свою очередь, приведет к исчезновению или минимизации послеоперационных проблем, а также снижению количества послеоперационных койко-дней.
Библиографическая ссылка
Горощенко С.А., Петров А.Е., Рожченко Л.В., Бобинов В.В., Коломин Е.Г., Самочерных К.А. ЗАБРЮШИННОЕ КРОВОТЕЧЕНИЕ КАК ОСЛОЖНЕНИЕ ПУНКЦИИ БЕДРЕННОЙ АРТЕРИИ // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32174 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.32174



