В последние десятилетия в мирном сосуществовании при различных ситуациях социальной напряженности и проявлении криминогенной обстановки в России отмечается прогрессивный рост частоты огнестрельных ранений (ОСР) [1].
По данным Национальной ассоциации медицинских экспертов и стандартов расследования случаев смерти (Нью-Йорк, 2013 г.), огнестрельное повреждение в судебно-медицинской экспертизе считается одним из сложнейших ее видов. Оно представляет собой серьезный вопрос в медицинской практике [2].
Основным фактором, вызывающим тканевые повреждения организма, представляется огнестрельное оружие и его элементы – дополнительные вещества снаряда (пороховые, металлические, копотные, масляные частицы). Они могут оказать разнообразное деструктивное воздействие на ткани организма [3].
Особенность патогенетического процесса данного типа травматизации состоит в том, что разрушение тканевой целостности организма в области ранения является последствием воздействия повреждающего агента физического характера, сопровождающегося изменением метаболизма клеток, их гибелью, тканевым распадом, расстройством локальной иммунной системы и микроциркуляции, высвобождением биологических медиаторов [4].
В патогенетическом процессе ОСР участвуют 4 фактора: ударно-волновой эффект ранящего снаряда, воздействие повреждающего агента, боковой удар самой пули, влияние вихревой струи, появляющейся позади повреждающего элемента.
По классификации Г.И. Назаренко и соавт. (2002) выявлено, что заживление раневого нарушения анатомической целостности проходит ряд стадий: фаза воспаления (стадия альтерации, экссудации, отторжения погибших элементов, обработки и очистки раны), фаза репарации (образование грануляций и их рубцевание с развитием соединительной ткани и закрытием раны) и фаза ремоделирования (период эпителизации рубца и его реорганизации с регенерацией утраченных тканевых структур) [5, 6].
В судебной медицине вопрос об определении давности и прижизненности возникновения повреждений в мягких тканях является одним из наиболее важных. В диагностике ОСР большую роль играет гистологический метод, которым можно оценивать реактивные изменения, возникающие на посттравматическом сроке.
Также в подробном исследовании огнестрельного ранения применяются и другие способы, такие как патоморфологический, иммуногистохимический, теплофизический [7, 8].
Цель работы заключается в использовании иммуногистохимического и морфометрического методов в диагностике огнестрельной травмы.
Материал и методы исследования
Проведено судебно-медицинское исследование 85 лиц, умерших от огнестрельных повреждений (первая группа, основная).
Известно, что определение давности раневого повреждения можно осуществлять при помощи морфометрического и иммуногистохимического методов [9].
Забор морфологического материала ОСР проведен на 1-е, 3-и, 5-е, 7-е и 10-е сутки смерти. Он был изъят из раневого канала.
В качестве сравнения использован материал, полученный от колото-резаного ранения (вторая группа, группа сравнения, n=30), на аналогичном сроке наступления смерти.
Полученные фрагменты тканей подвергали стандартной парафиновой оценке с помощью гистологических и гистохимических окрасок, стандартному иммуногистохимическому (ИГХ) исследованию по непрямому иммунопероксидазному методу.
Морфометрический анализ проводили с использованием объекта-микрометра при увеличении 10х20 диаметр поля зрения 880 мкм, при 10х40 диаметр поля зрения 460 мкм.
По данным литературы, в некротической зоне раневого канала отмечается утрачивание тонких структур. Ткань подвергается аутолизу с наличием кровоизлияний с быстрым гемолизом эритроцитов. В зависимости от срока смерти обнаруживается различная степень сосудистой реакции, которая проявляется в виде спазма сосудов разного диметра с развитием дистонии [10, 11].
Для установления прижизненности ОСР использовали ИГХ-маркер – фибриноген, а для оценки выраженности его характера применяли ИГХ-реакцию в виде деформации виментина. Фибриноген – бесцветный белок, растворенный в плазме крови, предшественник фибрина, проникающий в ткани сразу после повреждения сосудов и являющийся маркером прижизненности. Виментин — цитоплазматический белок промежуточных филаментов клеток соединительных тканей и других тканей мезодермального происхождения. В результате его пластичности клетка сохраняет целостность [12, 13].
В процессе секционного и последующего гистологического исследования с применением иммуногистохимического метода выполнен отбор мягких тканей из стенки огнестрельного канала. Материал фиксирован в нейтральном формалине. Далее проведена стандартная таксация материала с применением иммуностейнера и антител к фибриногену для мягких тканей в стенке раневого канала, к саркомерному актину, актину гладкомышечных клеток и виментину для клеточных элементов, к CD-антигенам для элементов клеточной реакции.
Полученные результаты обработаны программой «MS Exel 2013». Разница средних по значениям ошибки среднего (m), полученная в результате морфометрического анализа сравнения показателей раневых каналов огнестрельных и колото-резаных ранений, а также при расчете величины средних значений и отклонений, является достоверной.
Результаты исследования и их обсуждение
В результате сравнительного морфометрического исследования огнестрельных и колото-резаных повреждений получены следующие результаты, которые отражены в таблице.
Сравнение результатов морфометрии огнестрельных и колото-резаных повреждений
|
Объекты исследования |
Колото-резаные повреждения, 400х (сумма среднего, стандартное отклонение, ошибка среднего) |
Огнестрельные повреждения, 400х (сумма среднего, стандартное отклонение, ошибка среднего) |
|
Лимфоциты, до 30 минут после получения травмы |
||
|
Некроз |
21±2,4 m=0,8 |
10±2,0 m=0,6 |
|
ЗРИ/ЗМС |
14±2,2 m=0,7 |
22±5,1 m=1,6 |
|
Нейтрофилы, до 30 минут после получения травмы |
||
|
Некроз |
8±7,6 m=1,0 |
4±1,5 m=0,5 |
|
ЗРИ/ЗМС |
3±3,3 m=0,3 |
5±1,5 m=0,5 |
|
Макрофаги, до 30 минут после получения травмы |
||
|
Некроз |
3±3,4 m=0,4 |
1±0,4 m=0,1 |
|
ЗРИ/ЗМС |
2±1,5 m=0,2 |
2±0,7 m=0,2 |
|
Площадь поражения, до 30 минут после получения травмы |
||
|
Некроз |
1±0,1 m=0 |
1±0,1 m=0 |
|
ЗРИ/ЗМС |
1±0,1 m=0 |
1±0,1 m=0 |
|
Лимфоциты, через 3 суток после получения травмы |
||
|
Некроз |
25±7,5 m=2,4 |
13±3,3 m=1,0 |
|
ЗРИ/ЗМС |
23±3,3 m=1,0 |
11±2,4 m=0,8 |
|
Нейтрофилы, через 3 суток после получения травмы |
||
|
Некроз |
10±2,8 m=0,9 |
18±4,7 m=1,5 |
|
ЗРИ/ЗМС |
8±2,1 m=0,7 |
12±3,0 m=1,0 |
|
Макрофаги, через 3 суток после получения травмы |
||
|
Некроз |
10±3,1 m=1,0 |
7±1,9 m=0,6 |
|
ЗРИ/ЗМС |
9±2,8 m=0,9 |
6±1,8 m=0,6 |
|
Площадь поражения, через 3 суток после получения травмы |
||
|
Некроз |
1±0,1 m=0 |
1±0,1 m=0,1 |
|
ЗРИ/ЗМС |
1±0,1 m=0 |
1±0,2 m=0,1 |
|
Лимфоциты, через 5 суток после получения травмы |
||
|
Некроз |
25±6,5 m=2,1 |
11±3,2 m=1 |
|
ЗРИ/ЗМС |
20±2,4 m=0,8 |
9±2,7 m=0,8 |
|
Нейтрофилы, через 5 суток после получения травмы |
||
|
Некроз |
9±2,3 m=0,7 |
16±3,7 m=1,2 |
|
ЗРИ/ЗМС |
8±1,7 m=0,5 |
10±3,4 m=1,1 |
|
Макрофаги, через 5 суток после получения травмы |
||
|
Некроз |
10±2,4 m=0,8 |
8±1,9 m=0,6 |
|
ЗРИ/ЗМС |
8±1,9 m=0,6 |
7±1,5 m=0,5 |
|
Площадь поражения, через 5 суток после получения травмы |
||
|
Некроз |
1±0,1 m=0 |
1±0,2 m=0,1 |
|
ЗРИ/ЗМС |
1±0,1 m=0 |
1±0,2 m=0,1 |
|
Лимфоциты, через 7 суток после получения травмы |
||
|
Некроз |
12±3,1 m=1,0 |
13±3,1 m=1,0 |
|
ЗРИ/ЗМС |
9±2,1 m=0,7 |
10±2,1 m=0,7 |
|
Нейтрофилы, через 7 суток после получения травмы |
||
|
Некроз |
6±1,9 m=0,6 |
6±2,0 m=0,6 |
|
ЗРИ/ЗМС |
3±1,6 m=0,4 |
3±1,5 m=0,3 |
|
Макрофаги, через 7 суток после получения травмы |
||
|
Некроз |
13±2,7 m=0,8 |
15±2,7 m=0,8 |
|
ЗРИ/ЗМС |
11±1,8 m=0,6 |
11±1,8 m=0,6 |
|
Площадь поражения, через 7 суток после получения травмы |
||
|
Некроз |
1±0,1 m=0 |
1±0,1 m=0 |
|
ЗРИ/ЗМС |
1±0,2 m=0,1 |
1±0,2 m=0,1 |
|
Лимфоциты, через 10 суток после получения травмы |
||
|
Некроз |
7±1,5 m=0,5 |
10±2,7 m=0,9 |
|
ЗРИ/ЗМС |
7±2,2 m=0,7 |
12±2,0 m=0,6 |
|
Нейтрофилы, через 10 суток после получения травмы |
||
|
Некроз |
5±2,0 m=0,6 |
6±1,8 m=0,9 |
|
ЗРИ/ЗМС |
2±1,1 m=0,3 |
4±1,5 m=0,5 |
|
Макрофаги, через 10 суток после получения травмы |
||
|
Некроз |
14±2,5 m=0,8 |
15±2,5 m=0,8 |
|
ЗРИ/ЗМС |
12±2,3 m=0,7 |
15±3,2 m=1,0 |
|
Площадь поражения, через 10 суток после получения травмы |
||
|
Некроз |
1±0,2 m=0 |
1±0,2 m=0 |
|
ЗРИ/ЗМС |
1±0,2 m=0 |
1±0,1 m=0 |
Примечание. ЗРИ – зона реактивных изменений. ЗМС – зона молекулярного сотрясения
В таблице представлен материал исследования, который был распределен на 5 этапах: не более 30 минут, около 3-х, 5-х, 7-х и 10-х суток.
При давности ОСР не более 30 минут в первой группе количество лимфоцитов в зоне некроза преобладает над таким же показателем в аналогичной зоне огнестрельного повреждения. В зоне реактивных изменений при колото-резаном повреждении значительно понижено количество лимфоцитов в отличие от второй группы. В то же время количество нейтрофилов в зоне некроза группы сравнения значительно превышало показатели основной группы. При сравнении показателей макрофагов в соответствующих участках нами получены данные, которые показывают, что при колото-резаном повреждении количество макрофагов больше, чем при огнестрельном (таблица).
При давности ранения примерно 3 суток показано, что в зоне некроза лимфоциты преобладают в первой группе повреждения, в отличие от второй группы. Параллельно уровень нейтрофилов в зоне некроза был больше в основной группе относительно группы с колото-резаной травмой. Количество макрофагов имеет практически сходные значения в обеих группах.
При давности переживания травмы около 5 суток установлено, что в раневой области концентрация лимфоцитов была превышена в первой группе. Одновременно в некротической зоне количество нейтрофилов при огнестрельном ранении было больше, чем в группе сравнения. Таким образом, количество макрофагов в первой группе превышало такое во второй группе.
При давности травматизации 7 суток выявлено, что уровни лимфоцитов, нейтрофилов и макрофагов в исследуемых зонах как в первой группе, так и во второй по ходу наблюдения были соответственно равны.
При давности травмы 10 суток зарегистрировано, что количество лимфоцитов в раневой зоне в группе сравнения было меньше, чем в основной. В зоне молекулярного сотрясения концентрация лимфоцитов преобладала над реактивными изменениями в первой группе. Показатели нейтрофилов как в зоне некроза, так и в зоне молекулярного сотрясения группы сравнения незначительно превышали аналогичные показатели в группе сравнения. Количество макрофагов в зоне некроза и в зоне молекулярного сотрясения различается незначительно.
Мягкие ткани из области стенок раневых каналов были изучены с применением ИГХ-реакции и оценивались по следующим морфологическим признакам: наличие кровоизлияний, фрагментации мышечных и коллагеновых волокон, жировых кист при рутинных окрасках как в зоне некроза, так и в зоне молекулярного сотрясения; наличие мелких кровоизлияния в зоне молекулярного сотрясения при окраске по Шпильмайеру; наличие лизиса саркомерного актина в мышечных волокнах при постановке соответствующей реакции; значительная интенсивность ИГХ-реакции с антителами к фибриногену в толще мышечных волокон и в строме; выраженность ИГХ-реакции с антителами к виментину и гладкомышечному актину в сосудах зоны молекулярного сотрясения; наличие дезорганизации цитоархитектоники цитоскелета в сосудистых миоцитах. В других стромальных элементах отмечались потеря циркулярной ориентации в сосудах, денатурация по типу глыбчатого распада; оценка танатогенеза при танатогенетическом анализе; морфометрическая оценка лейкоцитарной реакции в зонах некроза и молекулярного сотрясения с уточнением типа лейкоцитов с учетом СD-антигенов.
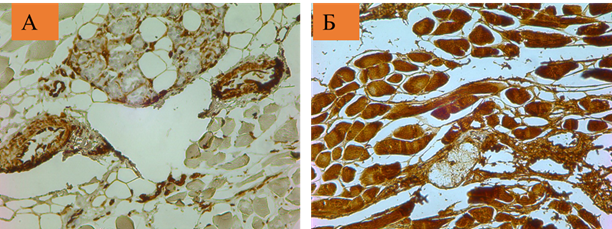
ИГХ-метод. Деформация виментина в стенках сосудов – а, имбибиция фибриногеном мышечных волокон – б
Прижизненные огнестрельные ранения характеризуются экссудацией фибриногена; наличием деформации цитоскелета (виментина); наличием отека, жировых кист и кровоизлияний в стенке раневого канала; наличием дезорганизации цитоархитектоники внутриклеточных сократительных и других промежуточных филаментов мышечных и других стромальных клеток в зоне молекулярного сотрясения; имбибицией плазменными белками мышечных волокон в зоне молекулярного сотрясения при ее отсутствии в зоне некроза, в том числе термического (рисунок). Интенсивность ИГХ-реакции с антителами к фибриногену в области молекулярного сотрясения значительно выше, чем в интактной ткани области дермы и подкожной клетчатке интактных мягких тканей кожи.
При давности травмы не более 30 минут при огнестрельных повреждениях отмечается замедление воспалительной реакции по отношению к колото-резаным ранам в зоне реактивных изменений. На более поздних сроках переживания происходит выравнивание воспалительной реакции.
Эти отличия могут быть связаны как со специфическими факторами выстрела, в частности термическим действием, так и с более выраженными изменениями микроциркуляции и клеточной миграции при огнестрельных повреждениях в сравнении с колото-резаными ранами.
Изучая вопрос определения танатогенеза при смерти от различных огнестрельных повреждений, целесообразно применять методы танатогенетического (полуколичественного) анализа, который позволит на основании доступного морфологического исследования составить суждения о виде смерти, темпе умирания и других вопросах танатогенеза, а также исходя из этих данных можно уточнить выводы о давности огнестрельных повреждений.
Выводы
1. Основным морфологическим признакам огнестрельного ранения служит наличие кровоизлияний, фрагментации мышечных и коллагеновых волокон, жировых кист.
2. В гистологической диагностике огнестрельной травмы применяется ряд методов, таких как иммуногистохимические и полуколичественные, позволяющие определить в тканях организма вещества, которые не могут быть диагностированы рутинными методами исследования.
Библиографическая ссылка
Збруева Ю.В., Семёнов Г.Г., Путинцев В.А., Богомолов Д.В., Джуваляков П.Г. ПРИМЕНЕНИЕ КОМПЛЕКСНОГО МЕТОДА АНАЛИЗА В СУДЕБНО-ГИСТОЛОГИЧЕСКОЙ ДИАГНОСТИКЕ ДАВНОСТИ И ПРИЖИЗНЕННОСТИ ПОВРЕЖДЕНИЙ МЯГКИХ ТКАНЕЙ ПРИ ОГНЕСТРЕЛЬНОЙ ТРАВМЕ // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32168 (дата обращения: 03.02.2026).
DOI: https://doi.org/10.17513/spno.32168



