Рекоарктация аорты (реКоАо) - это формирование реобструкции после первичной коррекции коарктации аорты (КоАо). Частота развития варьирует от 5% до 50% в зависимости от диагностических критериев [1]. Среди наиболее значимых факторов риска выделяют: инфузию простагландина, возраст младше 1 мес. и низкий вес пациента в предоперационном периоде, оставленную дуктальную ткань при первичной коррекции и не диагностированную или заведомо не устраненную гипоплазию дуги аорты. Гипоплазия дуги аорты является наиболее распространенной патологией, сочетающейся с КоАо, с частотой встречаемости до 70% [2]. В большом количестве исследований была выявлена взаимосвязь артериальной гипертензии (АГ) с гипоплазией дуги аорты [2]. Предполагается, что причиной АГ является измененное морфологическое строение стенки аорты, заключающееся в дисбалансе эластиновых и коллагеновых волокон и приводящее к увеличению «жесткости» гипоплазированного участка [3]. Именно поэтому АГ остается серьезной проблемой даже после успешного устранения КоАо.
Таким образом, понятие реКоАо включает не только формирование рестеноза непосредственно на участке коррекции, но также не диагностированную и/или не устраненную гипоплазию дуги аорты при выполнении первичной операции, с которой и связана клиническая картина и формирование АГ, что является основной причиной летальных исходов [4].
Целью данного исследования является оценка эффективности и безопасности хирургического лечения реКоАо у детей через срединную стернотомию в условиях антеградной селективной церебральной перфузии (АСЦП) с учетом непосредственных и отдаленных результатов, а также клинико-демографических и анатомических особенностей порока.
Материалы и методы исследования
Проведение исследования было одобрено локальным этическим комитетом Томского национального исследовательского медицинского центра Научно-исследовательского института кардиологии, № 139, 14.02.2019. За последние 12 лет в КХО № 2 было прооперировано 380 пациентов с КоАо и реКоАо, в том числе в сочетании с другими врожденными пороками сердца (ВПС). В данное исследование был включен 201 пациент, которым выполнялись хирургические вмешательства по поводу КоАо или реКоАо, а также проводилась оценка динамики градиента на дуге аорты с помощью эхокардиографии (ЭхоКГ) и непрямого измерения артериального давления (АД), отмечалось наличие АГ и прием антигипертензивной терапии в послеоперационном периоде. Все пациенты с КоАо или реКоАо имели сопутствующую тубулярную гипоплазию дуги аорты или полисегментарные стенозы как ее эквивалент. Тубулярная гипоплазия дуги аорты устанавливалась при Z-score ≤ − 2.
Критериями включения в исследование являлись: плановая операция по поводу коарктации/рекоарктации аорты с гемодинамически незначимыми врожденными аномалиями сердечно-сосудистой системы, добровольное информированное согласие пациента в письменной форме.
Критериями исключения из проспективной части исследования являются отсутствие согласия пациента и период новорожденности.
Первичные конечные точки исследования – формирование реКоАо и развитие АГ. Вторичные конечные точки исследования – частота послеоперационных осложнений, длительность искусственной вентиляции легких (ИВЛ), частота развития и длительность острого почечного повреждения (ОПП) в послеоперационном периоде, динамика ренального и церебрального NIRS в интра- и послеоперационном периоде, показатели неврологического статуса пациента и наличие АГ в послеоперационном периоде. Измерение АД выполнялось с использованием кардиомонитора Drager Infinity Delta XL (Dragerwerk AG, Германия). Суточный мониторинг АД выполнялся в период госпитализации пациента с помощью монитора ABPM – 04 (Meditech, Венгрия). Эхо-КГ исследование выполнялось на ультразвуковой системе ViviD Q (GE Healthcare, США). МСКТ с внутривенным контрастированием являлась базовым методом диагностики наряду с ЭхоКГ. Все исследования выполнялись на гибридном томографе Discovery NM/CT 570c (GE Healthcare, США) с последующим построением 3D-компьютерной реконструкции и измерением различных отделов аорты на требуемых участках. В качестве контраста использовался препарат Ultravist-370 (Guerber France, Франция).
Хирургический доступ для пациентов с КоАо заключался в выполнении срединной стернотомии, перикардиотомии и инициации искусственного кровообращения (ИК) по стандартной методике. Пациентам с реКоАо выполнялась срединная ре- или стернотомия с последующим кардиолизом и выделением дуги и нисходящего отдела аорты в рубцово-измененных тканях с инициацией ИК по методике, идентичной группе с КоАо.
Выбор хирургической техники на основном этапе операции зависел от клинико-демографических характеристик и анатомических особенностей пациентов с реКоАо. Всего использовались три различные методики: расширение участка КоАо/реКоАо и дуги аорты заплатой, резекция участка КоАо/реКоАо с протезированием линейным сосудистым протезом или резекция участка КоАо и реКоАо с широким косым анастомозом «конец в конец».
Все пациенты были разделены на две группы: I группа - повторные пациенты (с реКоАо в сочетании с гипоплазией дуги, 49 пациентов) и II группа - первичные пациенты (с КоАо в сочетании с гипоплазией дуги, 152 пациента). В каждой исследуемой группе пациенты подразделялись на 5 подгрупп в зависимости от возраста (табл. 1).
Таблица 1
Возрастные группы пациентов с КоАо и реКоАо
|
Группа |
Возраст |
РеКоАо, n=49 |
КоАо, n=152 |
|
1 группа |
1 мес. – 1 год |
14 |
53 |
|
2 группа |
1 – 3 года |
4 |
13 |
|
3 группа |
3 – 6 лет |
3 |
37 |
|
4 группа |
6 – 12 лет |
17 |
31 |
|
5 группа |
12 – 18 лет |
11 |
18 |
Полученные группы статистически значимо различались по таким параметрам, как систолическое и диастолическое АД (p=0.024 и p=0.001 соответственно).
С целью получения сопоставимых групп сравнения была применена балансная статистическая методика propensity score matching. В модель сопоставления был включено 15 предоперационных параметров, способных оказать влияние на конечные точки исследования. Таким образом, были получены две группы, по 44 пациента в каждой, сопоставимые по всем основным и наиболее значимым параметрам. После псевдорандомизации выполнялся сравнительный анализ полученных групп: группа I (реКоАо), группа II (КоАо). Основные характеристики пациентов, включенных в исследование, представлены в таблице 2.
Таблица 2
Основные предоперационные показатели пациентов обеих групп
|
Показатель |
I группа, n=44 |
II группа, n=44 |
p-value |
|
Возрастная подгруппа |
|||
|
1 группа (1 мес. – 1 год), n (%) |
11 |
11 |
1,0 |
|
2 группа (1 – 3 года), n (%) |
3 |
3 |
1,0 |
|
3 группа (3 – 6 лет), n (%) |
3 |
3 |
1,0 |
|
4 группа (6 – 12 лет), n (%) |
16 |
16 |
1,0 |
|
5 группа (12 – 18 лет), n (%) |
11 |
11 |
1,0 |
|
Мужской пол, n (%) |
29 (65,9) |
22 (50) |
0,131 |
|
Вес, Me (Q25-Q75%) |
27,5 (8,4; 46) |
27 (8,85; 50) |
0,947 |
|
Сопутствующие пороки |
|||
|
БАК, n (%) |
27 (61,3) |
28 (63,6) |
0,826 |
|
ОАП, n (%) |
0 |
7 (15,9) |
0,006 |
|
ДМПП/ООО, n (%) |
0 |
8 (18,1) |
0,003 |
|
Аберр. ЛПКА, n (%) |
4 (9) |
4 (9) |
1,0 |
|
Результаты инструментальных исследований |
|||
|
САД рука, Me (Q25-Q75%), мм рт. ст. |
117,5 (105; 134) |
126,5 (111,5; 137,5) |
0,299 |
|
ДАД рука, Me (Q25-Q75%), мм рт. ст. |
63,5 (56,5; 72,5) |
74,5 (64; 83,5) |
0,004 |
|
САД нога, Me (Q25-Q75%), мм рт. ст. |
105 (93,5; 130) |
103 (87,5; 113,5) |
0,165 |
|
ДАД нога, Me (Q25-Q75%), мм рт. ст. |
62,5 (53; 73,5) |
58,5 (49; 73) |
0,289 |
|
Градиент САД рука/нога, Me (Q25-Q75%) |
15,5 (2; 30,5) |
21,5 (11,5; 34) |
0,073 |
|
Градиент ДАД рука/нога, Me (Q25-Q75%) |
0 (-8,5; 13) |
12 (4; 25,5) |
0,001 |
|
Пик ЭхоКГ градиент, Me (Q25-Q75%) |
45 (36,5; 53,5) |
48,5 (38,5; 59) |
0,218 |
|
Ср. ЭхоКГ градиент, Me (Q25-Q75%) |
19,5 (15; 26) |
21 (18; 27) |
0,279 |
Методы статистической обработки
Статистическая обработка результатов проводилась с помощью программного комплекса SPSS 23.0 for Windows (IBM Corp., Armonk, NY, USA) в сочетании с пакетом R for Windows (R Development Core Team, Vienna, Austria). Псевдорандомизация сравниваемых групп проводилась с помощью балансной статистической методики propensity score matching с использованием поиска ближайшего соседа при соотношении «случай – контроль», равном 1:1. Для статистического анализа количественных данных использовался критерий Манна - Уитни. Для анализа качественных показателей применялся критерий χ2 Пирсона и точный критерий Фишера. Для оценки прогноза риска возникновения АГ в отдаленном послеоперационном периоде был проведен анализ выживаемости Каплана - Майера. Все статистические показатели считались достоверными при p <0,05.
Результаты исследования и их обсуждение
Непосредственные результаты
Несмотря на большую продолжительность времени окклюзии Ао (p=0,006) и АСЦП (p=0,001) во II группе, общее время ИК было ожидаемо выше в I группе (p=0,038). Между тем интраоперационные значения церебрального и ренального NIRS, а также уровень лактата плазмы не различались между группами (табл. 3).
Таблица 3
Основные интраоперационные показатели пациентов обеих групп
|
Показатель |
I группа |
II группа |
p-value |
|
cNIRS начало операции, % |
72±8,5 |
70±10 |
0,055 |
|
cNIRS АСЦП, % |
80,3±9,1 |
81,1±7,6 |
0,069 |
|
cNIRS конец операции, % |
72±6,5 |
71±7,7 |
0,12 |
|
rNIRS начало операции, % |
65±11,1 |
67±7,0 |
0,072 |
|
rNIRS АСЦП, % |
47±5,5 |
50±4,2 |
0,079 |
|
rNIRS конец операции, % |
67±6,0 |
68±9,4 |
0,061 |
|
Лактат начало операции, ммоль/л, Me (Q25-Q75%) |
1,5±0,5 |
1,2±0,3 |
0,07 |
|
Лактат АСЦП, ммоль/л, Me (Q25-Q75%) |
1,7±0,6 |
1,4±0,7 |
0,08 |
|
Лактат конец операции, ммоль/л, Me (Q25-Q75%) |
1,6±0,3 |
1,7±0,4 |
0,083 |
|
Общее время ИК, Me (Q25-Q75%), мин. |
130 (69,5; 149,5) |
92 (74; 125) |
0,038 |
|
Время окклюзии Ао, Me (Q25-Q75%), мин. |
32 (30; 37) |
40 (30; 48,5) |
0,006 |
|
Время АСЦП, Me (Q25-Q75%), мин. |
26 (23; 29) |
35 (25; 40,5) |
0,001 |
При анализе используемых хирургических методик были обнаружены значимые различия в их распределении. Наиболее распространенной хирургической методикой в I группе (50%) была пластика дуги аорты заплатой, в то время как во II группе наиболее распространенной методикой (50%) стало протезирование аорты линейным протезом (табл. 4). Средний возраст пациентов для выполнения широкого косого анастомоза «конец в конец» для I группы составил 20,9 мес., для II группы – 35,4 мес., для пластики заплатой в I группе составил – 111 мес., а во II группе – 99 мес. И средний возраст для протезирования в I группе составил – 133 мес., а во II группе – 138 мес.
Таблица 4
Распределение хирургических методик в обеих группах
|
Методика |
I группа |
II группа |
|
Анастомоз конец в конец, n (%) |
12 (27,3) |
19 (43,2) |
|
Пластика заплатой, n (%) |
22 (50) |
3 (6,8) |
|
Протезирование, n (%) |
10 (22,7) |
22 (50) |
В послеоперационном периоде уровень лактата статистически значимо не различался как после 12 ч (p=0,079), так и после 24 ч (p=0,08) наблюдения.
При оценке неврологического статуса у пациентов обеих групп не были выявлены статистически значимые различия по уровню церебрального NIRS через 12 (p=0,083) и 24 часа (p=0,063), а также уровню сознания после экстубации. При анализе продолжительности ИВЛ в послеоперационном периоде также не было выявлено статистически значимых межгрупповых различий (p=0,059). По результатам осмотра невролога, наличие очаговой симптоматики не отмечалось ни в одной из групп.
Анализ данных ренального NIRS не выявил статистически значимых различий между группами через 12 (p=0,055) и 24 часа (p=0,072). Первая стадия ОПП в соответствии с критериями AKIN была выявлена в обеих группах (p=0,088). Лечение осуществлялось путем коррекции объема введенной и выделенной жидкости, а также внутривенного введения лазикса.
Время пребывания пациентов в палате интенсивной терапии (ПИТ) значимо не различалось между группами (p=0,069).
При анализе послеоперационных осложнений было обнаружено, что в I группе частота послеоперационных кровотечений, потребовавших ревизии послеоперационной раны, и частота хилоторакса, лечение которого у двух пациентов осуществлялось диетой и назначением октреотида, а у одного пациента потребовалась хирургическая ревизия с клипированием грудного лимфатического протока, были значимо выше (p=0,04).
При расчете систолического и диастолического градиента АД между верхними и нижними конечностями было отмечено его значимое снижение в обеих группах (p=0,058) и (p=0,261).
По данным послеоперационной ЭхоКГ, гемодинамически значимый остаточный градиент не определялся ни у одного из прооперированных пациентов (p=0,155).
При выписке из стационара количество пациентов, которым требовался прием антигипертензивной терапии, значимо не различалось между группами (p=0,56).
Таблица 5
Послеоперационные показатели пациентов обеих групп
|
Показатель |
I группа |
II группа |
p-value |
|
cNIRS 12 ч в ПИТ, %, Me (Q25-Q75%) |
70±6,3 |
71±9,7 |
0,083 |
|
cNIRS 24 ч в ПИТ, %, Me (Q25-Q75%) |
72±8,3 |
70±11,2 |
0,063 |
|
rNIRS 12 ч в ПИТ, %, Me (Q25-Q75%) |
69±3,1 |
65±4,0 |
0,055 |
|
rNIRS 24 ч в ПИТ, %, Me (Q25-Q75%) |
67±6,6 |
66±7,7 |
0,072 |
|
Время ИВЛ, ч, Me (Q25-Q75%) |
11±8 |
14±7 |
0,059 |
|
ОПП (ст. 1), n (%) |
3 |
4 |
0,055 |
|
Лактат 12 ч в ПИТ, ммоль/л, Me (Q25-Q75%) |
1,7±0,7 |
1,3±0,3 |
0,079 |
|
Лактат 24 ч в ПИТ, ммоль/л, Me (Q25-Q75%) |
1,5±0,6 |
1,8±0,2 |
0,08 |
|
Время пребывания в ПИТ, сут., Me (Q25-Q75%) |
1,7±0,9 |
1,5±0,7 |
0,069 |
|
П/о кровотечения, n П/о хилоторакс, n |
2 3 |
2 0 |
1 0,001 |
|
САД рука, мм рт. ст., Me (Q25-Q75%) |
113,5 (102; 123,5) |
112 (100,5; 116,5) |
0,269 |
|
ДАД рука, мм рт. ст., Me (Q25-Q75%) |
61,5 (53,5; 66) |
64,5 (60; 74) |
0,053 |
|
САД нога, мм рт. ст., Me (Q25-Q75%) |
107 (94; 130,5) |
119,5 (111,5; 125,5) |
0,143 |
|
ДАД нога, мм рт. ст., Me (Q25-Q75%) |
65 (54; 72) |
65 (55; 74,5) |
0,605 |
|
Градиент САД рука/нога, мм рт. ст., Me (Q25-Q75%) |
-4 (-11; 18) |
-7 (-13; -2,5) |
0,058 |
|
Градиент ДАД рука/нога, мм рт. ст., Me (Q25-Q75%) |
-3,5 (-15,5; 5) |
0 (-7; 6,5) |
0,261 |
|
Пик ЭхоКГ градиент, мм рт. ст., Me (Q25-Q75%) |
0 (0; 2,5) |
0 (0; 8,5) |
0,155 |
|
Ср. ЭхоКГ градиент, мм рт. ст., Me (Q25-Q75%) |
0 (0; 0) |
0 (0; 3,5) |
0,104 |
|
Прием АГ терапии, n (%) |
6 (13,6) |
8 (18,1) |
0,56 |
Отдаленные результаты
Для оценки прогноза риска возникновения АГ в отдаленном послеоперационном периоде был проведен анализ выживаемости Каплана - Майера. Послеоперационное наблюдение за пациентами продолжалось 169 месяцев. Во II группе медиана времени с момента операции до появления АГ составила 138 месяцев, 95% CI (128;157), в I группе - 149 месяцев, 95% CI (133;169).
В течение одного года после операции случаев возникновения АГ в обеих группах зарегистрировано не было. Спустя 3 года возникновение АГ было отмечено у 1,3% детей во II группе и у 2,1% детей в I группе. За пятилетний период наблюдения число зарегистрированных случаев АГ у прооперированных детей увеличилось до 6% во II группе и не изменилось в I группе. На рисунке приведены кривые Каплана - Майера для обеих групп (КоАо – синий цвет, реКоАо – красный цвет). Сравнение рисков возникновения АГ в группах по логранговому критерию статистически значимых различий не выявило (р=0,23).
Помимо анализа АД в послеоперационном периоде, всем пациентам выполнялось ЭхоКГ-исследование. У всех пациентов определялся магистральный спектр кровотока в брюшной аорте и не обнаруживались данные за реКоАо.
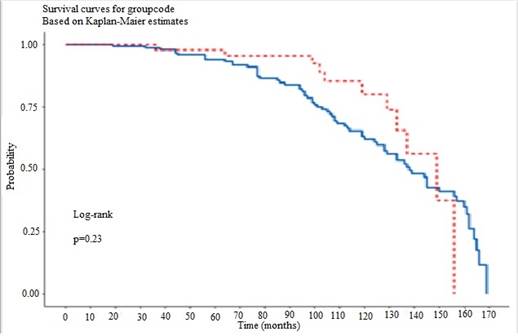
Возникновение артериальной гипертензии в I (красный цвет) и во II группе (синий цвет)
С момента первой успешной коррекции КоАо, выполненной Crafoord и Nilyn, прошло уже более 80 лет [5]. За почти вековую историю изучения заболевания данные о выживаемости пациентов свидетельствуют о достаточно серьезном снижении продолжительности жизни пациентов с КоАо относительно здоровых людей. Проведя сравнительный анализ 30-летней выживаемости пациентов с прооперированной КоАо в 1989 и 2014 годах, обнаружили, что 10-летняя выживаемость выросла на 2,3%, 20-летняя на 2,4%, а 30-летняя на 1,5% [6]. Примечательно, что улучшения в хирургической технике, новые возможности лечения АГ, наблюдение за сопутствующими заболеваниями не оказывают влияния на отдаленную выживаемость. В структуре развития резидуальной АГ при КоАо можно выделить две составляющие: первая – аномалии сосудистой стенки, к которым относятся повышенная жесткость, эндотелиальная дисфункция и нарушения в ренин-ангиотензиновой системе, вторая – реКоАо, в 70% случаев сочетающаяся с тубулярной гипоплазией дуги аорты [7]. Несмотря на определенные успехи применения эндоваскулярных методов коррекции реКоАо, радикальное лечение реКоАо в сочетании с гипоплазией дуги аорты возможно только хирургически.
Непосредственные результаты лечения реКоАо, как и КоАо, состоят из двух компонентов: непосредственно хирургической техники и используемой методики нейро- и органопротекции. Об эффективности хирургической техники можно судить по наличию остаточного градиента на дуге аорты и послеоперационным осложнениям как в ближайшем, так и в отдаленном периодах. Оценка эффективности нейро- и органопротекции путем мониторирования интра- и послеоперационных показателей носит лишь прогностический характер. Поэтому большинство клиник нашей страны и мира руководствуются личным опытом в выборе хирургической методики и способа нейро- и органопротекции.
Одним из наиболее распространенных осложнений ИК и АСЦП у детей является ОПП, встречающееся до 30% случаев и являющееся одной из главных причин летальных исходов [8; 9]. Наиболее важными факторами риска ОПП у детей являются: возраст, время ИК и АСЦП, ламинарный ток крови во время ИК и воспалительный ответ [9; 10]. В качестве мониторинга интра- и послеоперационной оценки степени повреждения почек был выбран NIRS. Во-первых, метод позволяет оценивать адекватность перфузии в реальном времени, а во-вторых, NIRS показал лучшую достоверность в качестве предиктора развития ОПП в сравнении с биомаркерами [8]. В качестве оценки стадии ОПП при нарушениях почечной функции была выбрана классификация AKIN, которая является наиболее удобной в ежедневной клинической практике и не требует выполнения дорогостоящих исследований.
Оценка неврологического статуса детей, особенно младшего возраста, является серьезной и широко обсуждаемой проблемой. Сложность заключается в невозможности объективной оценки неврологического статуса ребенка ввиду незрелости ЦНС. В качестве прогностической методики оценки интра- и послеоперационных осложнений был выбран мониторинг церебрального NIRS. Другим важнейшим параметром является продолжительность ИВЛ, поскольку при отсутствии признаков органной дисфункции отсутствие спонтанного респираторного драйва у детей является важнейшим признаком повреждения ЦНС. В нашем исследовании не было значимых межгрупповых различий по всем описанным показателям [11].
Таким образом, антеградная селективная церебральная перфузия, применявшаяся в качестве метода нейро- и органопротекции в проведенном нами исследовании, продемонстрировала отсутствие межгрупповых различий по всем исследуемым показателям, что говорит о возможности ее применения как при первичных, так и при повторных вмешательствах, без увеличения рисков и частоты осложнений.
С точки зрения хирургических осложнений (кровотечения, повреждения нервных волокон и лимфатических сосудов) повторные операции, безусловно, несут гораздо больший риск, чем первичные вмешательства, поскольку требуется выполнение рестернотомии, кардиолиза и выделения магистральных сосудов в рубцово-измененных тканях. В нашем исследовании число осложнений в I группе было выше, чем во II группе. Среди них были послеоперационные кровотечения, по поводу чего выполнялась хирургическая ревизия и хилоторакс, лечение которого в двух случаях осуществлялось диетой и назначением октреотида, в одном случае требовалась хирургическая ревизия с клипированием грудного лимфатического протока.
При анализе используемых хирургических техник были обнаружены значимые межгрупповые различия в их распределении.
Резекция с широким косым анастомозом конец в конец была выполнена во II группе в 43% случаев, а в I группе в 27%. Во II группе методика имела более широкое применение относительно максимального возраста пациентов. Все же мы считаем это хорошим результатом для пациентов с реКоАо, поскольку методика позволяет полностью нивелировать использование инородных материалов. Главным фактором, ограничивающим применение данного метода, является эластичность стенки аорты, которая закономерно снижается с возрастом пациентов и естественно ниже у пациентов с реКоАо.
Артериальная гипертензия является основным пусковым механизмом в развитии осложнений, приводящих к летальному исходу, и остается серьезной проблемой у пациентов с прооперированной КоАо и реКоАо. Несмотря на большие возможности терапевтического лечения АГ, его эффективность гораздо выше при отсутствии структурных изменений (обструкций) дуги аорты, которые можно устранить только оперативным путем. При проведении ЭхоКГ в ближайшем и отдаленном послеоперационном периоде, реКоАо не обнаруживалась ни в одной из групп. Новые случаи развития АГ также не были зарегистрированы. Результаты 5-летнего периода наблюдений продемонстрировали, что у 6% пациентов II группы произошло развитие АГ, в I группе новых случаев АГ обнаружено не было.
К сожалению, все большее число публикаций подтверждают, что КоАо, особенно в сочетании с гипоплазией дуги аорты, является системной патологией с огромным риском развития АГ в отдаленном периоде. Тем не менее радикальное хирургическое устранение участка обструкции с формированием анатомически правильной формы дуги аорты снижает вероятность и тяжесть развития АГ в отдаленном периоде, что, в свою очередь, позволяет с большей эффективностью осуществить подбор антигипертензивной терапии.
Выводы
1. Хирургическое лечение рекоарктации аорты сопровождалось более высокой частотой послеоперационных осложнений (p=0,04). Наиболее распространенным осложнением являлся хилоторакс, который встретился в 6,8% случаев среди пациентов I группы. Несмотря на это, тяжесть и длительность послеоперационного периода не различались между группами. Летальных исходов в исследовании зафиксировано не было.
2. В исследовании не было выявлено неврологических осложнений среди пациентов I группы, что было полностью сопоставимо с результатами первичных вмешательств.
3. За пятилетний период наблюдения число зарегистрированных случаев АГ у прооперированных детей I группы не изменилось, а во II группе выросло на 6%. Сравнение рисков возникновения АГ в обеих группах по логранговому критерию статистически значимых различий не выявило (р=0,23).
4. Резекцию реКоАо с наложением расширенного косого анастомоза «конец в конец» возможно выполнить у детей в возрасте до 21 мес., а пластику дуги аорты с помощью заплаты - детям до 9,5 лет. У детей старше 9,5 лет необходимо использовать линейные сосудистые протезы.
Библиографическая ссылка
Егунов О.А., Кривощеков Е.В., Баянкина В.М., Кожанов Р.С. РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ РЕКОАРКТАЦИИ АОРТЫ У ДЕТЕЙ С УЧЕТОМ КЛИНИКО-ДЕМОГРАФИЧЕСКИХ И АНАТОМИЧЕСКИХ ОСОБЕННОСТЕЙ ПОРОКА // Современные проблемы науки и образования. 2022. № 5. ;URL: https://science-education.ru/ru/article/view?id=32142 (дата обращения: 01.01.2026).
DOI: https://doi.org/10.17513/spno.32142



