Грыжи брюшной стенки являются наиболее частым состоянием, требующим только хирургического вмешательства. Наиболее сложными в плане лечения являются послеоперационные (после лапаротомий) и рецидивные грыжи, которые возникают с частотой от 8% до 16%. В линейке этой патологии растущую проблему представляют большие грыжи W3 (от 12 до 25 см в поперечнике и 25–30 см продольном направлении) [1–3]. У таких пациентов наиболее часто в послеоперационном периоде возникают ранние и поздние осложнения (компартмент-синдром, гематомы, свищи, отторжение аллоимпланта и др.), встречающиеся до 25% и выше, влияющие на качество жизни оперированных. Рецидивы после операций у этого контингента пациентов достигают 40%. Поэтому многие исследователи высказываются в пользу разработки новых эффективных методик хирургического лечения [4–6].
Из-за латерализации и сокращения прямых и косых и поперечных мышц живота размеры грыжевых ворот увеличиваются, при пластике возникает натяжение. Поэтому в зависимости от протяженности дефекта брюшной стенки, конституции пациента для восстановления ее анатомических структур применяются различные способы оперативных вмешательств [7, 8].
В 1990-х гг. получило распространение предложение по использованию разделенных компонентов передней брюшной стенки в открытой пластике (O.M. Ramirez, 1990). При выполнении такой техники хирург не применяет инородные материалы. При этом достигается увеличение мобильности брюшной стенки до 8 см с каждой стороны. Недостатком этого вмешательства является большая травматичность тканей, приводящая к образованию гематом, сером и, как следствие, к длительному заживлению раны [9]. Предложенная A.M. Carbonell в 2008 г. техника по разделению заднего компонента передней брюшной стенки (впоследствии модифицированная и названная TAR) увеличила мобилизацию передней брюшной стенки до 6 см, но не в полной мере ликвидировала травматичность вмешательства [10, 11]. Рецидивы при этих вмешательствах достигают от 4% до 32%, а осложнения, такие как послеоперационная боль, слабость стенки, деформация, снижают качество жизни оперированных.
Цель работы: оценить эффективность применения предложенного устройства для интраоперационного вытяжения мышечно-фасциальных структур передней брюшной стенки, используемых для закрытия ее дефектов.
Материалы и методы исследования
Главным принципом применения предлагаемого устройства является создание раздельной равномерно направленной тяги на мышечно-фасциальные компоненты по обоим краям передней брюшной стенки за внешнюю жестко фиксированную опору (Заявка на полезную модель № 2022115771 от 10.06.2022 г.). Оно состоит из 2 раздельных вертикальных стоек, 2 планок-подвесов с насечками, 2 ходовых винтов со штурвалами, а также спиц (рис. 1).
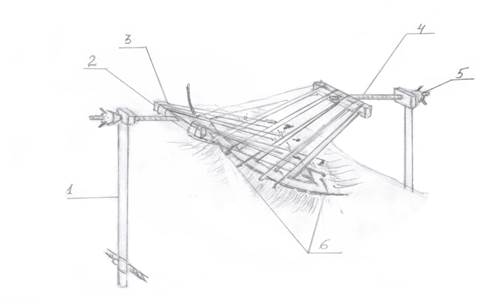
Рис. 1. Схема вытяжного устройства (1 – вертикальная стойка; 2 – планка-подвес; 3 – насечки на планке; 4 – ходовой винт; 5 – штурвал; 6 – спицы-протекторы)
После выделения грыжевого мешка и иссечения брюшины выделяли края дефекта передней брюшной стенки (передний и задний листки апоневроза без вскрытия влагалища прямой мышцы). Параллельно направлению хода волокон прямой мышцы между апоневротическими листками, по всей длине дефекта проводили спицы – как слева, так и справа (рис. 2).
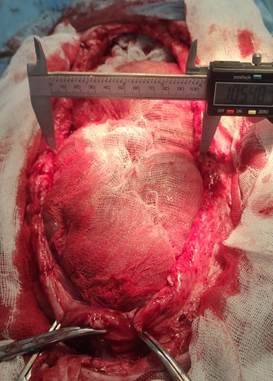
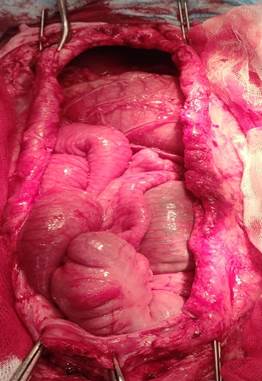
А Б
Рис. 2. Внешний вид дефекта передней брюшной стенки (А – ширина дефекта до вытяжения 11,5 см – W3; Б – спицы-протекторы проведены между апоневротическими листками)
После этого накладывали швы, которые проходят позади спиц через каждые 15–20 мм как на левый, так и на правый край передней брюшной стенки. Швы закрепляли через прорези (насечки) на планке-подвесе натяжного механизма, укрепленного на противоположней стороне раны. За счет раздельной жесткой конструкции швы натягиваются индивидуально. Используя нити как рычаги между фиксированной передней брюшной стенкой и планкой-подвесом натяжного механизма, фасциальную тягу можно увеличивать за счет гайки-штурвала. Фасциальные края оттягиваются под углом 45° по отношению к горизонтальной плоскости. Диагонально-вертикальное вытяжение во всех случаях проводили с усилием 12 кг, продолжительностью 25–40 минут. В период вытяжения швы подтягивали при помощи натяжного механизма каждые 5 минут. Это противодействовало естественной мышечной тяге. Проведенные спицы обеспечивали равномерное распределение тяги на всех участках передней брюшной стенки без прорезывания тканей (рис. 3).


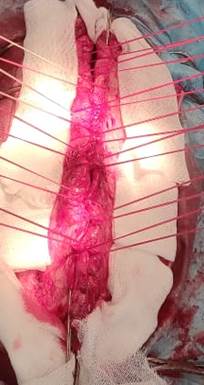
А Б В
Рис. 3. Изменение фасциального расстояния в зависимости от времени тракции (А – через 15 мин; Б – 30 мин; В – 40 мин)
Эксперимент проведен на животных (свиньях), которым ранее в различные сроки моделировали послеоперационные грыжи. Оперативное пособие и все манипуляции с животными реализовались с использованием общего обезболивания, регламентированного Приложением № 8 («Правило гуманного обращения с лабораторными животными», «Санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клеток (вивариев)» (№ 1045-73), а также приказом № 727 от 1984 г. Министерства высшего образования СССР «Правила проведения работ с экспериментальными животными». Исследование проведено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации о гуманном отношении к лабораторным животным (2000 г.), Директивой Европейского сообщества (86/609 ЕС) и правилами лабораторной практики в Российской Федерации (приказ МЗ РФ № 267 от 19.06.2003 г.).
Животные (10 самок свиней весом 25–30 кг), как правило, содержались в виварии до повторной операции. Продолжительность эксперимента – от 7 до 30 суток. Операции проводили под ингаляционным наркозом (севоран в дозе МАК 2–2,5 об. %) и общей анестезией (золетил – 100 в/м 15 мг/кг) с соблюдением правил асептики. Анестезию контролировали непрерывным мониторингом ЭКГ, артериального давления, капнометрии и минутным объемом дыхания. В качестве обезболивания в послеоперационном периоде использовали раствор кеторола 1,0 × 3 раза в день в/м. Антибактериальная терапия проводилась цефтриаксоном в дозе 50–75 мг/кг 1 раз в сутки в/м.
Клинический материал составили 11 пациентов с послеоперационными и рецидивными грыжами W3. Из них с рецидивными грыжами (R1) было 4 пациента, R2 – 5 пациентов, R3 – 2 пациента. Возраст оперированных колебался от 43 до73 лет. Мужчин – 7 пациентов, женщин – 4. Во время тракции передней брюшной стенки больные находились под тотальной медикаментозной миоплегией. Длительность тракции передней брюшной стенки с обеих сторон составила от 25 до 35 мин.
Критерием включения было наличие послеоперационной и/или рецидивной вентральной грыжи с шириной дефекта более 10 см (W3).
Критерии исключения: ХОБЛ, ХСН 2Б и выше, трофические и гнойно-воспалительные изменения в проекции послеоперационного рубца.
Статистическая обработка проводилась методом вариационной статистики с вычислением среднеарифметической и среднеквадратического отклонения с использованием модуля Statistica 11.0.
Результаты исследования и их обсуждение. В эксперименте частота закрытия, достигнутая с помощью вытяжного устройства, после вытяжения в зависимости от размеров грыжевых ворот была высокой и составила от 84% до 95%. Продолжительность оперативного пособия, включая время тракции в эксперименте, составила 203,40±19,0 мин. В таблице 1 отражены размеры дефектов в апоневрозе до и после использования вытяжного механизма, сокращение фасциального расстояния в %, а также время тракции.
Таблица 1
Изменения ширины грыжевого дефекта в зависимости от его ширины и времени тракции (см; мин; %)
|
№ опыта |
Ширина дефекта до вытяжения (см) |
Ширина дефекта после вытяжения (см) |
Ширина фасциального расстояния (%) |
Время тракции (мин) |
|
1. |
12,5 |
1,9 |
84,8% |
25 |
|
2. |
11.2 |
0,8 |
92,9% |
25 |
|
3. |
10,8 |
0,5 |
95,4% |
25 |
|
4. |
14,3 |
1,6 |
88,8% |
35 |
|
5. |
15,1 |
2,1 |
86,1% |
35 |
|
6. |
10,4 |
0,3 |
97,1% |
25 |
|
7. |
13,3 |
0,9 |
93,2% |
35 |
|
8. |
14,2 |
1,2 |
91,5% |
40 |
|
9. |
13,5 |
0,6 |
95,6% |
35 |
|
10. |
16,1 |
1,9 |
88,2% |
40 |
При анализе результатов интраоперационного вытяжения мышечно-апоневротических структур было отмечено значительное стабильное уменьшение расстояния до фасции. Более чем у половины экспериментальных животных сокращение фасциального расстояние составило свыше 90%, у остальных экспериментальных животных – более 80%.
При пластике передней брюшной стенки в группе животных, у которых сокращение фасциального расстояния составило более 90%, пластику передней брюшной стенки проводили сшиванием апоневроза узловыми швами «край в край» без апоневротической дупликатуры. У животных с сокращением фасциального расстояния от 80% до 90% проводили пластику с использованием кожного аутотрансплантата, подготовленного по предложенной методике (Заявка на изобретение № 2022103233 от 09.02.2022 г.) с расположением трансплантата sublay.
Клинический анализ результатов показал (несмотря на отсутствие статистического анализа из-за небольшого числа случаев), что не совсем ожидаемые результаты, с точки зрения сокращения фасциального расстояния, были у пациентов с грыжами, локализующимися после верхнесрединных лапаротомий, и у мужчин. Таких пациентов было 3. Эта процедура была более эффективна при локализации дефекта от средне- и нижнесрединных лапаротомий.
Среднее значение фасциального расстояния до операции составило 12,6±0,3 см. У 7 пациентов сокращение фасциального расстояния было более 90%. В 3 случаях оно составило более 80%. И в 1 случае сокращение дистанции составило 75%. У 3 пациентов с сокращением фасциального расстояния более чем на 95% пластика проведена путем сшивания апоневроза край в край без дупликатуры. У остальных был использован аутодермальный трансплантат помещенный sublay. Длительность операции в среднем составила 210,16±14,3 мин с учетом вытяжения мышечно-апоневротических структур и фиксации аутодермального трансплантата. Объем кровопотери в среднем составил 300,36±81,06 мл. Ранние осложнения возникли у 2 пациентов в виде сером в подкожно-жировой клетчатке, которые были диагностированы сонографически и не требовали пункции. По классификации Clavien-Dindo – I степень осложнений. На наш взгляд, эти осложнения возникли как следствие раннего удаления активного дренажа. Компартмент-синдром у больных не диагностирован. Осложнений, связанных с проведением анестезии, не регистрировали. Среднее время пребывания в клинике составило 7,5±1,6 койко-дня. Сроки возвращения трудоспособности в среднем составили 23,12±2,1 дня. При наблюдении пациентов в течение 6–24 месяцев рецидива заболевания не было отмечено.
Настоящее исследование подтверждает результаты немногочисленных работ по определению воздействия тяговой силы на переднюю брюшную стенку, показывающих высокую результативность и низкий уровень осложнений. Приложение регулированной тяговой силы представляет собой развитие метода [12, 13].
При достигнутом уровне растяжения выше 90% и больших дефектах эффективность интраоперационного вытяжения мышечно-апоневратических структур передней брюшной стенки была высока. При сокращении фасциального расстояния более чем на 80% положительный результат достигается за счет применения биологического подготовленного трансплантата.
При различных вмешательствах по разделению анатомических структур передней брюшной стенки целостность ее не сохраняется, а травматичность вмешательства приводит к нарушению кровообращения вследствие пересечения многочисленных сосудов, в том числе и перфорантных. Это приводит к осложнениям (таким как серомы, инфекции, гематомы, некроз брюшной стенки, нарушения чувствительности). По данных некоторых авторов, после разделения передних компонентов осложнения возникают у 42,9% больных, а после разделения заднего компонента – у 31,2%. При этом общая частота инфицирования раны при малоинвазивных или эндоскопических вмешательствах составляет 20,6%, а для открытых компонентных расслоений – 34,6%. Частота повторных операций после разделения компонентов, в том числе и эндоскопическими методами, составила от 12% до 19% [14, 15].
Применение вытяжного устройства позволяет провести минимально травматичную препаровку слоев передней брюшной стенки, что дает возможность избежать большинства осложнений, характерных для сепарационных методов.
Заключение. Предложенное устройство для интраоперационного вытяжения мышечно-фасциальных структур передней брюшной стенки предполагает многообещающий подход в качестве инновационного варианта лечения больших послеоперационных грыж. Настоящее исследование показывает высокую эффективность интраоперационной тракции фасций при хорошей клинической осуществимости и низкой частоте осложнений.
Библиографическая ссылка
Топчиев А.М., Протасов А.В., Федосеев А.В., Топчиев М.А., Паршин Д.С., Самсонов А.В. ВОЗМОЖНОСТИ ИНТРАОПЕРАЦИОННОГО ВЫТЯЖЕНИЯ МЫШЕЧНО- ФАСЦИАЛЬНЫХ СТРУКТУР ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ КАК ЭТАП ПОДГОТОВКИ ИХ К ПЛАСТИКЕ ПРИ ПОСЛЕОПЕРАЦИОННЫХ ГРЫЖАХ W3 // Современные проблемы науки и образования. 2022. № 5. ;URL: https://science-education.ru/ru/article/view?id=32137 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/spno.32137



