Рак легкого (РЛ) по-прежнему самая смертоносная злокачественная опухоль в развитых странах мира. Хирургический метод остается ключевым в лечении операбельного РЛ. Сброс воздуха по плевральным дренажам нередко возникает после операций на легких из-за повреждения легочной паренхимы. Частота сброса воздуха после резекции легкого составляет от 25% до 50% в 1-й день после операции и до 20% во 2-й день [1; 2]. Сброс воздуха в большинстве случаев прекращается самопроизвольно, но когда он продолжается на 5–7-е сутки после операции, то такое состояние называется длительной утечкой воздуха (ДУВ) и относится к послеоперационным осложнениям [3; 4]. Утечка воздуха есть сообщение альвеол легочной паренхимы дистальнее сегментарного бронха с плевральной полостью [4]. ДУВ определяется Обществом торакальных хирургов (Society of Thoracic Surgeons) как утечка воздуха, сохраняющаяся более 5 дней после операции. ДУВ развивается у от 5% до 25% больных, перенесших резекции легких, и является наиболее частым послеоперационным осложнением после плановой резекции легкого [5-7].
ДУВ требует длительного дренирования плевральной полости, что усиливает послеоперационную боль, вызывая поверхностное дыхание, затрудненное откашливание, что приводит к повышенному риску развития пневмонии, а также снижению подвижности, сопровождающемуся высоким риском тромбоэмболических осложнений [1]. ДУВ отрицательно влияет на течение послеоперационного периода. Частота развития эмпиемы составляет 10,4% при сбросе воздуха более 7 дней по сравнению с 1% при утечках воздуха менее или равных 7 дням (р = 0,01) [8; 9]. Кроме того, лечение осложнения связано с необходимостью выполнения дополнительных инвазивных вмешательств, таких как химический плевродез или повторная операция [10]. ДУВ связана с увеличением госпитальной летальности; пациенты с утечкой воздуха имеют в 3,4 раза больший риск умереть, чем больные без нее (95% CI: 1,9–6,2) [11]. Очевидно, что ДУВ негативно влияет на сроки начала адъювантного лечения [12; 13].
Больные с ДУВ значительно дольше пребывают в больнице, что приводит к увеличению затрат. Пациенты с длительным сбросом воздуха после резекции легкого имели среднюю продолжительность пребывания 7,2 против 4,8 дня (р <0,001) по сравнению с теми, у кого осложнения не было, что сопровождалось 30%-ным увеличением расходов на стационарное лечение [11]. Подобные результаты отмечены и в группе больных с видеоассистированной торакоскопической (VATS) резекцией легкого, со средней продолжительностью пребывания в больнице почти в два раза большей по сравнению с пациентами без ДУВ: 11,7 против 6,5 дней (р <0,001) [14]. Частота повторного перевода после операции в отделение интенсивной терапии при ДУВ составляет 9% против 5% (p = 0.05), что вызвано дыхательной недостаточностью вследствие развития пневмонии [15]. Кроме того, частота ДУВ была в два раза выше среди больных, потребовавших повторной госпитализации и операции на лёгком: 21,4% против 10,2% (p <0.001) [16].
Когда факторы риска осложнений определены и используются для разработки проверенных, высокоточных алгоритмов стратификации рисков, появляется возможность оптимизировать их профилактику и лечение. В торакальной хирургии ДУВ после резекции легкого является одним из таких осложнений. С учетом существенного влияния ДУВ на состояние больных необходим простой инструмент, помогающий до операции идентифицировать пациентов, имеющих высокий риск развития осложнения. Обзор преследует цель всестороннего обсуждения факторов риска возникновения ДУВ у больных, перенесших резекцию легких по поводу рака, и подходов к созданию применимой модели прогнозирования для стратификации риска. Понимание проблемы даст возможность разрабатывать более эффективные способы прогнозирования, предупреждения и лечения ДУВ во избежание её последствий, позволив хирургам сосредоточить свое внимание и ресурсы на больных с повышенным риском.
Цель исследования: проанализировать результаты современных научных исследований, отражающих проблему факторов риска и прогнозирования длительной утечки воздуха после резекции лёгкого у больных раком лёгкого.
Материал и методы исследования. В литературном обзоре выполнен анализ современных российских и зарубежных (исключительно на английском языке) научных работ, значимых относительно темы обзора и представленных в базах данных eLibrary, PubMed, Scopus и в научной электронной библиотеке «КиберЛенинка» (Cyberleninka).
Результаты исследования и их обсуждение
Факторы риска ДУВ.
Факторы риска развития ДУВ целесообразно подразделять на факторы исходного состояния больных, операционные хирургические факторы и факторы послеоперационного ведения, которые в принципе соответствуют предоперационным, периоперационным и послеоперационным факторам риска.
Касательно демографического статуса больных: пожилой возраст, курение в анамнезе и более низкий индекс массы тела (ИМТ) определены как факторы риска. Именно они обусловливают «хрупкость» легочной паренхимы и пониженную способность к заживлению повреждений.
Взаимосвязь между возрастом и частотой развития ДУВ изучалась в большом количестве исследований [5; 14; 17], метаанализ которых показал, что пожилой возраст не значимый фактор риска ДУВ в качестве бинарной переменной (OR = 1,40, 95% CI: 0,87 - 2,37; р = 0,051), в то время как достоверный в качестве непрерывной переменной (MD = 1,82, 95% CI: 1,04 - 2,58; р <0,001) [8]. Повышенный риск ДУВ достоверно связан с более низким ИМТ [5,15,18(25)] (OR= 2,12, 95%CI от 1,20 до 3,45, р = 0,017) [8] и мужским полом (OR= 1,69, 95%CI от 1,45 до 1,98, р<0,001) [5; 18; 19]. Интересно, что ИМТ обратно пропорционален частоте ДУВ, такая отрицательная корреляция предположительно обусловлена тем, что у больных с ожирением микроокружение поврежденных тканей более благоприятно для их герметизации [5].
Доказано, что курение непосредственно влияет на выработку коллагена, а вызванная табачным дымом локальная иммуносупрессия дыхательных путей способствует хроническому течению воспалительного процесса. Курение в анамнезе значительно увеличивает риск ДУВ (OR= 1,84, 95% CI от 1,45 до 2,31, р<0,001) [5; 20; 21]. Риск ДУВ повышался с нарастанием индекса курения (MD = 8,07, 95%CI от 5,04 до 11,09, р<0,001) [15; 19; 22]. Системное использование кортикостероидов также достоверно увеличивало риск развития ДУВ (р= 0,031) [5; 23; 24].
Установлено, что три сопутствующих заболевания в значительной степени связаны с повышенным риском ДУВ. Результаты объединенного анализа в зависимости от конкретной сопутствующей патологии распределились следующим образом: хроническая обструктивная болезнь легких (ХОБЛ), о которой сообщается в 9 исследованиях OR= 2.05, 95% CI: 1,43-2,73; р = 0,002 [21; 25; 26]; эмфизема легких OR= 2,35, 95% CI: 1,18 - 5,01; р = 0,036 [20; 23]; и цереброваскулярные заболевания OR= 2,16, 95%, CI: 1,13 - 3,99; р = 0,013 [27-29]. В то время как сахарный диабет не связан с риском развития ДУВ (р = 0,408) [24; 30; 31].
Функциональное состояние дыхательной системы до операции является важной составляющей исходного статуса пациентов. Параметры, указывающие на дисфункцию легких с учетом сопутствующей ХОБЛ и эмфиземы, а именно низкие показатели ОФВ1, ОФВ1/ФЖЕЛ% и DLCO (скорость поглощения СО на единицу альвеолярного РСО во всём лёгком), в значительной степени ассоциируются с ДУВ. Более низкий от прогнозируемого процент диффузионной емкости легких (DLCO%), что установлено при анализе 8 исследований [17; 29; 30], существенно увеличивал риск ДУВ (MD = -8,76, 95%CI: от -11,06 до -6,34; р<0,001) [8]. Подобная взаимосвязь замечена для более низких показателей ОФВ1 (MD= -0,22, 95% CI: от -0,38 до -0,05, р = 0,024) и более низком ОФВ1 в процентах от прогнозируемого (ОФВ1%) (MD =-7,91, 95% CI: от-9,44 до -6,33; р <0,001) [18; 20; 30]. Метаанализ 7 исследований [18; 19; 27] также показал, что более низкое соотношение ОФВ1 к ФЖЕЛ (ОФВ1/ФЖЕЛ%) способствует повышению риска развития ДУВ OR=1,99, 95% CI: 1,22–3,33; р = 0,005 [8]. У больных с нарушенной функцией легких, как правило, наблюдается повышенное сопротивление дыхательных путей и патологические изменения паренхимы, которые связаны с нарушением процессов заживления. Количественная оценка функциональных показателей системы дыхания способствует реализации мероприятий по интраоперационной профилактике ДУВ. Эмфизема также может быть количественно определена как индекс эмфиземы с использованием компьютерной томографии (КТ) и его вычислением с помощью программного обеспечения в течение нескольких минут. Поскольку КТ обязательный метод визуализации немелкоклеточного РЛ (НМРЛ), тем более при планировании хирургического лечения, количественная оценка выраженности эмфиземы не создаст пациенту дополнительной задержки в обследовании. Если перед операцией проводится выявление больных с высоким риском развития ДУВ, для предотвращения последней рационально использовать интраоперационную профилактику, используя укрепление линии механического шва, фибриновый клей и другие хирургические герметики [32].
Исходный статус больных кандидатов для хирургического вмешательства оценивался по шкале Зуброда в 3 исследованиях [5; 19; 27]. Достоверной ассоциации между плохим исходным статусом и повышенным риском ДУВ не выявлено (OR= 1,50, 95% CI : 0,75–2,78; р = 0,06), так же как и не обнаружено связи между оценкой по шкале ASA (American Society of Anesthesiology) и увеличением частоты ДУВ (р = 0,088) [8]. Показатели гемоглобина (р=0,057) и сывороточного альбумина (р = 0,052) не ассоциировались с риском ДУВ [18; 24; 30]. Однако частота ДУВ оказалась существенно выше у больных, получавших неоадъювантную химиотерапию (OR= 1,49, 95%CI 0,86–2,58, р = 0,03) [20; 24].
Объединенный анализ данных 7 исследований [15; 22; 33] дал достоверный OR=1,45, 95%CI: 0,99–2,04; р = 0,021, который свидетельствует о повышении частоты ДУВ при злокачественных новообразованиях по сравнению с доброкачественной патологией легких. Больные с морфологически подтвержденным метастатическим поражением лимфатических узлов - III стадией НМРЛ имели более высокий риск ДУВ по сравнению с больными I–II стадии по классификации TNM (р = 0,003) [8].
При анализе данных нескольких исследований установлено, что торакотомия значительно увеличивала риск ДУВ по сравнению с малоинвазивной VATS-хирургией (р = 0,009) [29; 34; 35]. Кроме того, обнаружено, что верхняя лобэктомия является фактором риска более высокой частоты развития ДУВ, чем нижняя или средняя лобэктомия (OR = 1,22, 95% CI: 0,92–1,63; р <0,04) [8]. Верхняя лобэктомия сопровождается значительным риском развития ДУВ вследствие образования остаточной апикальной плевральной полости с плохой аппозицией листков висцеральной и париетальной плевры. Однако частота ДУВ не различалась между резекциями левого и правого легкого (р = 0,233). Швы легочной паренхимы большей длины увеличивают риск ДУВ [22].
Интраоперационные предикторы ДУВ включают: плевральные сращения (спайки), слабо выраженные междолевые борозды и традиционную оперативную технику. Наличие плевральных сращений значительно увеличивало риск развития ДУВ (р <0,001), что подтверждено анализом данных ряда исследований [14; 36; 37]. Доказано, что слабо выраженные междолевые борозды (OR= 6,58, 95% CI: 2,11–21,13; р = 0,004) и традиционная техника оперирования в такой ситуации (OR= 2,14, 95% CI: 1,31–3,66; р = 0,003) также являются существенными факторами риска развития ДУВ.
В отличие от исходного статуса пациентов, хирурги осуществляют непосредственный контроль за мануальной техникой хирургического приема. Установлено, что создание плеврального тента является безопасным способом снижения частоты ДУВ после верхних лобэктомий. Следует избегать некоторых хирургических манипуляций, которые рассматриваются как факторы риска, например обширной, особенно «тупой» диссекции слабо выраженных междолевых борозд. Некоторые авторы пропагандируют так называемый однонаправленный способ оперирования, призывающий выполнять резекцию легкого в строгом порядке, избегая непрерывных манипуляций с долями и тем самым уменьшая повреждение паренхимы.
A. Attaar с сотр. выявили, что хирурги с высокой ежегодной нагрузкой становятся значимым предиктором риска развития ДУВ, объясняя сложившуюся ситуацию тем, что хирурги, выполняющие большее количество операций, вероятно, чаще оперируют больных с более высоким исходным риском ДУВ, исключив данный фактор из разработанной ими прогностической модели [5]. Н. Elsayed с коллегами обнаружили, что конкретный хирург может ассоциироваться с более высоким риском развития ДУВ, что, по их мнению, связано с привычками хирурга, например к рутинному подключению плевральных дренажей к вакуумной аспирации после операции [15]. Мастерство хирурга и/или их привычки являются весьма субъективными факторами риска. Вместе с тем необходимы дальнейшие исследования для выявления влияния деятельности хирургов на частоту ДУВ.
Современный метаанализ 39 исследований с участием 89.006 пациентов показал, что ДУВ остается наиболее частым послеоперационным осложнением после резекций легкого по поводу РЛ, составляя в среднем 15% от всех перенесших операцию [8]. Среди множества изучаемых факторов в настоящее время установлено, что 22 из них достоверно ассоциируются с риском развития ДУВ. Пять факторов риска, включая курение в анамнезе (OR =1,84, 95% CI: 1,45 - 2,31; р<0,001), прием стероидов перед операцией (OR= 1,51, 95% CI: 0,87 - 2,65; р = 0,031), более низкий показатель соотношения ОФВ1/ФЖЕЛ% (OR =1,99, 95% CI: 1,22 - 3,33; р = 0,005), бесфиссурную технику диссекции долей легкого (OR = 2,14, 95% CI: 1,31 - 3,66; р = 0,003) и постхирургическую/патологическую III-IV стадию по классификации НМРЛ TNM (OR = 1,50, 95% CI: 1,07 - 2,12; р = 0,003), отличаются высоким качеством доказательств [8], предоставляя исследователям обновленную информацию для стратификации риска. Вместе с тем необходимы дальнейшие углубленные исследования для расширения охвата факторов риска и создания широко применимой модели прогнозирования ДУВ для совершенствования профилактики и снижения частоты данного осложнения.
Прогнозирование ДУВ
В последние десятилетия торакальные хирурги прилагают максимум усилий для обеспечения безопасности хирургического лечения РЛ прежде всего за счет предотвращения послеоперационных осложнений. Применяется ряд усовершенствований и инноваций в хирургическом методе: строгие алгоритмы послеоперационного ведения дренажей плевральной полости, создание плевральных тентов, использование степлеров с рассасывающимися прокладками, хирургических герметиков, распыление биологического клея и интраоперационного плевродеза. Перечисленные способы, безусловно, помогают снизить количество ДУВ, однако существуют некоторые ограничения для их рутинного употребления, включая непригодность ко всем без исключения больным и увеличение затрат. Таким образом, очень важно применять специальные подходы выборочно у пациентов с высоким риском развития ДУВ, который следует прогнозировать заранее. Многие исследовательские группы предложили шкалы оценки и номограммы для прогнозирования риска ДУВ (табл. 1) [20; 38; 39].
Таблица 1
Исследования, посвященные созданию прогностических моделей ДУВ
|
Автор, страна, центр. |
Годы исследования |
Количество больных |
ДУВ (%) |
Модель |
Факторы риска в модели |
|
Brunelli А. et al. 2004 Италия [32] |
1995–2003 |
588 |
16 |
Шкала оценки |
ОФВ1, спайки, верхняя лобэктомия |
|
Pompili C. et al. 2017 UK [18] |
2007–2015 |
5069 |
9,9 |
Шкала оценки |
Мужчины, ИМТ, ОФВ1 |
|
Oh S.G. et al. 2017 Корея [28] |
2005–2009 |
720 |
18,75 |
Шкала оценки |
Возраст, спайки, ИМТ, ОФВ1 |
|
Kim W.H. et al. 2017 Корея [16] |
2013–2015 |
1060 |
19 |
Формула |
Мужчины, возраст, ИМТ, ОФВ1, торакотомия, большая резекция легкого, однолёгочная вентиляция более 2 часов |
|
Attaar А. et al. 2017 США STS GTSD [5] |
2009–2014 |
2317 |
8,6 |
Номограмма |
ИМТ, ОФВ1, курение, шкала Zubrod, вид операции, торакотомия справа, атипичная резекция |
|
Viti A. et al. 2018 Италия [23] |
2014–2017 |
459 |
15,7 |
Шкала оценки |
Мужчины, ИМТ, ОФВ1, курение, спайки, эмфизема, время операции, исходный статус |
|
Pan H. et al. 2019 Китай [20] |
2015–2017 |
493 |
10,8 |
Номограмма |
Возраст, ОВФ1/ФЖЭЛ%, ИМТ, курение, правая сторона, спайки, длина линии шва |
|
Seder C. W.et al. 2019 CША STS GTSD [6] |
2009–2016 |
52.198 |
10,4 |
Шкала оценки |
Мужчины, ИМТ, лобэктомия или билобэктомия, ОФВ1 |
В 2004 г. A. Brunelli с коллегами предпринята попытка объединить факторы риска в модели прогнозирования, которую можно было бы использовать в клинической практике или в исследовательских целях для стратификации риска ДУВ. В результате ретроспективного анализа данных 588 пациентов, перенесших лобэктомию по поводу РЛ, была предложена шкала оценки риска ДУВ, включающая следующие переменные: ОФВ1, плевральные сращения и резекции верхних долей. Однако интерпретация ретроспективных данных, по мнению самих авторов, часто осложняется их разнородностью и возможными ошибками отбора [40; 41].
В связи с этим в последующем ими проведен многоцентровой анализ наблюдений с использованием перспективных электронных баз данных, включивших все последовательные лобэктомии, выполненные в центре с января 2000 г. по апрель 2008 г., которые использовались в качестве исходного набора для разработки системы оценки, прогнозирующей риск ДУВ. Затем шкала оценки риска валидировалась на выборке пациентов, прооперированных в другом центре (центр В) с 2006 по 2008 г. В обоих центрах применялись стандартизированные методы послеоперационного ведения больных, описанные ниже [42]. Больные, перенесшие комбинированные операции с резекцией грудной стенки или диафрагмы, или те, кто после операции нуждался в искусственной вентиляции легких (ИВЛ), были исключены. Лобэктомии выполнялись щадящим мышцы и нервы переднебоковым торакотомным доступом сертифицированными торакальными хирургами.
Ни у одного из пациентов не использовались плевральные тенты, хирургические герметики, укрепление линии механического шва или пневмоперитонеум. Механические степлеры применялись у всех больных для ушивания бронхов и для диссекции слабо выраженных или полностью отсутствующих междолевых борозд у 80% пациентов. Полные или «пленчатые» междолевые борозды не потребовали использования степлеров у 20% больных. Систематическая медиастинальная лимфодиссекция выполнялась всем пациентам.
По завершении операции наличие утечки воздуха проверяли путем погружения паренхимы легкого в стерильный физиологический раствор с раздуванием легкого до устойчивого давления от 25 до 30 см H2O. Если обнаруживалась какая-либо значительная утечка воздуха из лёгкого, предпринималась попытка её устранения наложением отдельных швов на паренхиму. По завершении операции плевральная полость дренировалась двумя или одной дренажными трубками. Дренажи подключали к отсосу при отрицательном давлении -15 см H2O до утра после оперативного вмешательства, а затем использовали режим альтернативной аспирации: водяной затвор в течение дня и активная аспирация в ночное время. Физическая реабилитация проводились всем больным, начиная с первого послеоперационного дня [9].
После получения рентгенограмм грудной клетки, показывающих полное расправление оставшейся части легкого, дренажи из плевральной полости удаляли, если сброс воздуха по ним отсутствовал, а объем отделяемого из плевральной полости составлял менее 400 мл за предыдущие 24 часа. Когда наличие утечки воздуха казалось сомнительным, проводилось провокативное пережатие дренажей в течение 12 часов; если не возникало одышки, подкожной эмфиземы, снижения сатурации кислорода, дренажи удаляли [42].
Опираясь на новые данные, авторы пересмотрели и валидировали свою шкалу в 2010 г. [45 (32)]. В первоначальной выборке с участием 658 больных, перенесших лобэктомии, ДУВ развилась у 87 (13%) пациентов. После ROC-анализа числовых переменных пошаговая логистическая регрессия выявила следующие значимые и надежные предикторы ДУВ: возраст старше 65 лет, наличие плевральных спаек, ОФВ1 менее 80% от прогнозируемого и ИМТ менее 25,5 кг/м2. Оценка факторов риска, основанная на их коэффициентах, представлена в таблице 2.
Таблица 2
Совокупная оценка риска длительной утечки воздуха
|
Критерий |
Балл |
|
Возраст старше 65 лет |
1 |
|
Наличие плевральных спаек |
1 |
|
ОФВ1 < 80% |
1,5 |
|
ИМТ < 25.5 кг/м2 |
2 |
Для получения совокупного балла индивидуальные баллы суммировались у каждого больного в диапазоне от 0 до 5,5. В качестве примера: 70-летний пациент с ОФВ1= 60%, ИМТ =23 кг/м2 и с плевральными спайками получил бы максимальную оценку в 5,5 баллов [38]. Затем больные относились к классу риска в соответствии с их совокупными баллами. Риск ДУВ постепенно увеличивался с каждым классом: класс A (0 баллов) – 1,4%; класс B (1 балл) - 5,0%; класс C (1,5–3 балла) - 12,5%; класс D (более 3 баллов) - 29,0%, которые достоверно ассоциировались с увеличением риска ДУВ в валидационной выборке из 233 больных [32].
L. Lee с соавт. разработали инструмент прогнозирования, основанный на канадском опыте, который аналогичным образом включал плевральные сращения, ОФВ1 и DLCO [43 (39)], а французские исследователи вывели более сложный индекс модели прогнозирования ДУВ, включающий: мужской пол, ИМТ, шкалу одышки, плевральные спайки, лобэктомию или сегментэктомию, билобэктомию, резекцию буллы, операции по уменьшению объёма легких и резекцию верхней доли [37; 39]. C. Pompili с сотр. предложили шкалу оценки риска ДУВ, основанную на анализе базы данных European Society of Thoracic Surgeons, установив, что мужской пол, ОФВ1 менее 80% и ИМТ менее или равный 18,5 кг/м2 лучше прогнозируют ДУВ у больных после VATS [31].
Cтремление разработать надежную модель прогнозирования ДУВ неизбежно приводило к исключению больших групп пациентов. Так, модели рисков А. Brunelli [32; 42] и L. Lee [38] исключают сублобарные резекции. Между прочим, исключение больных, перенесших операции по уменьшению объёма легких, сопровождающихся высокой, до 50%, частотой сброса воздуха и рутинным использованием хирургических способов предупреждения ДУВ, оправданно. Любое доминирование в модели способно скрыть взаимосвязи между ДУВ и различными её предикторами у больных РЛ или у пациентов с не верифицированными очагами в паренхиме легкого, наиболее часто нуждающихся в хирургическом лечении. Хотя частота ДУВ ниже после VATS-резекций, включение хирургического доступа и типа операции в качестве переменных в модель, вероятно, позволит лучше прогнозировать ДУВ [19; 29; 43]. Кроме того, сомнительно, являются ли ранее выявленные факторы риска, введенные в модель, всеобщими для прогнозирования риска развития ДУВ.
Поэтому целью исследования A. Attaar с сотр. стала разработка инструмента клинического прогнозирования ДУВ после резекции легкого с использованием предоперационных параметров и интраоперационных переменных большой группы больных, пролеченных в одном центре, и подтверждение гипотезы, что стандартные, легкодоступные предикторы могут быть использованы для стратификации пациентов по классам риска [5].
В общей сложности 2317 пациентов соответствовали критериям включения в исследование; частота ДУВ составила 8,6% (200/2317). Больные с ДУВ имели достоверно более высокий уровень госпитальной летальности: 3,0% против 1,1% (р = 0,034). ДУВ значительно увеличила среднюю продолжительность пребывания в больнице: 10 против 4 дней, (р<0,001); на 10-й день после операции выписаны только 47% больных с ДУВ по сравнению с 90% пациентов без ДУВ [5]. Большинство резекций легкого - VATS лобэктомия или сегментэктомия при первичном РЛ.
Пациенты с ДУВ оказались старше, преимущественно мужского пола, имели более низкий ИМТ, курение в анамнезе, заболевания периферических сосудов, ХОБЛ, предыдущее употребление стероидов, более высокий балл по шкале Zubrod и более низкий % ОФВ1. Больные с ДУВ чаще страдали первичным РЛ по сравнению с доброкачественными опухолями или метастазами в легкие, подвергались лобэктомии, сегментэктомии либо билобэктомии по сравнению с атипичной резекцией, резекции правого легкого и торакотомии и оперировались хирургом с более высокой годовой нагрузкой.
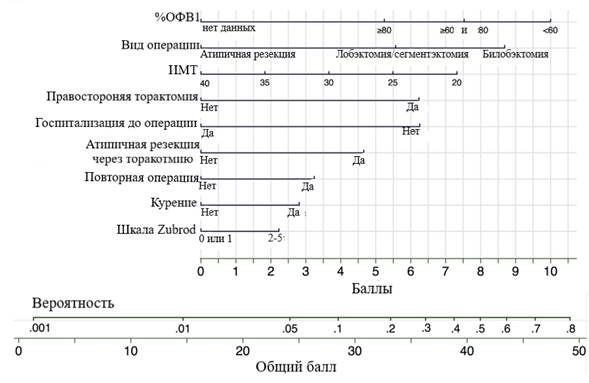
Окончательная регрессионная модель включила следующие параметры: ИМТ, % ОФВ1, ежегодную нагрузку на хирурга, курение, оценку по шкале Зуброда, предоперационную госпитализацию, повторную операцию, тип операции, сторонность (латеральность), хирургический доступ, правостороннюю торакотомию и атипичную резекцию с торакотомным доступом.
Рис. 1. Номограмма для расчёта вероятности ДУВ. Для расчёта вероятности ДУВ суммируйте баллы по всем переменным до общего балла с соответствующей вероятностью
Пример: курильщик (2,5 балла) с ИМТ = 32 (3 балла), %ОФВ1= 65 (7,5 балла) и оценкой Зуброда = 1 (0 баллов) без предыдущей операции на грудной клетке (0 баллов) или предоперационной госпитализации (6 баллов), которому планируется открытая правосторонняя (6 баллов) лобэктомия (5 баллов). Общее количество баллов: 30. Вероятность составляет около 12%. (Attaar A., Winger D.G., Luketich J.D., Schuchert M., Sarkaria I., Christie N., Nason K. с измен. [5])
На основании вышеперечисленных переменных создана обобщенная номограмма, с исключением годовой нагрузки хирурга конкретного учреждения (рис. 1). Затем по номограмме рассчитывали балльную оценку для каждого больного и разделили пациентов на группы низкого, промежуточного и высокого риска. По сравнению с группой низкого риска, у больных в группе промежуточного риска вероятность возникновения ДУВ оказалась более чем в 5 раз выше, в то время как в группе высокого риска вероятность была выше более чем в 12 раз. Наблюдаемые показатели ДУВ в группах составили 2,0, 8,8 и 19,3% (р <0,001), что близко соответствовало прогнозируемым показателям модели.
Дискриминационная точность конечной регрессионной модели составила 75,9% (C statistic, 0,759; 95% CI: 0,725–0,792), которая правильно классифицирует 74,9% пациентов. Тест Хосмера-Лемешова указывает на хорошее соответствие модели данным (р = 0.735). Дискриминационная точность для номограммы - 75,7% (C statistic, 0,762; 95% CI: 0,724–0,790) и 72,9% для групп риска (C statistic, 0,729; 95% CI: 0,698–0,760).
Таким образом, на основании анализа данных пациентов авторами разработана модель, основанная на анализе данных больных одного учреждения, перенесших резекцию легкого по поводу доброкачественных и злокачественных новообразований, оперированных в объёме лобэктомии или сегментэктомии, атипичной резекции и билобэктомии через торакотомный или VATS хирургический доступ. С использованием довольно большой выборки исследование проверило гипотезу о том, что стандартные, легкодоступные предикторы, а именно три часто идентифицируемых фактора риска ДУВ: низкий ИМТ [44], низкий % ОФВ1 [32; 38] и лобэктомия [45; 46], могут быть использованы для стратификации больных.
Разработанная номограмма позволила сформировать шкалу вероятностной оценки ДУВ и классифицировать пациентов по риску в группы низкого, промежуточного и высокого риска с хорошей дискриминационной точностью, улучшив предоперационное консультирование, обоснованное интраоперационное использование хирургических способов предупреждения утечек воздуха и прогнозирование возможной ускоренной выписки больных с низким риском развития ДУВ. Важно отметить, что в группах риска наблюдалось монотонное увеличение частоты, наблюдаемой ДУВ, что указывает на четкие различия между ними.
Точный и обобщенный инструмент стратификации риска ДУВ, вероятно, облегчил принятие клинических решений и оказания специальной помощи больным. Учитывая необходимость тщательно разработанных стандартизированных протоколов для эффективного ведения и наблюдения за больными, возможность прогнозирования ДУВ до операции необходима, т.к. существуют как интраоперационные способы профилактики, например плевральные тенты, герметики, укрепление линий механического шва, так и послеоперационные методы лечения ДУВ, эффективность которых остается не вполне ясной [3; 40; 41].
ДУВ из паренхимы легкого - результат нарушения заживления поврежденных альвеол, что нередко связано с плохой аппозицией легкого к париетальной плевре. Очевидно, что кроме технических моментов, зависящих от хирурга и установок конкретной клиники, таких как метод диссекции междолевых щелей, шва легочной паренхимы, использования герметиков и клея, непосредственное влияние на заживления ран оказывают снижение эластичности легких и воспаление легочной паренхимы. Действительно, вывод о том, что увеличение ИМТ защищает от ДУВ, подтверждается тем, что у больных с недостаточным весом и низким ИМТ замечена значительно более высокая частота ДУВ [22; 47; 48]. Считается, что более низкий ИМТ является маркером более низкого статуса питания и плохого заживления ран. Однако трудно объяснить продолжающееся снижение частоты ДУВ у больных с избыточным весом и ожирением, что, вероятно, связано с более высокой частотой дыхания, более низким дыхательном объёмом, снижением общего комплаенса системы дыхания и резервного объема выдоха при сохраненных показателях спирометрии и газообмена. Предполагается, что перечисленные факторы способны создавать внутригрудную среду, обеспечивающую герметизацию дефектов паренхимы [49].
В противоположность сложившемуся мнению, что возраст [14; 15; 21] и пол [8; 10; 43] являются независимыми предикторами ДУВ, авторы не обнаружили их достоверной значимости [5]. Эмфизема легких [20; 23], ХОБЛ [7; 29; 45], наличие плевральных сращений [14; 24; 37], DLCO1 [17; 28; 29] и резекция верхней доли [15; 39; 42] – другиe, ранее выявленные факторы риска ДУВ, оказались не доступными для анализа в данной работе.
Для создания и проверки простой прогностической шкалы ДУВ у пациентов, перенесших резекцию легкого по поводу РЛ, C.W. Seder с коллегами использовали базу данных STS GTSD (Society of Thoracic Surgeons General Thoracic Surgery Database), которая является крупнейшей в мире проспективной проверенной базой данных по торакальной хирургии, содержащей социально-демографические характеристики больных, информацию об оперативных вмешательствах и сведения о непосредственных результатах хирургического лечения [6].
Для анализа из базы данных STS GTSD выбраны следующие независимые переменные: пол, возраст, ИМТ, статус курения (курившие против никогда не куривших), предоперационный ОФВ1%, предоперационный DLCO%, предшествующие кардио-торакальные вмешательства, шкала Zubrod (PS - performance status: 0–4 балла), прием стероидов, сахарный диабет, VATS или открытый доступ, тип резекции, размер опухоли и стадия N. На основе данных предыдущих исследований ИМТ подразделялся на 25 кг/м2 и меньше или больше, чем 25 кг/м2 [26; 28; 47], ОФВ1% [20; 23; 30] и DLCO% [17; 27; 28] разделены на 70% или менее и более 70% соответственно. Пациенты с экстремальными показателями ИМТ (<18 кг/м2 и >45 кг/м2), ОФВ1% (>120% или <30%) или DLCO% (>120% или <30%) были исключены для создания модели [6].
Шкала Zubrod подразделена следующим образом: 0 баллов против 1–4. Статус курения: курившие против никогда не куривших - выбран для анализа вместо количества лет курения для удобства клинического использования. Также рассмотрены: тип оперативных вмешательств, выполнялись ли множественные одновременные резекции легких, продолжительность пребывания в стационаре, выписка из больницы с плевральными дренажами, повторная госпитализация в течение 30 дней, госпитальная и 30-дневная летальность [6].
К началу исследования 52.198 пациентов (46% мужчин) из базы данных STS GTSD соответствовали критериям включения; частота ДУВ составила 10,4% (5453/52.198). Средний возраст больных - 68 лет. Большинство пациентов ранее курили и оценены по шкале Zubrod 0 или 1 баллом. Лобэктомия выполнена 76% больных, верхняя лобэктомия справа оказалась наиболее распространенной резекцией легкого - 35%. VATS использовалась в 65% случаев; несколько одновременных ипсилатеральных резекций легкого выполнены y 10% больных.
Однофакторный и многофакторный логистический регрессионный анализ продемонстрировал, что почти все исходные 14 переменных ассоциировались с ДУВ. Окончательные ковариации, включенные в прогностическую модель, следующие: ИМТ 25 кг/м2 или меньше (OR= 1,95; 95% CI: 1,84–2,07), лобэктомия или билобэктомия (ОR= 1,95; 95% CI : 1,79–2,12), ОФВ1 70% или менее (ОR= 1,43; 95% CI : 1,34–1,52 ), мужской пол (ОR= 1,39; 95% CI: 1,31–1,47) и вмешательство на верхней доле справа (ОR= 1,40; 95% CI: 1,32–1,49).
Для разработки шкалы оценки ДУВ, которую можно использовать в клинической практике, каждый модельный коэффициент был округлен до ближайшей единицы (табл. 3).
Таблица 3
Шкала оценки риска длительной утечки воздуха [6]
|
Критерий |
Балл |
|
ИМТ ≤ 25 кг/м2 |
7 |
|
Лобэктомия или билобэктомия |
6 |
|
ОФВ1≤70% |
5 |
|
Мужской пол |
4 |
|
Верхняя лобэктомия справа |
3 |
Далее обнаружено, что суммарный показатель шкалы ДУВ, превышающий 17 баллов, позволяет стратифицировать больных в группы высокого или низкого риска развития ДУВ: с частотой ДУВ 19,6% и 9% случаев соответственно. Классификация рисков оказалась правильной у 79% пациентов [6].
Больные с высоким риском ДУВ (более 17 баллов по шкале) имели достоверно большую среднюю продолжительность пребывания в стационаре: 5 против 4 дней (р <0,001); чаще выписывались с плевральными дренажами: 14,2% против 7,1% (р < 0,001) и более высокий показатель повторной госпитализации в течение 30 дней: 10% против 7,5% (р < 0,001). Послеоперационная госпитальная (1,5% против 0,7%, р < 0,001) и 30-дневная летальность (1,9% против 1%; Р < 0,001) у пациентов с ДУВ оказалась почти в два раза выше, чем у больных с низким риском [6].
Анализ данных 39.660 больных, перенесших лобэктомию по поводу РЛ, выявил, что ИМТ 25 кг/м2 и менее (OR= 1,92; 95% CI: 1,81–2,05), ОФВ1 70% или менее (OR = 1,42; 95% CI: 1,32–1,52), верхняя лобэктомия справа (OR = 1,45; 95% CI 1,36–1,54; 4 балла) и мужской пол (OR =1,34; 95% CI 1,26–1,43) являются предикторами ДУВ с правильным прогнозированием наличия или отсутствия ДУВ в 83% случаев.
Предложенная модель отличается от предыдущих моделей риска тем, что она разработана и апробирована на большой, проверенной, многоцентровой популяции больных, перенесших резекции легкого, и предполагает использование для прогноза исключительно предоперационных данных. Модель достаточно проста и может с легкостью применяться в повседневной клинической практике, т.к. подразделяет пациентов на 2 категории высокого и низкого риска вместо 3 или 4 классов, как предлагалось ранее [5].
Несмотря на масштабность рассматриваемого исследования, оно имеет ограничения. В частности, база данных STS GTSD специально не разрабатывалась как исследовательский инструмент, поэтому некоторые переменные, имеющие отношение к изучению ДУВ, такие как техника резекций легкого, использование герметиков, плевральных тентов, различной тактики ведения плевральных дренажей, цифровых дренажных устройств и частота повторных операций, оказались недоступными для анализа. Например, при выполнении анатомических резекций легкого некоторые хирурги подходят к сосудам через междолевые борозды, а другие используют «бесфиссурную» технику, при которой паренхима легкого прошивается в последнюю очередь. Очевидно, как ограничение воспринимается скромная положительная прогностическая ценность и высокая частота ложноположительных результатов данной модели. Вместе с тем высокая отрицательная прогностическая ценность модели прогнозирования позволяет избежать продленной госпитализации и ненужных затрат при послеоперационном ведении больных, у которых вряд ли разовьется ДУВ.
В последнее время доказано, что пациенты, перенесшие минимально инвазивную торакальную хирургию (VATS или RATS), менее подвержены развитию ДУВ по сравнению с торакотомией [24; 25; 47]. Серьезные повреждения тканей, вызванные открытым доступом, сопровождаются замедленным заживлением раны и, следовательно, увеличивают риск осложнений. Опыт учреждений, в которых большинство операций на легких проводятся с использованием минимально инвазивного подхода, показывает, что абсолютных противопоказаний для малоинвазивной хирургии нет [5; 7]. Однако в ряде случаев при: центральном РЛ, опухолях размером более 5 см, инвазии в крупные сосуды, массивном поражении лимфатических узлов корня легкого, - очевидны преимущества открытого доступа [7]. На самом деле, перечисленные аспекты имеют прямое отношение к риску ДУВ.
Принимая во внимание современные тенденции развития торакальной хирургии, R. Jin с коллегами создали свою прогностическую модель ДУВ, проанализировав данные 1511 пациентов, перенесших резекции легких по поводу РЛ или метастазов в легкие с января 2014 по январь 2018 г. в клинике Ruijin, Shanghai Jiao Tong University School of Medicine, КНР. Большинству больных выполнены малоинвазивные вмешательства: VATS-1085, RATS- 247, и только у 179 использован открытый доступ. Из всех пациентов, которым планировалось малоинвазивное вмешательство, у 21 (1.58%) выполнена конверсия в торакотомию. Общая частота ДУВ составила 9,07% (137/1,511) [7].
С помощью электронных медицинских записей задокументированы следующие демографические данные: возраст, пол, ИМТ, оценка по шкале PS ЕCOG (performance status Eastern Cooperative Oncology Group), оценка по шкале ASA (American Society of Anesthesiologists), респираторные (астма, хронический бронхит, ХОБЛ и т.п.) и сердечно-сосудистые (ишемическая болезнь сердца, аритмии, пороки клапанов и т.п.) заболевания в анамнезе, сахарный диабет, торакальные операции и переломы ребер, статус курения. Фиксировались данные предоперационного обследования: компьютерная томография, эхокардиография и %ОФВ1, с подразделением на три категории: ≥80%, от 50% до 80% и <50%, согласно классификации тяжести ограничения воздушного потока при ХОБЛ [50].
Регистрировались хирургические параметры: хирургический доступ (торакотомия или VATS/ RATS), тип операции (лобэктомия, сегментэктомия, клиновидная резекция или билобэктомия), локализация вмешательства, время операции и объём кровопотери во время операции, а также послеоперационные патологоанатомические заключения.
Из рассмотренных переменных логистический регрессионный анализ установил, что пол, возраст, показатель PS ЕCOG, % ОФВ1, тип операции, хирургический доступ и курение в анамнезе достоверно связаны с риском развития ДУВ. Примечательно, что пациенты с ДУВ были мужчинами старшего возраста и имели гораздо более низкий % ОФВ1.
Выявлено, что для больных старше и моложе 70 лет частота ДУВ составляет 15,94% (44/276) и 7,53% (93/1,235) соответственно. Пациенты, перенесшие малоинвазивную хирургическую операцию (VATS/RATS), имели меньше шансов к развитию ДУВ - 7,73% (103/1,332) по сравнению с 18,99% (34/179) у перенесших торакотомию (р <0,001). Среди 24 больных после билобэктомии у 8 развилась ДУВ. Лобэктомия - основной тип операции, несла более высокий риск ДУВ 10,77% (121/1124), чем сегментэктомия - 3,11% (6/193) или атипичная резекция - 1,18% (2/170). По сравнению с никогда не курившими больными курящие или бросившие курить пациенты имели достоверно более высокий риск ДУВ: 14,29% (63/441) против 6,92% (74/1,070) (р <0,001) [7].
Многофакторная логистическая регрессия, представленная в виде отношения шансов (OR - odds ratio) с 95% CI (confidence intervals), показала, что возраст OR =1,02; CI: 1,01–1,05, хирургический доступ (VATS/ RATS против торакотомии) OR = 0,61; CI: 0,38–0,97, тип операции: сегментэктомия сравнительно с лобэктомией OR = 0,35; CI: 0,15–0,82, атипичная резекция по сравнению с лобэктомией OR =0,12 ; CI 0,03–0,50; билобэктомия сравнительно с лобэктомией OR =3,04; CI: 1,22–7,57 и статус курения OR =1,54; CI: 1,05–2,27 являются независимыми факторами риска развития ДУВ [7].
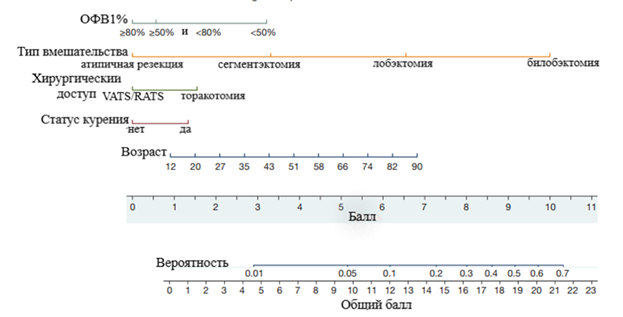
Рис. 2. Номограмма предоперационного прогнозирования риска ДУВ после резекции легких по поводу злокачественных новообразований. Для расчёта вероятности ДУВ суммируйте баллы по всем переменным до общего балла, который преобразуется в прогнозируемую вероятность (Jin R., Zheng Y., Gao T. с измен. [7])
С использованием вышеперечисленных коэффициентов модели разработана номограмма для определения вероятности ДУВ, которая позволяет удобно прогнозировать осложнение (рис. 2). Первоначально собираются данные больного, которому предстоит резекция легкого, и определяются баллы для каждой переменной, которые следует суммировать, чтобы получить общий балл. Далее значение общего балла используется для оценки вероятности ДУВ у конкретного пациента. Например, 75-летний пациент с нормальным % ОФВ1 и 20-летним стажем курения в анамнезе, которому предстоит VATS лобэктомия, имеет общий балл 13,5. Предполагаемая вероятность ДУВ у больного немного менее 20% [7].
Прогностическая модель и номограмма продемонстрировали вполне хорошую точность в оценке риска ДУВ, с C statistic, 0,70 для данных разработки и C statistic, 0,77 для валидационного набора данных. Незначительное значение теста Хосмера-Лемешова демонстрирует близкое соответствие между прогнозируемым и фактическим риском ДУВ. Оптимальное пороговое значение суммарных баллов по номограмме составляет 12 баллов, соответствующих расчетной вероятности ДУВ около 10% с чувствительностью и специфичностью 56% и 68% соответственно [7].
Существует несколько вероятных механизмов, объясняющих выявленные взаимосвязи. Хорошо известно, что статус курения и % ОФВ1 тесно связаны с нарушением функции легких. Важно отметить, что нарушения функции легких указывают на повышенное сопротивление дыхательных путей при ХОБЛ [21; 29; 45], снижение эластичности легких и эмфизему [8; 20; 23], которые непосредственно влияют на заживление паренхимы легких. Возраст является ключевым фактором, влияющим на общее физическое состояние, играющим важную роль для послеоперационной реабилитации. Установлено, что пожилой возраст является фактором риска развития ДУВ [17; 18; 28]. Кроме того, как упоминается выше, разные хирургические доступы обусловливают различную степень повреждения легочной паренхимы, приводящую к возникновению ДУВ [21; 24; 27]. С физиологической точки зрения, меньшее количество легочной ткани, удаляемой в результате сегментэктомии или атипичной резекции, приводит к более низкому уровню внутриплеврального давления и к снижению риска ДУВ [46].
Заключение. Обзор современной литературы показал, что концепция разработки прогностической модели оценки риска ДУВ не нова, но проблема по-прежнему далека от разрешения. Ни один из описанных на сегодняшний день алгоритмов не получил широкого клинического применения из-за неоднородности включённых факторов риска или зависимости от трудно учитываемых переменных. Ранее считалось, что недостатки моделей обусловлены анализом данных относительно небольших групп пациентов, как правило, лечившихся в одном учреждении, что потенциально приводило к предвзятости и снижению внешней валидности. Однако использование популяционных выборок, например базы данных STS GTSD, лишь подчеркнуло проблему прогнозирования риска у конкретных больных из-за неизменно возникающей суперпозиции непреднамеренных, нераспознанных и неисследованных переменных [44].
Сходство, отмеченное для всех моделей, пытающихся стратифицировать больных по риску ДУВ, заключается в их скромной прогностической способности. Последнее, вероятно, является отражением слабой связи между изученными клиническими параметрами и ДУВ. Действительно, если присмотреться, редкий фактор риска ДУВ в обзоре дал отношения шансов (OR - odds ratio) более 2, тогда как известно, что клинические факторы риска, связанные с менее чем 3-кратным OR, являются ненадежными для прогнозирования персональных событий у больных. На наш взгляд, для преодоления ограничений открыты несколько путей. Во-первых, следует исследовать роль биохимических маркеров в прогнозировании риска ДУВ. Во-вторых, выделить наиболее универсальные и надежные клинические параметры. Наконец создать программную прогностическую модель с использованием искусственного интеллекта.
Вместе с тем, независимо от имеющихся ограничений, уже существующие модели обладают прогностическим потенциалом, повышающим способность хирургов выявлять пациентов с предрасположенностью к развитию ДУВ до операции. Следовательно, при их использовании весь комплекс мероприятий, направленных на предупреждение осложнения, может быть осуществлен заранее, а возможный вред от дополнительного вмешательства у больных с низким риском сведен к минимуму.
Библиографическая ссылка
Иозефи К.Д., Харагезов Д.А., Лазутин Ю.Н., Статешный О.Н., Милакин А.Г., Лейман И.А., Витковская В.Н., Гаппоева М.А., Мирзоян Э.А. ФАКТОРЫ РИСКА И ПРОГНОЗИРОВАНИЕ ДЛИТЕЛЬНОЙ УТЕЧКИ ВОЗДУХА ПОСЛЕ РЕЗЕКЦИИ ЛЁГКОГО У БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЁГКОГО // Современные проблемы науки и образования. 2022. № 6-2. ;URL: https://science-education.ru/ru/article/view?id=32133 (дата обращения: 31.01.2026).
DOI: https://doi.org/10.17513/spno.32133



