По данным современных авторов, частота формирования грыж после открытых абдоминальных вмешательств превышает 20% [1]. В США ежегодно выполняется до 500 тыс. операций по поводу грыж [2]. Ведущим методом лечения пациентов с данной патологией является протезирующая пластика брюшной стенки [2]. Частота послеоперационных раневых осложнений при этом составляет 4-23%, до 10% осложнений ассоциированы непосредственно с сеткой [3]. Основной проблемой в данной области хирургии является оказание помощи особой категории больных - лицам с большими и сложными дефектами брюшной стенки [4]. Операции, выполняемые в таких случаях, относятся к наиболее сложным в техническом отношении, продолжительным и рискованным вмешательствам [5]. Основными вариантами хирургического пособия в описанных ситуациях являются передняя сепарация (anterior component separation technique - ACST, операция Ramirez) и задняя (posterior component separation technique - PCST или transversus abdominis release - TAR) [5-7]. Дискуссия по поводу данных операций включает вопросы целесообразности и безопасности применения ACST и PCST по сравнению с конвенциональной протезирующей пластикой брюшной стенки [4], а также возможности, преимущества и недостатки названных методик в сравнительном аспекте [8]. В качестве средств, позволяющих в раннем послеоперационном периоде сопоставить степень хирургической травмы и ответ организма на произведенное вмешательство, используется целый ряд лабораторных критериев. Особого внимания заслуживает цитокиновый ответ на вмешательство, который находится в поле зрения современных ученых [9]. В ряде исследований ставится задача сравнения течения послеоперационного периода при различных операциях герниологического профиля с помощью цитокинов в качестве средства объективного контроля иммунного, системного воспалительного ответа [10-12]. Авторы сравнивают течение послеоперационного периода в зависимости от имплантируемого эндопротеза, фармакологического обеспечения [13] и иных факторов. Экспериментальных исследований в данном разделе хирургии относительно немного [9; 10; 13]. Публикаций, в которых изучен цитокиновый профиль послеоперационного периода при сепарационной пластике, до настоящего времени не представлено.
Цель работы: изучить особенности цитокинового ответа в послеоперационном периоде при моделировании грыжи живота и последующей реконструкции брюшной стенки с помощью сепарационной пластики.
Материал и методы исследования. Работа выполнена на 25 кроликах породы русская шиншилла с разрешения локального этического комитета ФГБОУ ВО «ПИМУ» Минздрава России (протокол № 5 от 10.03.2021 г.) в соответствии с законодательством РФ («Правила гуманного обращения с лабораторными животными», «Деонтология медико-биологического эксперимента») и с Европейской конвенцией по защите позвоночных животных [14]. Все операции проведены под наркозом комбинацией препаратов Золетил 100 (25 мг/кг) и Ксилавет (3 мг/кг), вводимых внутримышечно. Осуществлялось адекватное обезболивание, были предприняты меры профилактики инфекций области хирургического вмешательства и стрессовых язвенных поражений желудочно-кишечного тракта, проводились наблюдение и перевязки. Животные были поделены на 5 групп. Рандомизацию осуществляли методом конвертов. В первой группе (n=5) выполняли срединную лапаротомию длиной 15 см с последующим стандартным ушиванием брюшной стенки (непрерывно, атравматичной нитью 2/0) и раны. В остальных группах на первом этапе моделировали послеоперационную грыжу больших размеров. С этой целью проводили такую же лапаротомию, после чего ушивали только кожу. Формирование больших послеоперационных грыж наблюдали в течение 30 суток. На втором этапе производили реконструкцию брюшной стенки с помощью сепарационной пластики. Во 2-й группе выполняли операции Ramirez II. Выполняли мобилизацию грыжевого мешка, билатерально проводили ретромускулярную диссекцию, рассекали апоневроз наружной косой мышцы живота латеральнее наружного края влагалища прямой мышцы живота и параллельно последнему, продолжали препаровку латерально между апоневрозом наружной косой мышцы живота и внутренней косой мышцей. Протезировали медиальный и латеральные сегменты брюшной стенки полипропиленовыми сетками ES 3030 (РФ). В 3-й группе осуществляли точно такие же вмешательства, но без этапа протезирования. В 4-й группе применяли способ TAR. Выполняли мобилизацию грыжевого мешка, билатерально проводили ретромускулярную диссекцию, пересекали поперечную мышцу живота с обеих сторон с последующей диссекцией в латеральном направлении, протезированием медиального и латеральных сегментов полипропиленовой сеткой ES 3030 (РФ). В 5-й группе применяли аналогичные операции, только без использования эндопротезов. Техника операций на брюшной стенке не отличалась от приемов, описанных разработчиками указанных операций и применяемых в клинической практике [5; 7; 8]. С целью стандартизации вмешательств основные этапы и технические приемы были ранее многократно отработаны авторами настоящего исследования в предыдущих экспериментах. Все особенности вышеуказанных вмешательств подробно описаны и находятся в свободном доступе. Распределение животных по группам показано в таблице 1.
Таблица 1
Распределение животных по группам
|
Группа животных |
Вариант операции |
Количество животных |
|
1 |
Лапаротомия |
5 |
|
2 |
Ramirez II с сеткой |
5 |
|
3 |
Ramirez II без сетки |
5 |
|
4 |
TAR с сеткой |
5 |
|
5 |
TAR без сетки |
5 |
У всех животных оценивали содержание провоспалительных цитокинов: интерлейкина - 1 бета (IL-1β), фактора некроза опухоли альфа (TNFα), а также противовоспалительных цитокинов: интерлейкина - 10 (IL-10), трансформирующего фактора роста бета 1 (TGFb1). Перечисленные показатели исследовали в плазме крови до вмешательства (исходный уровень), на 3-и сутки (фаза экссудации) и на 10-е сутки (фаза пролиферации) после операции с использованием иммуноферментного анализа (ELISA Cloud-Clone Corp., China) и оценивали на спектрофотометре Epoch (BioTek, USA) с использованием стандартных калибровочных кривых. После выполнения этапа моделирования грыж на 3-и сутки также исследовали уровни указанных цитокинов. Кровь для проведения лабораторных исследований отбирали утром из краевой вены уха животного в объеме 1,5 мл в пробирку типа Эппендорф. Для получения плазмы образцы крови центрифугировали в течение 30 минут после сбора при 3000 об/мин в течение 10 минут. Аликвотированные образцы плазмы по 150 мкл помещали в холодильник при -20 °C в течение 2 часов, затем хранили при -80 °C до анализа. Полученные результаты обработаны с применением методик математической статистики и использованием пакета программы Statistica 12.0. Данные на нормальность распределения изучали тестом Shapiro – Wilk. В ряде последовательностей распределение отличалось от нормального, поэтому для сравнения количественных показателей независимых выборок использовали критерий Mann – Whitney. Для сравнения данных в зависимых выборках использовали t-критерий Wilcoxon. Динамику в последовательности независимых выборок оценивали по Kruscal - Wallis. Статистически значимыми считали различия при уровне р <0,05.
Результаты исследования и их обсуждение. Подробные сведения о динамике IL-1β в плазме крови животных на этапах эксперимента приведены в таблице 2. В таблицах 2-5 уровни цитокинов приведены в пг/мл, Mean – среднее, Med – медиана, SD – стандартное отклонение, Q1 – Q3 – первый и третий квартили, IQR – интерквартильный размах (ИКР). Исходный уровень IL-1β до оперативных вмешательств составлял (Mean) 18,04 пг/мл, ИКР 12,71.
Таблица 2
Динамика IL-1β в ходе эксперимента
|
Сроки забора крови |
Группа |
Mean |
Med |
SD |
p, Shapiro - Wilk |
Q1 |
Q3 |
IQR |
p, Mann - Whitney |
p, Kruskal - Wallis |
|
|
До операции |
Все животные |
18,04 |
15,54 |
8,52 |
0,4182 |
10,39 |
23,10 |
12,71 |
|
|
|
|
3-и сутки после операции |
Лапаротомия |
17,57 |
19,17 |
5,50 |
0,3038 |
16,24 |
21,49 |
5,25 |
0,9272 |
|
0,1406 |
|
Моделирование грыжи |
18,52 |
16,15 |
8,96 |
0,2345 |
11,61 |
23,93 |
12,32 |
||||
|
Ramirez II с сеткой |
14,52 |
14,53 |
6,76 |
0,8462 |
8,67 |
20,70 |
12,03 |
0,5752 |
0,1862 |
||
|
Ramirez II без сетки |
11,73 |
10,96 |
5,59 |
0,0317 |
6,54 |
17,68 |
11,14 |
||||
|
TAR с сеткой |
21,06 |
17,39 |
12,72 |
0,0843 |
12,87 |
23,10 |
10,23 |
0,0453 |
|||
|
TAR без сетки |
10,09 |
9,83 |
4,46 |
0,4863 |
6,04 |
11,61 |
5,56 |
||||
|
Все животные |
15,04 |
13,52 |
7,97 |
0,0006 |
9,23 |
19,93 |
10,70 |
|
|
||
|
10-е сутки после операции |
Лапаротомия |
21,81 |
20,70 |
6,71 |
0,3360 |
17,68 |
22,29 |
4,61 |
|
|
0,0180 |
|
Ramirez II с сеткой |
12,26 |
8,77 |
8,12 |
0,0899 |
6,54 |
16,95 |
10,41 |
0,9362 |
0,2139 |
||
|
Ramirez II без сетки |
10,31 |
8,68 |
3,89 |
0,1088 |
7,58 |
14,86 |
7,27 |
||||
|
TAR с сеткой |
8,28 |
6,80 |
3,13 |
0,0741 |
6,04 |
11,61 |
5,56 |
0,0547 |
|||
|
TAR без сетки |
13,37 |
12,56 |
4,90 |
0,2269 |
8,67 |
19,17 |
10,50 |
||||
|
Все животные |
12,91 |
11,61 |
6,88 |
0,0045 |
7,06 |
16,95 |
9,90 |
|
|
||
На 3-и сутки после оперативного вмешательства данный показатель снизился до 15,04 пг/мл, ИКР 10,70 без достоверных отличий между видами оперативных вмешательств (p=0,1406, Kruscal - Wallis), но при детальном сравнении сепарационных пластик было отмечено влияние эндопротеза, особенно в группе TAR с протезированием (21,06 пг/мл, ИКР 10,23), где значение анализируемого показателя было достоверно выше по отношению к группе TAR без применения сетчатого имплантата (10,09 пг/мл, ИКР 5,56), p=0,045, Mann - Whitney. На 10-е сутки после оперативного вмешательства уровень IL-1β снизился до 12,91 пг/мл, ИКР 9,90. Статистически значимое снижение уровня анализируемого интерлейкина было отмечено в группе TAR с сеткой до 8,28 пг/мл, ИКР 5,56 (р= 0,046400, Wilcoxon). Имелись достоверные отличия между видами оперативных вмешательств (p=0,0180, Kruscal - Wallis). При сравнении сепарационных пластик между собой отличия статистически не были значимы (p=0,2139, Kruscal - Wallis). Значение IL-1β после лапаротомии 21,81 пг/мл ИКР 4,61 было достоверно выше по сравнению со значениями, полученными после сепарационных пластик: Ramirez II - 10,31 пг/мл, ИКР 7,27 (p=0,01371, Mann - Whitney); TAR с сеткой - 8,28 пг/мл, ИКР 5,56 (p=0,008114, Mann – Whitney). Графическое отображение выполненного анализа представлено на рис. 1.
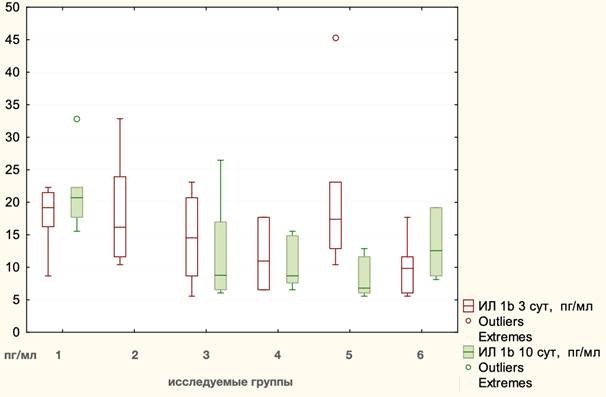
Рис. 1. Динамика уровней IL-1β на этапах эксперимента: 1 - лапаротомия, 2 - моделирование грыжи, 3 - Ramirez II с сеткой, 4 - Ramirez II без сетки, 5 - TAR с сеткой, 6 - TAR без сетки
Среднее значение исходного уровня TNFα составляло 4,22 пг/мл, ИКР 0,93. На 3-и сутки после оперативного вмешательства значение данного показателя практически не изменилось и составляло 4,05 пг/мл, ИКР 1,46. Статистически значимых различий уровня TNFα между оперативными вмешательствами (p=0,2846, Kruscal - Wallis) и техниками разделения компонентов (p=0,2996, Kruscal - Wallis) не наблюдалось.
Точные данные по динамике уровня фактора некроза опухоли альфа в плазме крови отражены в таблице 3. На 10-е сутки отмечается небольшое повышение уровня TNFα в плазме до 4,72 пг/мл, ИКР 0,76. Отличий между группами животных не было (p=0,1071, Kruscal – Wallis). В то же время отмечается, что уровень TNFα статистически выше после TAR 4,66 пг/мл, ИКР 0,46, чем после Ramirez - 3,91 пг/мл, ИКР 0,57 (p=0,030640, Mann - Whitney). Графическое отображение изменений уровней TNFα на этапах эксперимента представлено на рис. 2.
Таблица 3
Динамика уровня TNFα в ходе эксперимента
|
Сроки забора крови |
Группа |
Mean |
Med |
SD |
p, Shapiro - Wilk |
Q1 |
Q3 |
IQR |
p, Mann - Whitney |
p, Kruskal - Wallis |
|
|
До операции |
Все животные |
4,22 |
4,59 |
0,76 |
0,0007 |
3,77 |
4,70 |
0,93 |
|
|
|
|
3-и сутки после операции |
Лапаротомия |
4,38 |
4,44 |
0,56 |
0,2174 |
3,85 |
4,90 |
1,05 |
0,6481 |
|
0,2846 |
|
Моделирование грыжи |
4,55 |
4,66 |
0,44 |
0,0604 |
4,08 |
4,94 |
0,86 |
||||
|
Ramirez II с сеткой |
4,43 |
4,75 |
0,73 |
0,0115 |
4,27 |
4,87 |
0,60 |
0,1495 |
0,2996 |
||
|
Ramirez II без сетки |
3,32 |
3,33 |
1,38 |
0,5215 |
2,13 |
4,73 |
2,61 |
||||
|
TAR с сеткой |
3,92 |
4,02 |
0,91 |
0,1049 |
3,12 |
4,76 |
1,64 |
0,4712 |
|||
|
TAR без сетки |
4,17 |
4,80 |
1,06 |
0,0064 |
2,91 |
4,90 |
1,98 |
||||
|
Все животные |
4,05 |
4,39 |
0,96 |
0,0001 |
3,42 |
4,87 |
1,46 |
|
|
||
|
10-е сутки после операции |
Лапаротомия |
4,39 |
4,67 |
0,68 |
0,0674 |
4,39 |
4,76 |
0,37 |
|
|
0,1071 |
|
Ramirez II с сеткой |
6,80 |
4,63 |
5,80 |
0,0001 |
4,27 |
4,73 |
0,46 |
0,0927 |
0,0546 |
||
|
Ramirez II без сетки |
3,91 |
3,85 |
0,56 |
0,5116 |
3,51 |
4,08 |
0,57 |
||||
|
TAR с сеткой |
3,80 |
4,11 |
1,14 |
0,1029 |
3,51 |
4,63 |
1,12 |
0,0547 |
|||
|
TAR без сетки |
4,66 |
4,76 |
0,31 |
0,2329 |
4,44 |
4,90 |
0,46 |
||||
|
Все животные |
4,72 |
4,44 |
2,76 |
0,0000 |
4,00 |
4,76 |
0,76 |
|
|
||
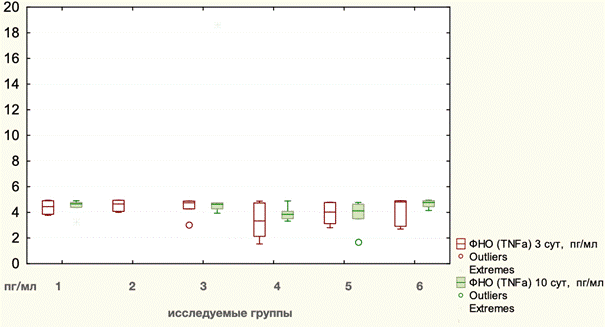
Рис. 2. Динамика уровней TNFα на этапах эксперимента: 1 - лапаротомия, 2 - моделирование грыжи, 3 - Ramirez II с сеткой, 4 - Ramirez II без сетки, 5 - TAR с сеткой, 6 - TAR без сетки
Сводные данные по уровню интерлейкина 10 приведены в таблице 4.
Таблица 4
Динамика IL-10 в ходе эксперимента
|
Сроки забора крови |
Группа |
Mean |
Med |
SD |
p, Shapiro - Wilk |
Q1 |
Q3 |
IQR |
p, Mann - Whitney |
p, Kruskal - Wallis |
|
|
До операции |
Все животные |
42,80 |
37,73 |
16,54 |
0,2509 |
29,84 |
55,20 |
25,35 |
|
|
|
|
3-и сутки после операции |
Лапаротомия |
54,91 |
55,20 |
21,16 |
0,4835 |
54,74 |
65,60 |
10,86 |
0,4113 |
|
0,3372 |
|
Моделирование грыжи |
49,07 |
52,16 |
11,72 |
0,3588 |
43,20 |
57,48 |
14,28 |
||||
|
Ramirez II с сеткой |
52,41 |
51,99 |
12,82 |
0,3403 |
40,82 |
66,09 |
25,28 |
0,6889 |
0,2925 |
||
|
Ramirez II без сетки |
48,25 |
40,68 |
22,48 |
0,5382 |
35,54 |
68,09 |
32,55 |
||||
|
TAR с сеткой |
80,72 |
66,30 |
45,21 |
0,0962 |
49,88 |
92,47 |
42,58 |
0,1735 |
|||
|
TAR без сетки |
52,54 |
39,66 |
28,95 |
0,1006 |
32,26 |
83,94 |
51,68 |
||||
|
Все животные |
52,47 |
46,07 |
25,68 |
0,0000 |
36,98 |
58,88 |
21,90 |
|
|
||
|
10-е сутки после операции |
Лапаротомия |
40,08 |
41,21 |
4,93 |
0,2330 |
40,42 |
41,61 |
1,18 |
|
|
0,7604 |
|
Ramirez II с сеткой |
41,25 |
42,00 |
5,78 |
0,2377 |
40,82 |
43,20 |
2,39 |
0,6889 |
0,6971 |
||
|
Ramirez II без сетки |
51,51 |
45,41 |
18,05 |
0,0248 |
39,65 |
53,53 |
13,88 |
||||
|
TAR с сеткой |
64,12 |
47,14 |
51,84 |
0,0033 |
35,13 |
57,02 |
21,89 |
0,4233 |
|||
|
TAR без сетки |
58,34 |
40,27 |
51,53 |
0,0007 |
35,13 |
44,42 |
9,29 |
||||
|
Все животные |
51,44 |
42,00 |
33,34 |
0,0000 |
38,88 |
48,60 |
9,72 |
|
|
||
Исходное значение данного интерлейкина составляло 42,80 пг/мл, ИКР 25,35. На 3-и сутки после оперативного вмешательства исследуемый показатель повысился до 52,47 пг/мл, ИКР 21,90, достоверных различий между видами операций не наблюдалось (p=0,3372, Kruscal – Wallis). На 10-е сутки среднее значение данного цитокина практически не изменилось и составляло 51,44 пг/мл, ИКР 9,72. Статистических различий значений IL-10 между лапаротомией и сепарационными пластики не было (p=0,7604, Kruscal – Wallis).
Статистические данные по динамике TGFb1 в ходе эксперимента представлены в таблице 5. Исходное значение данного показателя составляло (Mean) 108,60 пг/мл, ИКР 13,61. После проведения операций у животных уровень TGFb1 к 3-м суткам повысился до 121,73 пг/мл, ИКР 34,16. Графическое отображение изменений показателей TGFb1 в ходе эксперимента отражено на рис. 3.
Таблица 5
Динамика TGFb1 в ходе эксперимента
|
Сроки забора крови |
Группа |
Mean |
Med |
SD |
p, Shapiro - Wilk |
Q1 |
Q3 |
IQR |
p, Mann - Whitney |
p, Kruskal - Wallis |
|
|
До операции |
Все животные |
108,60 |
105,06 |
15,78 |
0,0075 |
99,47 |
113,08 |
13,61 |
|
|
|
|
3-и сутки после операции |
Лапаротомия |
129,99 |
123,72 |
23,57 |
0,8776 |
118,95 |
146,13 |
27,19 |
1,0000 |
|
0,8027 |
|
Моделирование грыжи |
130,56 |
126,20 |
20,85 |
0,4769 |
118,95 |
153,94 |
34,99 |
||||
|
Ramirez II с сеткой |
123,53 |
121,36 |
25,09 |
0,6344 |
107,33 |
129,80 |
22,47 |
0,9362 |
0,9503 |
||
|
Ramirez II без сетки |
128,40 |
120,80 |
40,66 |
0,4919 |
89,70 |
157,90 |
68,20 |
||||
|
TAR с сеткой |
112,32 |
106,30 |
26,23 |
0,8021 |
97,27 |
134,74 |
37,48 |
0,9362 |
|||
|
TAR без сетки |
116,32 |
123,81 |
22,09 |
0,2768 |
96,17 |
133,50 |
37,33 |
||||
|
Все животные |
121,73 |
118,95 |
25,71 |
0,2965 |
100,58 |
134,74 |
34,16 |
|
|
||
|
10-е сутки после операции |
Лапаротомия |
118,29 |
106,19 |
24,85 |
0,1805 |
105,06 |
123,72 |
18,66 |
|
|
0,3210 |
|
Ramirez II с сеткой |
123,77 |
120,80 |
30,66 |
0,1754 |
97,27 |
150,02 |
52,75 |
0,2298 |
0,2318 |
||
|
Ramirez II без сетки |
101,51 |
98,39 |
15,62 |
0,2624 |
86,53 |
118,95 |
32,42 |
||||
|
TAR с сеткой |
129,75 |
122,02 |
36,83 |
0,1679 |
103,93 |
135,99 |
32,06 |
0,9362 |
|||
|
TAR без сетки |
126,53 |
123,91 |
21,41 |
0,6458 |
111,92 |
138,50 |
26,58 |
||||
|
Все животные |
120,03 |
113,08 |
27,02 |
0,0214 |
100,58 |
135,99 |
35,41 |
|
|
||
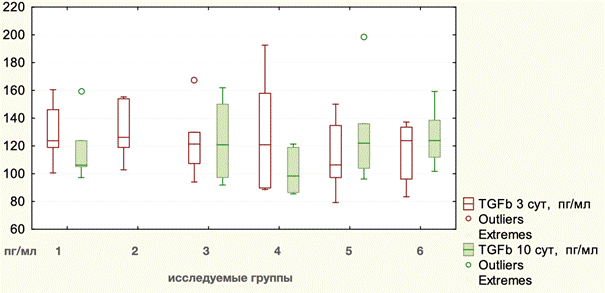
Рис. 3. Динамика уровней TGFb1 в ходе эксперимента: 1 - лапаротомия, 2 - моделирование грыжи, 3 - Ramirez II с сеткой, 4 - Ramirez II без сетки, 5 - TAR с сеткой, 6 - TAR без сетки
Отличий между видами оперативных вмешательств не было (p=0,8027, Kruscal – Wallis). Тот же показатель на 10-е сутки практически не изменился и составлял (Mean) 120,03 пг/мл, ИКР 35,41. В то же время в группе животных, которым выполнялась TAR с сеткой, отмечено достоверное повышение данного показателя до 129,75 пг/мл, ИКР 32,06 (р=0,043115, Wilcoxon). Различий по уровню данного показателя между лапаротомией и сепарационными пластиками не было (p=0,3210, Kruscal – Wallis). При сравнении значений TGFb1 после сепарационных пластик между собой также не было отмечено достоверных отличий (p=0,2318, Kruscal – Wallis).
По данным литературы, наиболее изучаемыми показателями послеоперационного периода, имеющими отношение к системной воспалительной реакции и цитокиновому профилю, являются CRP (C - реактивный белок), интерлейкины 1, 2, 4, 6, 8, 10, 13, TNF-α, TGFb1, VEGF (vascular endothelial growth factor), β-FGF (fibroblast growth factor) и ряд других показателей [10; 11; 15]. CRP расценивают как маркер острой фазы [9; 10] и предиктор воспалительных осложнений после операций герниологического профиля. Для сопоставления аналогичных по смыслу и показаниям операций (например, операция Лихтенштейна и трансабдоминальная преперитонеальная пластика при паховой грыже) исследователи сравнивают в динамике несколько показателей, принадлежащих к различным группам цитокинов - провоспалительных и противовоспалительных [12]. В рамках представленного исследования мы руководствовались таким же подходом. Предполагается, что более сложные и травматичные вмешательства вызывают значительные изменения уровней цитокинов, чем меньшие по объему и степени хирургической агрессии. Соответственно, близкие по масштабу и влиянию на организм операции будут иметь близкие по динамике цитокиновые профили [12]. Данные, полученные в настоящей работе, не противоречат ранее проведенным исследованиям, поскольку изучаемые вмешательства (Ramirez и TAR) в клинической практике имеют общепризнанные и во многом аналогичные показания, сопоставимую продолжительность и травматичность [6-8]. Приведенные в настоящей работе данные также свидетельствуют о том, что цитокиновый профиль послеоперационного периода у рассматриваемых операций является во многом сопоставимым. В нашем исследовании показатели IL-1β имели сходную динамику. С другой стороны, задняя сепарация представляется большинству авторов более сложной в техническом отношении операцией с более обширной зоной диссекции тканей [6; 8]. Результаты экспериментального исследования во многом подтверждают эти мнения. TAR оказывает более выраженное воздействие на оба компонента (провоспалительный и противовоспалительный). На 3-и сутки уровень IL-1β в группе TAR с сеткой был выше (21,06 пг/мл) по сравнению с группой Ramirez с сеткой (14,06 пг/мл). Уровень TNFα возрастал на 10-е сутки и был достоверно выше после операции TAR (4,66 пг/мл), чем после Ramirez II (3,91 пг/мл). Влияние имплантации сетки также имеет значение. Принято считать, что эндопротез не оказывает какого-либо специфического воздействия на иммунную систему [11], однако имплантацию столь большого инородного тела в брюшную стенку нельзя не учитывать (при осуществлении TAR обычно используют сетку размером 30х30 см). Следует иметь в виду, что у человека сепарационная пластика выполняется только с имплантацией сетки, что важно при оценке экспериментальных данных и их экстраполяции на клиническую практику. Концентрация IL-1β на 3-и сутки в группе TAR с протезированием была в 2 раза выше (21,06 пг/мл), чем в группе TAR без применения сетки (10,09 пг/мл), отличия достоверны. Показатель IL-10 незначительно возрастал на 3-и сутки и далее сохранялся приблизительно на том же уровне, причем статистических различий между лапаротомией и сепарационными пластиками не было. Динамика TGFb1 была аналогичной, причем уровень достоверно повышался в группе животных, которым выполнялась операция TAR с сеткой (129,75 пг/мл от исходного 108,6 пг/мл).
Заключение. Цитокиновый профиль послеоперационного периода после ACST и PCST имел общие черты. Максимальные изменения уровней цитокинов наблюдали в группе TAR, особенно с применением сетки. Это касалось как провоспалительного компонента, так и противовоспалительного. Следует полагать, что именно задняя сепарация с имплантацией эндопротеза ассоциирована с наибольшим влиянием на оба компонента цитокинового профиля в послеоперационном периоде. Это вполне соответствует общепринятым клиническим представлениям о масштабе данного вмешательства, обширности диссекции тканей в ходе операции и степени ее сложности.
Библиографическая ссылка
Паршиков В.В., Зарубенко П.А., Архипова Е.В. ЦИТОКИНОВЫЙ ПРОФИЛЬ ПОСЛЕОПЕРАЦИОННОГО ПЕРИОДА ПРИ МОДЕЛИРОВАНИИ ГРЫЖИ И РЕКОНСТРУКЦИИ БРЮШНОЙ СТЕНКИ С ПОМОЩЬЮ СЕПАРАЦИОННОЙ ПЛАСТИКИ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2022. № 5. ;URL: https://science-education.ru/ru/article/view?id=32101 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/spno.32101



