Кистозный фиброз (муковисцидоз) – аутосомно-рецессивно наследуемое заболевание, характеризующееся поражением всех экзокринных желез, а также важнейших органов и систем, при этом патология дыхательных путей является главной причиной развития осложнений и летальных исходов [1, 2].
Термин «кистозный фиброз» впервые был предложен в 1938 г. Дороти Андерсен, описавшей кистозную дегенерацию поджелудочной железы, сочетающуюся патологией легких у маленьких детей. Другое наименование – «муковисцидоз» – ввел С. Фарбер в 1944 г. (лат. mucus – «слизь», viscus – «вязкий»), отмечая роль повышенной вязкости секрета, выделяемого экзокринными железами.
Частота муковисцидоза варьирует в зависимости от этнической принадлежности или географической зоны. Заболевание рассматривается как детская патология, но в последние десятилетия доля взрослых выросла на 40% [3]. Реже заболевание встречается среди жителей Африки и Японии. В России частота заболевания новорожденных составляет 1:10000, различий по половому признаку не выявлено [4].
Для обзора литературы использовались публикации из научных электронных библиотек КиберЛенинка и e-LIBRARY, базы медицинских знаний PubMed, а также печатные издания за 2017–2021 гг., анализировались источники только с полным текстом в открытом доступе, написанные только на русском и английском языках. Общее количество проанализированных источников в указанных базах по запросам «муковисцидоз», «кистозный фиброз», «cystic fibrosis» составило 356.
Патогенез и патологическая анатомия
Муковисцидоз – классическое аутосомно-рецессивное генетическое заболевание, вызываемое мутациями с потерей функции в одном гене, находящемся на плече седьмой хромосомы, который кодирует регулятор трансмембранной проводимости (CFTR) [1, 2, 5].
Данная патология лежит в основе клинических проявлений, которые влияют на эпителиальную функцию врожденного иммунитета и просвет дыхательных путей в легких. Дисфункция эпителиальной ткани также участвует в модулировании хронического воспаления в дыхательных путях при муковисцидозе, что приводит к запуску провоспалительного каскада, который вызывает рекрутирование лейкоцитов в дыхательные пути. В основе воспалительно-опосредованного повреждения легких лежит чрезмерное скопление нейтрофилов в легких [6].
У большинства детей, больных муковисцидозом, преобладает экзокринная недостаточность поджелудочной железы, которая проявляется синдромом мальабсорбции, стеатореей, потерей веса, отставанием в физическом развитии [7]. По мнению ряда авторов, повышение количества иммунореактивного трипсиногена при муковисцидозе происходит в результате обструкции вязким секретом протоков панкреатических желез, что препятствует проникновению профермента в просвет тонкого кишечника и приводит к выбросу его в кровоток [8].
В патогенезе муковисцидоза выделяют три основных звена: поражения экзокринных желез и соединительной ткани, нарушение электролитного обмена. Патология экзокринных желез проявляется продукцией более вязкого секрета с повышенным содержанием белка и некоторых электролитов, сниженной ферментной активностью. Основой бронхолегочных перестроек служит нарушение проходимости и процесса самоочищения бронхов [9].
Некоторые аспекты патогенеза муковисцидоза представлены на рисунке.
Особенностью патогенетических изменений в бронхолегочной системе является развитие хронической колонизации. Если в начале жизни ребенка заселение бронхолегочной системы происходит грамположительной кокковой микрофлорой, то в дальнейшем преобладают грамотрицательные неферментирующие бактерии, вызывающие тяжелые формы инфекции [10]. Так, нетуберкулезные микобактерии могут стать причиной хронизации патологических процессов. Отдельной группой являются пациенты с иммунодефицитами, у которых микобактериозы приобретают генерализованное течение, ведущее к летальному исходу [11].
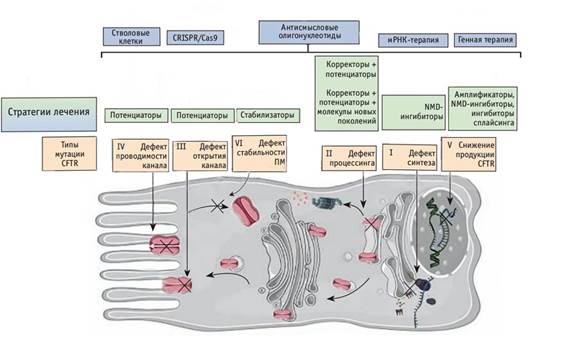
Виды дефектов синтеза белка CFTR при муковисцидозе и способы их коррекции (по I. Pranke и соавт.) [12, 13]
Основными чертами заболевания, обнаруживаемыми при микроскопическом исследовании, являются резко выраженная гиперплазия и пролиферация бокаловидных клеток на фоне десквамативного бронхита. Типичны плоскоклеточная метаплазия бронхиального эпителия и лимфоидная инфильтрация, часто по типу лимфоидных фолликулов. В подслизистом слое бронхов обнаруживаются гипертрофированные железы, кистозно расширенные и переполненные субстанциями, в составе которых преобладают слизистые клетки. Просветы бронхов и бронхиол, бронхоэктазы заполнены вязким белоксодержащим секретом с полиморфно-клеточными лейкоцитами, слущенными альвеолоцитами. В подслизистом слое имеет место смешанная воспалительная инфильтрация, встречаются участки фиброза перибронхиально. В просветах альвеол также обнаруживают повышение количества нейтрофилов, организующуюся пневмонию с тельцами Массона в виде грануляций, пропитывание межальвеолярных перегородок лимфоцитами и плазматическими клетками [14].
Клинически выделяют 4 стадии патологических изменений бронхолегочной системы при муковисцидозе.
1-я стадия характеризуется непостоянными изменениями функционального характера, что может сопровождаться незначительной одышкой при физических нагрузках и непродуктивным кашлем. Данная стадия может продолжаться до 10 лет.
На 2-й стадии развивается хронический бронхит. Кашель становится продуктивным, с небольшим количеством мокроты, одышка становится более выраженной. Аускультативно дыхание жесткое, выслушиваются влажные хрипы. Стадия длится от 2 до 15 лет.
3-я стадия – стадия осложнений. Одышка носит постоянный характер, при физической нагрузке может быть выраженной. С точки зрения морфологии, формируются участки диффузного пневмофиброза и ограниченного пневмосклероза, бронхоэктазы и кистозные образования. Продолжительность стадии – от 3 до 5 лет.
4-я стадия – терминальная, стадия тяжелой кардиореспираторной недостаточности, ведущей к смерти больного в течение нескольких месяцев [15].
При легочной форме муковисцидоза наблюдается деформация грудной клетки, пальцев рук по типу барабанных палочек и ногтей по типу часовых стекол, характерны наличие одышки, обструктивного синдрома, навязчивого коклюшеподобного кашля, ослабленное дыхание, влажные или сухие хрипы.
При кишечной форме определяются увеличение слюнных желез, кариозное поражение зубов, кандидозный стоматит, увеличение в размере печени и селезенки, холестаз, портальная гипертензия, наличие желчных камней, выпадение прямой кишки.
У новорожденных в 1,5–5% случаев был выявлен мекониальный илеус, возникающий вследствие медленного продвижения вязкого первородного кала. На 2–3-й день после рождения могут возникать беспокойство, срыгивание, вздутие живота, а также рвота после первых 4–6 кормлений, меконий отсутствует. Пальпаторно в животе определяется наличие каловых масс, наблюдается сосудистый рисунок. В копрограмме отмечаются стеаторея, сниженная активность трипсина, креаторея, что обусловлено недостаточностью секреции ферментов поджелудочной железы.
Критерии муковисцидоза по P.A. Di Sant. Agnese: наличие хронического бронхолегочного процесса; увеличение содержания электролитов в поте; кишечный синдром; наличие данного заболевания в семье. Для постановки диагноза достаточно наличия двух признаков [16].
Главной причиной осложнений при муковисцидозе является хроническое инфицирование дыхательных путей Pseudomonas aeruginosa, Staphylococcus aureus, Haemophilus influenzae, бактериями других видов: Burkholderia cepacia complex, Achromobacter spp, метициллинрезистентный золотистый стафилококк, Stenotrophomonas maltophilia. В остальных случаях преобладает иная грамотрицательная флора [17, 18].
При установлении диагноза «муковисцидоз» после первого года жизни в клинической картине доминируют отставание в физическом развитии и прогрессия респираторного синдрома, может встречаться стеаторея. В более позднем возрасте манифестируют формы заболевания, вызванные более «мягкими» мутациями [19].
Рентгенографически определяемые изменения в легких неспецифичны и определяются характером вторичного воспалительного процесса. Определяются усиление легочного рисунка, его деформация и тяжистый характер. Наблюдаются преобладание перибронхиальных патологий, ретикулярные изменения, вовлечения в процесс периацинарных и перилобулярных соединительнотканных элементов. Корни легких расширены, стояние диафрагмы низкое, она малоподвижна, купол уплощен. Также может отмечаться легочное сердце.
Основные паттерны при муковисцидозе взрослых: наличие выраженных, не менее 200% от исходных размеров, бронхоэктазов с уплотнением и утолщением стенок бронхов; паттерн «перстня» при поперечном томографическом сечении бронхов; паттерн «парных полос» при соосном с бронхом сечении томографического среза; заполнение резко расширенных бронхов слизистыми пробками; мозаичная структура легочной ткани [15, 20].
Общепринятым считается, что консервативная терапия основана на применении антибактериальных препаратов и муколитиков. Для топического применения используются ингаляционные дыхательные системы с компрессорной подачей аэрозоля. Изучалось применение таких муколитических препаратов, как дорназа aльфа и 3–7%-ный гипертонический раствор хлорида натрия [21].
Основу схем лечения хронического риносинусита составляют топические глюкокортикостероиды (тГКС). При применении этих препаратов понижаются активность секреции желез, степень проницаемости сосудистой стенки, эозинофильного воспаления, синтез медиаторов воспаления и реактивность рецепторного аппарата. Цель хирургического лечения – восстановление адекватного носового дыхания и вентиляции околоносовых пазух, что необходимо для лучшей диффузии лекарственных средств и обеспечения адекватного дренирования.
Выбор мировых практиков – расширенная функциональная эндоскопическая синус-хирургия (FESS) со вскрытием естественных соустий пазух и их промывание растворами антибактериальных препаратов [22]. Планирование оперативного лечения возможно только при наличии КТ-исследования околоносовых пазух. После операции для профилактики возможных осложнений рекомендована консервативная терапия, включающая тГКС [21, 23].
Многие годы единственным доступным лечением была симптоматическая терапия. Основные задачи симптоматической терапии – борьба с легочными инфекциями и синдромом мальабсорбции. Для профилактики осложнений используют физические упражнения, физиотерапию, витамино- и диетотерапию, что позволяет значительно увеличить продолжительность и улучшить качество жизни пациентов [24]. Внутривенные лекарственные формы применяются при тяжелом течении, в то время как при среднетяжелых обострениях со стороны бронхолегочной системы назначаются пероральные и/или ингаляционные препараты [25].
Цель работы. Обобщение актуальных данных, опубликованных по теме кистозного фиброза, а также раскрытие вопросов этиологии, патогенеза, клиники и принципов диагностики, патологической анатомии, описание эпидемиологии, осложнений, возникающих вследствие данного патологического процесса, методов лечения.
Материалы и методы исследования. Был проведен анализ клинических, патоморфологических и статистических данных в опубликованной научной литературе.
Результаты исследования и их обсуждение
В патогенезе муковисцидоза наибольшее значение имеют мутации II класса, связанные с нарушением открытия хлорного канала и снижением стабильности CFTR в плазматической мембране, – это делеция фенилаланина, обнаруженная у 80% больных [10, 11].
В аспекте патоморфологии можно выделить схожесть микроскопических изменений с бронхоэктатической болезнью легких, так как определяются десквамированный эпителий с признаками плоскоклеточной метаплазии, наличие бронхоэктазов и диффузной воспалительной инфильтрации. Однако присутствуют и отличительные признаки: преобладание гипертрофированных слизистых клеток, тельца Массона в виде грануляционной ткани, а также инфильтрация межальвеолярных перегородок плазматическими клетками и лимфоцитами.
Клиническая картина первых стадий носит неспецифический характер, 3-я и 4-я стадии отличаются достаточно быстрым прогрессированием по сравнению с более ранними проявлениями, развитием осложнений и выраженной дыхательной недостаточности. Наблюдается формирование разрастание фиброзов с ограничением склерозированных участков, также появляются бронхоэктатические очаги, кистозные образования. Для 4-й стадии характерна тяжелая кардиореспираторная недостаточность, приводящая к смерти больного [15].
Частота хронического инфицирования дыхательных путей различной флорой, по данным регистра, в 2017 г. составила: S. aureus – 57,1%, P. aeruginosa (хроническое инфицирование) – 32,4%, P. Aeruginosa – 14,9%, Burkholderia cepacia complex – 6,2%, Achromobacter spp. – 4,6%, метициллинрезистентный золотистый стафилококк – 4,0%, Stenotrophomonas maltophilia – 3,5%. В 14,1% случаев дыхательные пути больных поражены другой грамотрицательной флорой [17, 18].
Из-за ограниченности клинических данных фармакокинетические параметры прогнозируются на основании информации, полученной у взрослых пациентов, так как в исследованиях участвует меньшее число больных детского возраста, а также существуют сложности с забором образцов крови, отсутствуют доступные лекарственные формы пероральных препаратов [26]. В настоящее время разрабатываются инновационные протоколы и программы для исследований, предназначенные для педиатрической практики [27].
Заключение
После анализа публикаций отечественных и зарубежных авторов можно отметить, что муковисцидоз – это часто встречающееся наследственное заболевание, которое обусловлено генетической мутацией, сочетающейся с полиорганной недостаточностью, наиболее выраженной со стороны дыхательной и эндокринной систем, что требует специализированного подхода к методам диагностики и выбору терапии. Основные патологические изменения отмечаются в бронхолегочной системе при накоплении слизистых сгустков, вызывающих обструкцию и воспалительные изменения дыхательных путей. Патогенная микрофлора легких, характерная для муковисцидоза, редко встречается при других заболеваниях, а ряд микроорганизмов проявляют нетипичные для них свойства.
Библиографическая ссылка
Яшин С.С., Юнусова Ю.Р., Исакова Н.В., Сердобольская Ю.В. КИСТОЗНЫЙ ФИБРОЗ (МУКОВИСЦИДОЗ) // Современные проблемы науки и образования. 2022. № 5. ;URL: https://science-education.ru/ru/article/view?id=32008 (дата обращения: 30.01.2026).
DOI: https://doi.org/10.17513/spno.32008



