Рак легких является одной из наиболее распространенных причин смерти среди онкологических больных [1]. В формировании рака легкого играют роль хронические воспалительные процессы в бронхах и ткани легких, поскольку, как и другие эпителиальные опухоли, рак легких развивается после ряда морфологических и молекулярных изменений, которые начинаются в гистологически нормальном эпителии [2]. Хотя на сегодняшний день многое известно о предрасполагающих факторах рака бронхов и легких, их патоморфозе, гистологических особенностях, наше понимание этой проблемы остается еще весьма неполным. В частности, большой интерес представляют ранние предраковые изменения, выявляемые на молекулярном, биохимическом и морфологическом уровнях, вопрос их обратимости, методы исследования, способные их обнаружить. Исторически приоритет в совершенствовании знаний о раке легких принадлежал изучению инвазивного рака, тем не менее, лучшее понимание патогенеза рака легких вызвало повышенный интерес к изучению морфологических аномалий, которые свидетельствуют не об инвазивном раке, а о начале канцерогенеза, поскольку рак легких не возникает внезапно в бронхиальном эпителии, но представляет собой многоступенчатый процесс, в котором постепенно происходящие и сменяющие друг друга генетические и клеточные изменения приводят к формированию инвазивных изменений (то есть к появлению злокачественной опухоли). Помимо академического интереса, вопрос об изучении факторов и маркеров опухолевой прогрессии при раке бронхов и легких имеет также непосредственное отношение к клинической ситуации – знание этих деталей, безусловно, поможет оптимизировать диагностику этой патологии.
Основным методом диагностики, позволяющим еще до появления клинических и рентгенологических симптомов диагностировать и морфологически подтвердить центральный рак легкого, является видеобронхоскопия [3]. При подозрении на опухолевый процесс в легком проводится взятие образца опухолевой ткани с последующим гистологическим исследованием [3]. Между тем, относительно диагностической ценности цитологического исследования мокроты, несмотря на то, что этот метод достаточно прост, неинвазивен, нет единого мнения.
Многие авторы полагают, что очень важно разграничить реактивные процессы от процессов начавшегося канцерогенеза в бронхолегочных злокачественных опухолях [4], поскольку хроническое воспаление, безусловно, вовлечено в развитие дисплазии дыхательных путей и рака легких [5].
Поэтому актуальным на сегодняшний день является изучение реактивных (воспалительных, дегенеративных и дисрегенераторных) процессов в эпителии бронхов при хроническом бронхите, так как разработка новых подходов к диагностике и терапии заболеваний, включая разработку методов профилактической направленности, методов широкого скрининга, всегда базируется на основе вновь выявляемых закономерностей патогенеза.
Цель исследования. Проведение сравнительной оценки реактивных изменений в стенке бронхов у пациентов с хроническим бронхитом и раком легких.
Материал и методы исследования. Обследованы 28 человек в возрасте от 42 до 65 лет с диагнозами: «хронический бронхит» (ХБ), «хроническая пневмония» (ХП), «бронхоэктатическая болезнь» (ББ) или диагнозом «новообразования в легком», который уточнялся в процессе обследования. Формирование групп пациентов осуществлялось с соблюдением принципов рандомизации. В процессе исследования сформированы 2 группы больных, основанием для разделения всей изучаемой выборки на две группы послужила формулировка основного диагноза. Таким образом, I группу составили пациенты с диагнозом «хронический бронхит вне обострения» (n=18); II группу – пациенты с диагнозом рака бронхов или легких (n=10). Группу сравнения (гистологическая норма стенки бронха) составили 12 человек, погибших в результате несчастных случаев от причин, не связанных с заболеваниями органов дыхания. Исследование одобрено локальным этическим комитетом Пермского государственного медицинского университета имени академика Е.А. Вагнера и проводилось в соответствии с принципами Хельсинкской декларации ВМА.
Всем пациентам проводили бронхоскопию (видеобронхоскоп Olympus BF-1T150, Olympus BF-1TH 190) с прямой биопсией слизистой оболочки трахеи и бронхов – из измененных участков стенки бронха, из устьев бронхов, дренирующих пораженный участок легкого – даже при отсутствии визуально выявляемых патологических изменений, а также из визуально не измененных участков бронха, фиксируя расстояние от края патологических изменений. Полученные образцы фиксировали в 10%-ном растворе забуференного по Лилли формалина (рН-7,2) в течение 12–24 ч, препараты изготовляли в соответствии со стандартными гистологическими методиками, окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону, альциановым синим с рН=2,5 по Стидмену (выявление кислых мукополисахаридов). Гистологические препараты микроскопировали с использованием светового микроскопа «Биомед-4», при увеличениях 10 х 10, 10 х 40. Статистический анализ выполнен при помощи программного пакета Biostat Pro 5.9.8 и приложения Microsoft® Excel полнофункционального офисного пакета Microsoft Office 2010. Распределение рядов устанавливали при помощи методов Колмогорова–Смирнова. Описательную статистику осуществляли методом расчета статистических показателей – мер рассеивания местоположения. Сравнительную статистику проводили с использованием Z-критерия для сравнения долей, критерия Стьюдента и однофакторного дисперсионного анализа для сравнения средних величин. Критический уровень значимости при проверке статистических гипотез принимали равным p<0,05.
Результаты исследования и их обсуждение
При изучении стенки бронха на светооптическом уровне визуализировалась слизистая оболочка трахеи и бронхов, представленная однослойным многорядным мерцательным эпителием, собственной пластинкой слизистой оболочки и расположенными под ней циркулярно ориентированными пучками гладкомышечных клеток, образующими в бронхах мышечную пластинку слизистой оболочки. В эпителии дифференцируются реснитчатые клетки; их ядра составляют верхний ряд ядер эпителия бронха; бокаловидные клетки (мукоциты) – светлые, крупные, бокаловидной формы, цитоплазма их заполнена слизью, содержащей большое количество гликозаминогликанов, ядра визуализируются на уровне выше ядер базального слоя; базальные, или короткие вставочные, клетки, тесно прилежащие к базальной мембране, их ядра формируют нижний ряд в эпителии, в отдельных клетках визуализируются митозы; длинные вставочные клетки, ядра которых составляют средний ряд эпителия, – переходные формы от базальных клеток к реснитчатым.
В подслизистой основе трахеи и бронхов, образованной рыхлой волокнистой соединительной тканью, выявляются концевые отделы слизисто-белковых бронхиальных желёз. Волокнисто-мышечно-хрящевая оболочка в трахее и крупных и средних бронхах образована бронхиальным хрящом с надхрящницей, а также плотной оформленной волокнистой соединительной тканью, в бронхах она фрагментирована, прослеживается нечетко. Наружная оболочка – адвентициальная – образована рыхлой волокнистой соединительной тканью.
При изучении стенки бронха на светооптическом уровне у пациентов с диагнозом «хронический бронхит» в эпителии слизистой оболочки бронхов выявляли гиперплазию бокаловидных клеток (55,55%), определяемую при окрашивании препаратов альциановым синим по Стидмену, а также появление гиперплазии базальных клеток (33,33%) и их дисплазии невысокой степени (44,44%, рис. 2), участков плоскоклеточной метаплазии эпителия бронхов у небольшой части пациентов (22,22%, рис. 1).
Также у определенного количества больных (44,44%) отмечался гиалиноз базальной мембраны (рис. 1), средняя толщина ее в этой группе составляет 6,489±1,037 мкм. Фиброз соединительной ткани в слизистой оболочке и подслизистой основе выражен умеренно (при окрашивании препаратов по Ван Гизону). Инфильтрация соединительной ткани смешанного характера – преимущественно нейтрофильными лейкоцитами (44,44%) и лимфоцитами (55,55%).
У пациентов с новообразованиями бронхов и легких (бронхопульмональный рак) в эпителии участка, удаленного от новообразования, в сравнении с картиной, наблюдаемой при хроническом бронхите, исчезают бокаловидные клетки (20,0%, р1=0,000), призматический эпителий сменяется плоским (метаплазированным) у большего числа больных (40,0%, р1=0,009), отмечаются умеренные гиперплазия (20,0%, р1=0,055) и дисплазия базальных клеток (20,0%, р1=0,000), но сохраняются участки нормального эпителия. Гиалиноз базальной мембраны нарастает (60,0%, р1=0,034) (толщина 4725±929 нм; р=0,238), как и фиброз соединительной ткани в слизистой оболочке и подслизистой основе. Из инфильтрата исчезают нейтрофильные лейкоциты (20,0%, р1=0,000), в нем появляются наряду с лимфоцитами (40,0%, р1=0,056) плазматические клетки (40,0%, р1=0,000).
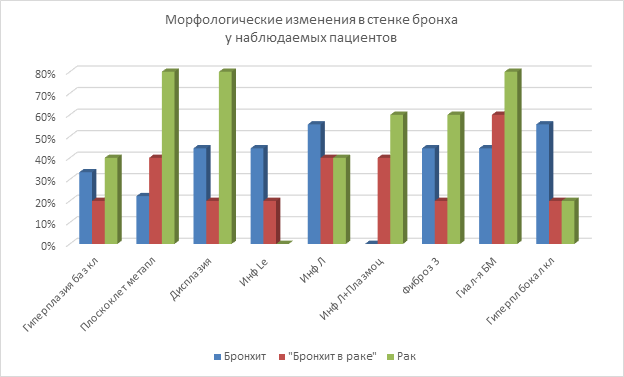
Рис. 1. Характер морфологических изменений в стенке бронха при хронических воспалительных и злокачественных процессах (примечание: «Гиперплазия баз кл» – «Гиперплазия базальных клеток»; «Плоскоклет метапл» – «Плоскоклеточная метаплазия»; «Инф Le» – «Инфильтрация нейтрофильными лейкоцитами»; «Инф Л» – «Инфильтрация лимфоцитами»; «Инф Л + Плазмоц» – Инфильтрация лимфоцитами и плазмоцитами»; «Фиброз 3» – «Выраженный фиброз»; «Гиал-я БМ» – «Гиалинизация базальной мембраны»; «Гиперпл бокал кл» – «Гиперплазия бокаловидных клеток»)
В самом новообразовании отмечаются плоскоклеточная метаплазия эпителия (80,0%, р1=0,000; р2=0,000), гиперплазия (40,0%, р1=0,378; р2=0,003) и дисплазия базальных клеток (80,0%, р1=0,000; р2=0,003), гиперплазия бокаловидных клеток встречается так же редко, как в предыдущей группе (20%, р1=0,000; р2=0,860). Нормальный эпителий практически не выявляется. Базальная мембрана гиалинизирована (80,0%, р1=0,000; р2=0,003), средняя ее толщина в этой группе образцов составляет 6,533±0,303; р=0,976 мкм (рис. 1, таблица). Фиброз соединительной ткани слизистой оболочки и подслизистой основы выраженный. В инфильтрате преобладают плазмоциты (60,0%, р2=0,007), лимфоциты встречаются в 40,0% случаев (р2=0,885); нейтрофилы не выявляются (р1=0,000).
Средняя толщина базальной мембраны в группах, нм (M±m)
|
I группа, хронический бронхит, n=18 |
II группа, удаленный участок, n=10 |
III группа, новообразование, n=10 |
|
6489±1037 |
4725±0929; р=0,238* |
6533±303; р=0,976* |
*р – по отношению к группе сравнения; для проведения статистического анализа использован критерий Стьюдента
Таким образом, выявлено следующее (рис. 2): гиперплазия базальных клеток встречается примерно с одинаковой частотой и при хроническом бронхите, и при раке легкого.
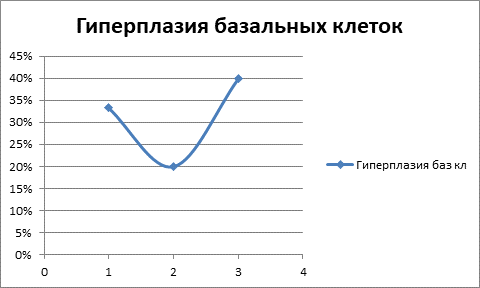
Рис. 2. Гиперплазия базальных клеток в слизистой оболочке бронхов у наблюдаемых пациентов (1 – группа пациентов с хроническим бронхитом; 2 – группа пациентов с онкозаболеванием, биопсия участка бронха, удаленного от места локализации новообразования; 3 – пациенты с онкозаболеванием, участок новообразования)
Неясным представляется уменьшение частоты встречаемости гиперплазии базальных клеток в слизистой оболочке бронха в удаленном от новообразования участке у онкологических пациентов. Отмечается статистически значимое нарастание встречаемости плоскоклеточной метаплазии в ряду: хронический бронхит – удаленный участок бронха при раке – рак. Дисплазия эпителия бронхов максимально выражена у пациентов с новообразованиями в участке новообразования, но неясным остается ее уменьшение в удаленном от новообразования участке относительно I группы пациентов (рис. 3).
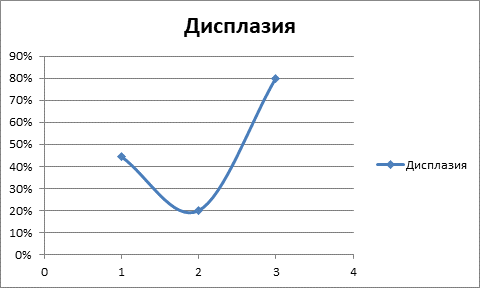
Рис. 3. Дисплазия эпителия бронхов у наблюдаемых пациентов (1 – группа пациентов с хроническим бронхитом; 2 – группа пациентов с онкозаболеванием, биопсия участка бронха, удаленного от места локализации новообразования; 3 – пациенты с онкозаболеванием, участок новообразования)
Относительно характера воспалительной инфильтрации подслизистой основы выявлено следующее: инфильтрация смешанного характера (нейтрофильные лейкоциты, лимфоциты) статистически значимо чаще выявляется у больных ХБ, нежели в биоптате с ХБ от больного с новообразованием легкого, и никогда не встречается в самом новообразовании. Инфильтрация лимфоцитами статистически значимо чаще встречается у пациентов с ХБ, чем у пациентов с новообразованиями в стенке бронха, у которых характер инфильтрации одинаков – в самом новообразовании и в анатомически удаленном от него участке. Инфильтрация плазматическими клетками совсем не встречается у больных с ХБ и статистически значимо нарастает в ряду: удаленный от новообразования участок – новообразование. Фиброз подслизистой основы максимально выражен у пациентов с раком в самом новообразовании. В участке, анатомически удаленном от опухоли, фиброз, как правило, умеренный. При ХБ выраженность фиброза варьирует. Гиалинизация базальной мембраны (БМ) статистически значимо нарастает в ряду: ХБ – удаленный от новообразования участок – новообразование. Тем не менее, средняя толщина ее статистически не различается в исследуемых группах (таблица). Гиперплазия бокаловидных клеток, напротив, статистически значимо реже встречается у онкологических больных – как в самом новообразовании, так и в удаленном от него участке.
По литературным данным известно, что, как и в случае других эпителиальных раков, рак легкого развивается в течение нескольких лет посредством ряда прогрессирующих изменений на молекулярном уровне, которые начинаются в гистологически нормальном эпителии. Плоскоклеточный рак развивается ступенчато и возникает после ряда реактивных, метапластических, предраковых и преинвазивных изменений; молекулярные изменения, которые происходят до начала инвазивного рака, многочисленны, они охватывают все шесть классических признаков рака, кроме инвазии и метастазирования. В крупных бронхах (которые могут быть последовательно отобраны с помощью эндоскопии) была описана серия плоскоклеточных изменений, ведущих от гиперплазии (либо базально-клеточной, либо слизистой), плоскоклеточной метаплазии, различных степеней дисплазии к карциноме in situ и инвазивному раку [6, 7]. При этом некоторыми авторами утверждается, что онкогенез зависит от сложных взаимодействий между генетически измененными опухолевыми клетками и окружающей их микросредой, главным образом, от активности фибробластов [8]. Поэтому при раке легкого интерстициальный фиброз является неблагоприятным фактором [9].
Заключение
Таким образом, в стенке бронха (в слизистой оболочке и подслизистой основе) при хронических воспалительных и злокачественных процессах наблюдаются сходные изменения, их выраженность нарастает по мере прогрессирования опухолевой трансформации. Это касается, прежде всего, существенного нарастания плоскоклеточной метаплазии и дисплазии базального эпителия бронхов. На этом фоне гиперплазия бокаловидных клеток, имеющая, по-видимому, в большей степени именно реактивный, компенсаторный характер, ослабевает по мере прогрессирования опухолевого процесса. По мере прогрессирования рака уменьшается также интенсивность лейкоцитарной инфильтрации, в большей степени нейтрофильной, нежели лимфоцитарной; в свою очередь, лимфоцитарная инфильтрация трансформируется в инфильтраты, образованные плазматическими клетками, что отражает реакцию иммунной системы на трансформацию собственно воспалительного процесса в злокачественный опухолевый процесс. Вместе с тем, по мере прогрессирования злокачественного новообразования нарастают (по-видимому, в большей степени вследствие нарастающей гипоксии) фиброз соединительной ткани и гиалиноз базальной мембраны бронхиального эпителия. Следовательно, течение реактивных процессов в слизистой оболочке бронхов при хроническом воспалении и злокачественных новообразованиях имеет не только существенные отличия, но и ряд общих тенденций, отражающих этапы трансформации воспалительной патологии в опухолевый процесс.
Библиографическая ссылка
Броян С.А., Косарева П.В., Сивакова Л.В., Самоделкин Е.И., Ложкина Н.В. РЕАКТИВНЫЕ ИЗМЕНЕНИЯ СТЕНКИ БРОНХА ПРИ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ И ЗЛОКАЧЕСТВЕННЫХ ПРОЦЕССАХ НА СВЕТООПТИЧЕСКОМ УРОВНЕ // Современные проблемы науки и образования. 2022. № 4. ;URL: https://science-education.ru/ru/article/view?id=31951 (дата обращения: 07.01.2026).
DOI: https://doi.org/10.17513/spno.31951



