Катехоламины (адреналин, норадреналин) являются компонентами стресс-реализующей системы. Их физиологические эффекты связаны с сужением периферических сосудов и улучшением кровообращения мозга и сердца, метаболические – с развитием гипергликемии. В результате их действия повышается потребность в кислороде и питательных веществах. Гемоглобин эритроцитов должен обеспечивать необходимую доставку кислорода. Наши исследования выявили, что при введении адреналина происходят сдвиги реологических показателей красной крови – повышается деформируемость эритроцитов, что улучшает их способность проходить через микрососуды [1].
Эволюционно стресс-реакция связана с риском кровотечения, поэтому еще одним важным эффектом катехоламинов является влияние на систему гемостаза. Наиболее изучено стимулирующее влияние адреналина на функции тромбоцитов, в частности на процесс их агрегации [2]. Несмотря на большое число работ, посвященных изменению функции тромбоцитов под влиянием катехоламинов, их морфологические особенности изучены мало, при этом не учитывается динамика изменений.
Цель исследования – изучение динамики морфофункциональных изменений тромбоцитов при гиперкатехоламинемии у крыс.
Материал и методы исследования. Исследование проводилось на 32 белых нелинейных крысах (самцах), находящихся в обычных условиях вивария. Имеется разрешение локального этического комитета на его осуществление (ФГБОУ ВО ИвГМА Минздрава России, № 6 от 26.05.2021 г.). Все работы проводились в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS № 123, Страсбург, 1986 г.). Гиперкатехоламинемию воспроизводили путем однократного подкожного введения эпинефрина – адреналина гидрохлорида (Московский эндокринный завод, Россия) в дозе 2 мг/кг [1]. У животных под золетиловым наркозом (1–2 мг на 100 г массы) из левого желудочка проводили забор крови в пробирку с цитратом натрия через 1 час (8 крыс), 24 часа (8 крыс) и 72 часа (8 крыс) после введения адреналина. Также были получены контрольные значения показателей у интактных животных (n=8). Кровь центрифугировали для получения обогащенной тромбоцитами плазмы (ОТП) 15 минут при 1000 об/мин, затем ее использовали для исследования агрегации тромбоцитов оптическим турбидиметрическим методом на анализаторе агрегации тромбоцитов АТ-02 (Россия). В качестве индуктора агрегации применяли раствор АДФ (ООО «Технология Стандарт», Россия) в конечной концентрации 5 мкмоль/л. Для оценки агрегационной активности тромбоцитов определяли следующие параметры: латентный период (лаг-фаза, с), скорость агрегации на 30-й секунде (%/мин), максимальная степень агрегации (%), время достижения максимальной амплитуды (с), степень дезагрегации (%). Оставшуюся ОТП повторно центрифугировали 10 мин при 3000 об/мин. Полученную надосадочную жидкость убирали, а осадок смешивали с 2,5%-ным раствором глутарового альдегида («Sigma-Aldrich», США) для фиксации тромбоцитов. Далее их переносили на предметное стекло и делали мазок. Морфологическое исследование проводилось при увеличении ×900 (иммерсионный объектив) с помощью микроскопа с цифровой окулярной камерой «ZEISS Axio Scope.A1» (Германия). Изображение обрабатывалось и анализировалось при помощи программы GNU ImageManipulationProgram (GIMP 2.10.14, США). Определяли длину и ширину клеток, рассчитывали площадь и индекс элонгации тромбоцита (ИЭ). 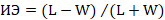 , где L – длина, W – ширина. Расчет производился на 300 клеток. На основании особенностей окраски препарата рассчитывался индекс омоложения тромбоцитов (ИОТр) как соотношение количества «молодых» и «старых» кровяных пластинок [3]. При использовании в качестве красителя азур-эозина доля структур красного цвета отражает насыщенность тромбоцитов гранулами, т.е. более зрелых клеток, а увеличение количества структур, имеющих синюю окраску, указывает на появление большого количества молодых форм тромбоцитов. Доля зеленой компоненты отражает функциональную активность тромбоцитов. Анализ полученных результатов проводился в программе Statistica с расчетом t-критерия Стьюдента, а также непараметрического критерия парных сравнений Вилкоксона. Данные представлены в виде средней арифметической и ошибки среднего (M±m). Статистическая значимость различий соответствовала p≤0,05.
, где L – длина, W – ширина. Расчет производился на 300 клеток. На основании особенностей окраски препарата рассчитывался индекс омоложения тромбоцитов (ИОТр) как соотношение количества «молодых» и «старых» кровяных пластинок [3]. При использовании в качестве красителя азур-эозина доля структур красного цвета отражает насыщенность тромбоцитов гранулами, т.е. более зрелых клеток, а увеличение количества структур, имеющих синюю окраску, указывает на появление большого количества молодых форм тромбоцитов. Доля зеленой компоненты отражает функциональную активность тромбоцитов. Анализ полученных результатов проводился в программе Statistica с расчетом t-критерия Стьюдента, а также непараметрического критерия парных сравнений Вилкоксона. Данные представлены в виде средней арифметической и ошибки среднего (M±m). Статистическая значимость различий соответствовала p≤0,05.
Результаты исследования и их обсуждение. Через 1 час после введения адреналина отмечались существенные функциональные изменения тромбоцитов. При анализе агрегации тромбоцитов происходило изменение практически всех ее показателей: увеличение лаг-фазы, снижение скорости и степени агрегации по сравнению с контрольными значениями (табл. 1).
Таблица 1
Динамика показателей агрегации тромбоцитов при введении адреналина
|
Показатели |
Группа |
|||
|
Контроль |
1 час |
24 часа |
72 часа |
|
|
Лаг-фаза, с |
8,90±0,19 |
13,3±1,60* |
9,25±0,55# |
8,29±0,26 |
|
Скорость агрегации, %/мин |
52,51±4,70 |
1,85±0,29* |
35,5±3,34*# |
55,7±6,17# |
|
Степень агрегации, % |
61,69±3,09 |
5,38±1,10* |
54,8±3,21# |
62,8±4,09 |
|
Степень дезагрегации, % |
3,01±0,44 |
0,00±0,00* |
2,13±0,68# |
7,75±1,43*# |
Примечание: здесь и далее * – достоверное отличие от исходных значений (р<0,05), # – достоверное отличие от предыдущего срока наблюдения (р<0,05).
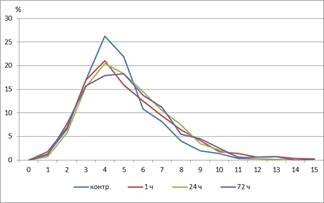
При оценке морфологии длина тромбоцитов достоверно увеличивалась, а ширина значительно снижалась, что приводило к возрастанию ИЭ и площади этих постклеточных структур (табл. 2). При оценке гистограмм распределения тромбоцитов по площади (рис. 1) в контроле мы наблюдали следующие особенности: максимальное количество тромбоцитов с площадью 4–5 мкм2 – 26%, немного меньше с площадью 5–6 мкм2 – 22%. Через 1 час у экспериментальных животных отмечалось уменьшение амплитуды модального класса до 21%. Вторым по частоте размером тромбоцитов являлся 3–4 мкм2 – 17%, при этом повышался процент более крупных клеток, то есть увеличивалась ширина распределения, что говорит о большей гетерогенности популяции тромбоцитов.
Таблица 2
Динамика морфофункциональных параметров тромбоцитов при введении адреналина
|
Показатели |
Группа |
|||
|
Контроль |
1 час |
24 часа |
72 часа |
|
|
Длина, мкм |
3,25±0,024 |
3,76±0,028* |
3,38±0,024*# |
3,53±0,024*# |
|
Ширина, мкм |
2,05±0,014 |
1,92±0,017* |
2,12±0,014*# |
2,03±0,016# |
|
Площадь тромбоцитов, мкм2 |
5,22±0,050 |
5,69±0,069* |
5,64±0,058* |
5,68±0,063* |
|
ИЭ, у.е. |
0,217±0,005 |
0,319±0,005* |
0,222±0,004*# |
0,258±0,004*# |
|
ИОтр, у.е. |
2,04±0,040 |
2,47±0,063* |
2,42±0,053* |
2,96±0,084*# |
|
Доля зеленого цвета, у.е. |
0,257±0,004 |
0,208±0,003* |
0,168±0,003*# |
0,172±0,002* |
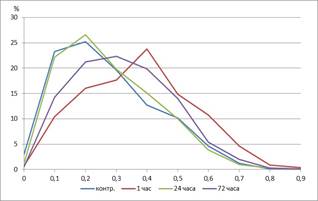
При оценке распределения клеток по ИЭ (рис. 2) наблюдалось смещение гистограммы вправо (в сторону увеличения) с максимумом этого показателя 0,3–0,5 у.е., при этом в контроле у большинства клеток он составлял менее 0,3 у.е.
|
|
|
|
Рис. 1. Кривая распределения тромбоцитов по площади. Ось абсцисс – площадь, мкм2, ось ординат – %. |
Рис. 2. Кривая распределения тромбоцитов по индексу элонгации. Ось абсцисс – индекс элонгации, у. е., ось ординат – %. |
Также отмечались увеличение отношения доли синего оттенка спектра к красному и снижение зеленой компоненты, что свидетельствовало об увеличении доли тромбоцитов со сниженной функциональной активностью (табл. 2).
Через 24 часа после введения адреналина по сравнению с предыдущим сроком наблюдения увеличивались скорость агрегации и ее максимальная амплитуда, при этом первый показатель не достигал контрольных значений, а второй возвращался к уровню контроля (табл. 1). Длина форменных элементов в этот период наблюдения уменьшалась, ширина увеличивалась, соответственно площадь не менялась по сравнению с предыдущим сроком наблюдения, по сравнению с контрольными значениями названные показатели тромбоцитов оставались повышенными (табл. 2). Пик гистограммы распределения по площади оставался на уровне 1-го часа, правая ветвь гистограммы растягивалась, свидетельствуя об увеличении количества клеток большего размера (рис. 1). ИЭ снижался почти на 40%, достигая значений в контроле, кривая распределение тромбоцитов по этому показателю также возвращалась к исходным значениям (рис. 2). ИОТр сохранялся на уровне предыдущего срока наблюдения, при этом оставаясь достоверно выше, чем в контроле, а доля зеленого спектра продолжала снижаться (табл. 2).
Через 72 часа показатели агрегатограммы практически не отличались от контрольных значений, за исключением времени достижения максимальных значений. Также обращало на себя внимание значительное повышение степени дезагрегации тромбоцитов, что свидетельствует о меньшей прочности агрегатов и увеличении обратимости этого процесса (табл. 1). При оценке морфологии тромбоцитов по сравнению с предыдущим сроком наблюдения площадь клеток достоверно не менялась, однако они становились длиннее и уже, что отражалось на увеличении ИЭ (табл. 2). Относительно контрольных значений сохранялись повышенными длина, площадь и ИЭ. На гистограмме распределения тромбоцитов по площади наблюдались снижение амплитуды максимума и смещение его вправо (рис. 1). При оценке распределения тромбоцитов по индексу элонгации отмечалось отсутствие характерных пиков, кривая имеет куполообразную форму; это говорит о том, что в крови в равной степени циркулируют клетки с индексом элонгации от 0,1 до 0,5 у.е. (рис. 2). По сравнению с предыдущим сроком наблюдения и контролем график был смещен вправо. При анализе цвето-яркостных характеристик препаратов отмечалось значительное увеличение доли синего оттенка относительно предыдущих сроков наблюдения, что сопровождалось еще большим возрастанием ИОТр. Зеленая компонента оптической плотности тромбоцитов сохранялась на уровне первых суток наблюдения, оставаясь значительно ниже, чем в контроле.
Фармакокинетика эпинефрина при подкожном введении характеризуется максимальной концентрацией его в крови через 5–10 минут с развитием максимального эффекта через 20 минут, который сохраняется 1–4 часа. При этом подключаются эндогенные стресс-реализующие механизмы: повышаются активность гипоталамо-гипофизарно-надпочечниковой системы, симпатоадреналовой системы, выработка вазопрессина. Таким образом, выброс биологически активных веществ из тромбоцитов под влиянием адреналина и их гиперактивация происходят в первые 30 минут.
В нашем эксперименте мы наблюдаем последствия острой гиперкатехоламинемии. Снижение показателей агрегатограммы через 1 час после введения адреналина может являться результатом формирования второй стадии диссеминированного внутрисосудистого свертывания. При этом происходят активация адренорецепторов тромбоцитов, повышение уровня внутриклеточного кальция. Запуск Ca2+-зависимых сигнальных механизмов приводит к активации различных ферментов, что существенно отражается на морфологии этих постклеточных структур. Такая сверхактивация тромбоцитов способствует образованию микрочастиц, что меняет их морфологию – уменьшается число форменных элементов с размером 4–5 мкм2, но возрастает с меньшим размером. Результатом этих изменений является выделение на поверхности тромбоцитов маркеров апоптоза, приводящее к их разрушению [4]. Другим механизмом нарушений агрегации, а также увеличения размеров тромбоцитов может быть изменение водного и ионного баланса в организме под влиянием стресс-реализующих систем, которые способствую возникновению гипернатриемии и гиперволемии.
Также в развитии морфофункциональных изменений играет роль смещение кислотно-основного баланса крови. Известно, что гиперкатехоламинемия является классической экспериментальной моделью отека легких. Введенная доза достаточна для его развития. Следовательно, в начале формируется респираторный ацидоз за счет нарушения газообмена и перфузии в легких, к которому присоединяется и метаболический. Развитие ацидоза также меняет ионный баланс клеток, что отражается на концентрации эндогенного кальция и состоянии цитоскелета тромбоцитов [5].
Известно, что высокое содержание катехоламинов в крови приводит к продукции особой популяции удлиненных, биполярных так называемых протромбоцитов. Это менее зрелые клетки с функциональной инертностью. Протромбоциты способны секвестироваться в селезенку и возвращаться в кровоток под действием катехоламинов. Они не способны взаимодействовать друг с другом и тромбоцитами других субпопуляций. Выброс значительного количества инертных протромбоцитов в циркуляцию является защитной реакцией организма против развития массированного тромбоза в условиях повышенного содержания в крови активаторов тромбоцитов [6].
Исследования концентрации газовых трансмиттеров при гиперкатехоламинемии выявили повышение монооксида углерода в крови в первый час эксперимента [7]. По данным литературы, это соединение нарушает взаимодействие между тромбоцитами и, следовательно, тормозит их агрегацию [8].
Увеличение отношения доли синего оттенка спектра к красному свидетельствует об омоложении популяции тромбоцитов, вероятно, за счет выхода из депо. При этом снижение зеленой компоненты – признак их более низкой функциональной активности, что является результатом выброса биологически активных веществ и подготовки тромбоцитов к апоптозу. Стимулировать его может, в том числе, монооксид углерода [9].
Через 24 часа функция тромбоцитов восстанавливается и даже превышает контрольные значения. Вероятно, к этому времени уже разрушены «сверхактивированные» форменные элементы и активно продуцируются новые, в частности в легких, которые являются экстрамедуллярным источником значительного количества тромбоцитов. Выше уже упоминалось про формирование отека легких в ответ на введение адреналина. В нашем исследовании эти органы могут стать важным источником этих форменных элементов, а местная эндотоксемия и свободнорадикальные процессы повышают агрегационную способность тромбоцитов. Также нельзя забывать о высокой концентрации стресс-реализующих гормонов, которые тоже увеличивают агрегацию. По данным литературы, через сутки в крови количество тромбоцитов биполярной формы начинает снижаться в результате формирования перетяжек на концах и отделения новых дискоидных тромбоцитов. Будучи молодыми клетками, они содержат все необходимые для жизнедеятельности белки, которые передаются отделяющимся от них дискоидным тромбоцитам, уже функционально активным [6].
Восстановление показателей агрегации на 3-и сутки эксперимента и усиление дезагрегации, низкая зеленая компонента оптической плотности, предположительно, связаны с повышением содержания оксида азота в крови. Концентрация этого трансмиттера, по данным наших предыдущих наблюдений, повышается как раз через 72 часа после введения адреналина [7]. Оксид азота является антиагрегантом, так как снижает как поступление кальция в тромбоциты из крови, так и высвобождение эндогенного кальция. Также сохраняется повышенная продукция тромбоцитов, что отражается на интенсивности синего спектра и индекса омоложения [10].
Заключение. Таким образом, через 1 час после введения адреналина значительно снижаются функции тромбоцитов, при этом увеличиваются размеры, индекс элонгации и возрастает содержание молодых форм. Через 24 часа их функция усиливается на фоне повышенного образования этих форменных элементов. Через 72 часа активность тромбоцитов становится близкой к нормальной, однако размеры и их продукция выше контроля. Такая динамика изменений в начале эксперимента может быть связана с преимущественным действием стресс-реализующих механизмов, а в конце наблюдения – с влиянием стресс-лимитирующих систем.
Работа является частью комплексного исследования по реализации государственного задания ФГБОУ ВО «ИвГМА» Минздрава России на 2022 год «Функциональный резерв гемостаза и реологии крови при гипоксических состояниях в норме и патологии».
Библиографическая ссылка
Касяник М.Л., Пахрова О.А., Иванова А.С. ДИНАМИКА МОРФОФУНКЦИОНАЛЬНЫХ ИЗМЕНЕНИЙ ТРОМБОЦИТОВ У КРЫС ПОД ВЛИЯНИЕМ АДРЕНАЛИНА // Современные проблемы науки и образования. 2022. № 4. ;URL: https://science-education.ru/ru/article/view?id=31939 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/spno.31939