Введение
Грибовидный микоз (ГМ) – редкое заболевание, которое является наиболее распространенным типом кожной неходжкинской зрелой Т-клеточной лимфомы. Первично ГМ возникает на коже без признаков поражения других органов и характеризуется инфильтрацией кожи зрелыми злокачественными Т-клетками. Согласно четвертому изданию классификации ВОЗ первичных кожных лимфом «Синей книги» ВОЗ по классификации опухолей кожи, ГМ развивается медленно, имеет вялотекущее течение, 5-летняя выживаемость составляет 88% [1, 2]. Однако при выявлении ГМ на поздней стадии отмечается вторичное поражение лимфатических узлов, крови и внутренних органов. Заболевание приобретает неблагоприятный прогноз с медианой выживаемости менее 5 лет. ГМ чаще диагностируется у взрослых или пожилых людей, соотношение мужчин и женщин составляет 2:1, а заболеваемость во всем мире составляет примерно 5–6 случаев на 1 миллион человек в год. Среднее время от появления симптомов до постановки диагноза в ретроспективных исследованиях составляет 3-–4 года, но может превышать четыре десятилетия [3].
Этиология ГМ неизвестна, однако выделяют факторы риска и триггеры заболевания, к которым относят ультрафиолетовое излучение, низкий уровень витамина DД в организме, инфицирование золотистым стафилококком, дерматофитами, микобактериями лепры, хламидиями, Т-клеточным лимфотропным вирусом человека типа 1, вирусом Эпштейна-–ББарр и вирусом простого герпеса. Среди лекарственных препаратов, которые могут спровоцировать развитие ГМ, отмечают антигистаминные, антигипертензивные средства, анитидепрессанты, диуретики (например, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента, ингибиторы обратного захвата серотонина, гидрохлоротиазид) [4].
Патогенез ГМ сложен и связан с нарушением регуляции сигнальных путей в Т-лимфоцитах кожи. Поверхность кожи здорового взрослого человека содержит примерно 20 миллиардов Т-клеток, что почти в два2 раза больше, чем во всем кровотоке. Предполагается, что Т-клетки являются наиболее мигрирующими клетками в организме, поступая в периферические ткани, а затем возвращаясь обратно в кровоток посредством миграции через лимфатические узлы. От 5% до 10% Т-клеток, находящихся в нормальной коже человека, представляют собой регуляторные Т-клетки (Treg). Эти клетки имеют решающее значение для предотвращения развития аутоиммунных реакций, индуцирования толерантности к аутоантигенам и подавления продукции цитокинов. Тем не менее, Treg играют важную роль в уклонении неопластических клеток от иммунного ответа, усиливая механизмы ответа опухоли на иммунный ответ. Однако при ГМ роль этих клеток неоднозначна. Большинство исследований свидетельствуют о наличии большого количества клеток Treg на ранней стадии заболевания (пятна/бляшки), в то время как на поздних стадиях ГМ количество этих клеток значительно ниже [5]. Один из механизмов молекулярного патогенеза ГМ может включать неадекватную активацию Т-клеток через презентацию антигена с последующим накоплением неопластических Т-клеток памяти. Регулировать функцию Т-лимфоцитов кожи способны клетки микроокружения лимфомы. Например, дендритные клетки могут играть двойную роль: противоопухолевую на ранних стадиях и туморогенную на поздних стадиях ГМ. Важную роль в прогрессировании ГМ можегут играть снижение количества регуляторных B-лимфоцитов, продуцирующих интерлейкин-10, и повышение количества опухольассоциированных макрофагов в микроокружении опухоли [5, 6]. Изучаеются рольи кератиноцитов, и их взаимодействие и перекрестная передача сигналов между стромальными и злокачественными Т-клетками, что может приводить к прогрессированию ГМ [7].
Изменение сигнальных путей также играет важное значениеважную роль в патогенезе ГМ. Активная пролиферация Т-лимфоцитов может наблюдаться при повышении экспрессии белка Ki-67, уровень которой увеличивается по мере прогрессирования заболевания и дисбалансе в системе цитокинов [8]. Описаны изменения опухольсупрессивных микроРНК (miR), таких как miR-16, miR-29, miR-150 и miR-26, связанных с инвазией опухоли и метастазированием при прогрессирующей кожной Т-клеточной лимфоме. Изучение функционирования микроРНК при данной патологии может способствовать улучшению ранней диагностики и разработке вариантов персонализированной терапии ГМ [9].
Кожные поражения ГМ обычно представлены четко очерченными, часто зудящими эритематозными пятнами разного размера и интенсивности окрашивания, расположенными в не подвергающихся воздействию солнца областях «купального костюма», включая грудь, ягодицы, нижнюю часть туловища и пах. Поражения кожи в виде бляшек представлены выступающими над поверхностью кожи красными, темно-красными или коричневыми бляшками с гладкой поверхностью, сопровождающиесясопровождающимися зудом и шелушением. При трансформации бляшек в опухоль происходит образование растущих узлов темно-красного цвета с вовлечением в процесс лимфатических узлов и других органов. При классическом течении заболевания изменения в коже проходят последовательно 3 стадии: пятно -– бляшка -– опухоль. Однако у некоторых пациентов все три типа поражений кожи могут наблюдаться одновременно. Это многообразие проявлений затрудняютзатрудняет диагностику заболевания и требуюет дифференцировать ГМ с другими кожными заболеваниями, такими, как экзема, фолликулит, пигментированные пурпурные дерматозы, псориаз, витилиго, лишай, а также острый лихеноидный питириаз и вариолиформный отрубевидный лишай [10]. К сожалению, биопсия кожи на ранних стадиях заболевания не всегда является информативной, что связано с отсутствием специфических изменений на этом этапе [11]. По данным C. Massone C. (2005), задокументированная частота ложноотрицательных результатов гистологического исследования при ГМ составляет 40%, а ложноположительных результатов – 44% [12].
Отмечено, что гистологические изменения при ГМ могут совпадать с некоторыми доброкачественными воспалительными состояниями, такими, как вторичный сифилис, реакции на укусы членистоногих, хронический актинический дерматит, хроническая кожная красная волчанка, грибковые инфекции, меланома [13]. Поэтому, в случае отсутствия четких клинических и гистологических данных, диагноз ГМ может быть поставлен на основании определения клональности Т-клеток и оценки аберрантной потери экспрессии Т-клеточного антигена с помощью иммуногистохимического анализа на маркеры CD2, CD3, CD5 и CD7 лимфоцитов кожи.
Цель исследования :
Иизучить клиническую картину, особенности диагностики и дифференциальной диагностики ГМ на примере клинического случая.
Материалы и методы исследования
Представлен клинический случай. Пациент С., 57 лет, обратился к дерматологуерматовенерологу с жалобами на наличие высыпаний по типу мелких пузырьков на коже кистей, которые сопровождались выраженным зудом. Впервые вышеуказанные жалобы появились 5 лет назад. Самостоятельно применял мазь «Фторокорт» и антигистаминные средства с временной положительной динамикой. Однако через год зудящиеся высыпания стали появляться на шее и лице, и пациент обратился к дерматовенерологулогу. Был выставлен диагноз: «Ээкзема», пациент получил курс стационарного лечения, после которого объем высыпаний уменьшился, но остался выраженный кожный зуд. Спустя 2 года пациент отметил появление высыпаний и на нижних конечностях, что послужило поводом для обращения пациента на консультацию к аллергологу. Исследование развернутого анализа крови и биохимических показателей крови, мочи и кала на наличие гельминтов не выявило отклонений от референсных значений. Аллергологический, наследственный анамнез был не отягощен, профессиональных вредностей не отмечено. Пациенту был выставлен диагноз: «Атопический дерматит, III возрастной период, смешанная форма». Дальнейшее применение мазей с глюкокортикостероидами было неэффективно, и пациент с целью дифференциальной диагностики пациент был повторно консультирован дерматовенерологомлогом. При объективном осмотре в области лица – инфильтрация застойного синюшно-серого цвета по типу «маски льва» (рис. 1), лихенификация, инфильтрация в области кистей и предплечий (рис. 2)., Ггиперпигментация кожи передней поверхности грудной клетки (рис. 3). На коже голеней пятна и узлы застойного коричневато-синего цвета. Отмечается увеличение паховых лимфатических узлов. Для исключения лимфопролиферативного заболевания было выполнено гистологическое исследование.
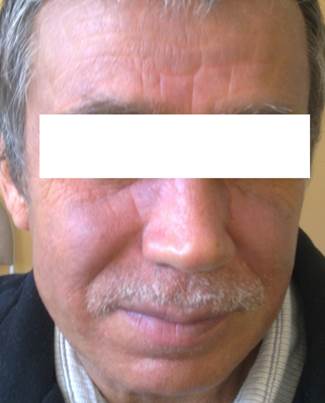
Рис. 1. Высыпания на лице у пациента с грибовидным микозом. На коже лица имеется эритема синюшно-серого оттенка, кожа плотная, отечная, с явлением лихенификации
Fig.1 Eruptions on the face of a patient with mycosis fungoides. On the skin of the face there is a bluish-gray erythema, the skin is dense, edematous with lichenification
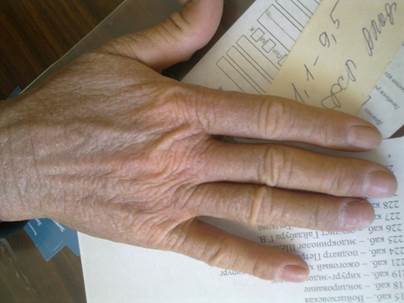
Рис. 2. Кожа кисти пациента с грибовидным микозом. Кожа плотная, бурого цвета с гиперпигментацией и синюшным оттенком за счет инфильтрации, лихенифицирована
Fig.2 Hand skin of a patient with mycosis fungoides. The skin is dense, brown in color with hyperpigmentation and a bluish tinge due to infiltration, lichenified
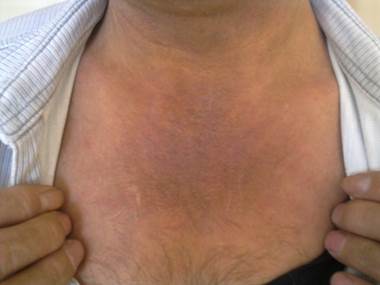
Рис. 3. Кожа передней поверхности грудной клетки у пациента с грибовидным микозом. Кожа уплотненная с лихенификацией, синюшного оттенка с гиперпигментацией
Fig.3 Skin of the anterior surface of the chest in a patient with mycosis fungoides. Skin compacted with lichenification, bluish tint with hyperpigmentation
Результаты исследования и их обсуждение
Результаты гистологического исследования: фрагмент кожи с явлениями невыраженного акантоза эпидермиса и наличия в дерме очагового инфильтрата смешанного состава. Преимущественно инфильтрат представлен лимфоидными элементами малого размера. Очагово отмечаются явления эпидермотропизма с распространением лимфоидных элементов в толще эпидермиса, часть интраэпидермально расположенных лимфоцитов имеет церебриформные ядра, зону перинуклеарного просветления. Микроабсцессы Потрие в представленных препаратах не определяются. Также в составе инфильтрата определяются в небольшом количестве крупные клетки типа иммунобластов, единичные эозинофилы, макрофаги, имеется очаговая пролиферация сосудов малого диаметра. Заключение: морфологическая картина подозрительна в отношении грибовидного микоза, для постановки окончательного диагноза необходимо проведение иммуногистохимического исследования.
Результаты иммуногистохимического исследования: клетки, формирующие дермальный инфильтрат и проявляющие эпидермотропизм (интраэпителиальные), в подавляющем большинстве имеют Т-клеточную дифференцировку и экспрессируют CD3 (100%), CD7, CD5, CD4. Интраэпидермальные лимфоциты экспрессируют CD8. Интраэпидермальными лимфоцитами не экспрессирован CD7. Дермальными Т-клетками экспрессирован CD3 (100%), CD7 (до 70%), CD4 (до 60%), CD8 (до 20%), CD5 (100%). Ki-67 экспрессирован Т-клетками эпидермотропного инфильтрата (до 10%). Активированные немногочисленные В-клетки, экспрессирующие CD30, формируют примесь в дермальном инфильтрате, а также распределены в виде небольших скоплений в глубжележащих отделах дермы. Заключение: полученная иммуноморфологическая картина выявила признаки аберрантного иммунофенотипа интраэпидермальных Т-клеток, что при имеющейся морфологической картине и соответствующих клинических данных свидетельствуюет в пользу грибовидного микоза.
Заключение
ГМ представляет собой заболевание, имеющее схожие проявления с другими поражениями кожи. Так как по данным эпидемиологических исследований установлен рост распространенности меланомы и других злокачественных новообразований кожи во многих странах мира, в том числе и в России [14, 15], врачу-дерматовенерологу в своей тактике при диагностике и дифференциальной диагностике дерматозов, в том числе с хроническим течением и отсутствием улучшений на фоне проводимой терапии, необходимо помнить об онконастороженности. Для дифференциальной диагностики ГМ необходимо проведение гистологического, а зачастуюо и иммуногистохимического исследования, которое позволяет с высокой достоверностью диагностировать у пациента данное заболевание.
Библиографическая ссылка
Котова К.В., Токмакова В.О., Окладникова Е.В., Палкина Н.В. СЛУЧАЙ ГРИБОВИДНОГО МИКОЗА // Современные проблемы науки и образования. 2022. № 4. ;URL: https://science-education.ru/ru/article/view?id=31868 (дата обращения: 18.02.2026).
DOI: https://doi.org/10.17513/spno.31868



