Оперативное лечение посттравматических, постостеомиелитических, а также ятрогенных дефектов костной ткани является актуальной проблемой современной травматологии и ортопедии [1]. Ранее использованные технологии не только часто не решали проблему, но и при формировании осложнений создавали новую [2]. Для решения данного вопроса на новом технологическом уровне в 1995–1997 гг. в Центре биотехнологий Национального института рака (Генуя, Италия) и Институте ортопедии Рицоли (Болонья, Италия) проводили эксперимент на животных с целью определения возможности применения полученных из костного мозга остеогенных стромальных клеток в сочетании с гидроксиапатитной керамикой при замещении костных дефектов. Объектом исследования стали 10 животных (овец), у которых экспериментально создавали дефект трубчатой кости, в который впоследствии внедряли биокерамический имплантат. Проведенные макроскопические, гистологические и рентгенологические исследования уверенно констатировали наличие роста периостальной кости, а также проникновение костной ткани внутрь пор имплантата с его полным заполнением. Теория эксперимента о том, что сочетание остеоиндуктивных свойств стромальных клеток костного мозга с ранее доказанными в многочисленных работах остеотропными свойствами гидроксиапатитной керамики позволяет стимулировать заполнение дефекта костной ткани, подтвердилась [3, 4, 5]. Учитывая полученные данные [6, 7], стало возможным обсудить применение данной технологии в медицинской практике. Коллегами из Италии в качестве клинической базы был выбран Уральский НИИ травматологии и ортопедии (ныне Уральский институт травматологии и ортопедии имени В.Д. Чаклина). Этот выбор был связан, в первую очередь, с большим практическим опытом применения различных керамических имплантатов в травматологии и ортопедии, а также с возможностями проведения оперативного лечения с применением аппаратов внешней фиксации, а по показаниям – и интрамедуллярной фиксации. После прохождения локального этического комитета с целью решения вопроса о возможности применения методики, на основании решения профильной проблемной комиссии и Ученого совета организаций, принявших участие в работе, а также при наличии согласия пациента на оперативное лечение и использование стволовых клеток больные включались в группу исследования. Исследование проводилось в соответствии с положениями Хельсинкской декларации по доклиническим и клиническим исследованиям, принятой Всемирной медицинской ассоциацией.
Все вышеперечисленное стало достаточным основанием для начала совместной работы. Данное исследование выполнено в рамках государственного задания по научной работе ГАУЗ «ЦСВМП «УИТО имени В.Д. Чаклина» (руководители д.м.н. И.Л. Шлыков, д.м.н. К.А. Бердюгин), ФГБОУ ВО УГМУ МЗ РФ (руководитель член-корр. РАН С.М. Кутепов,) регистрационный номер 121031900054-8, ФГБУН «ИИФ» УрО РАН (руководитель академик РАН В.А. Черешнев).
Цель исследования: изучение отдаленных (свыше 5 лет) исходов оперативного лечения пациентов с дефектом костной ткани при впервые примененном керамическом имплантате, насыщенном аутологичными стромальными клетками костного мозга. Принимая во внимание, что в настоящее время многие клиники нашей страны используют аналогичные технологии, отметим, что данный клинический пример иллюстрирует первое применение столь передового метода лечения.
Материал и методы исследования. В течение 1998–1999 гг. в УНИИТО были прооперированы 8 пациентов с дефектами длинных трубчатых костей (плечевой, лучевой, большеберцовой). Причинами образования дефектов у пациентов служили формирование гипотрофического псевдоартроза костей после перелома или отсутствие регенерата при проведении удлинения сегмента аппаратом внешней фиксации. Максимальный размер костного дефекта составлял 28,3 см³.
Первым этапом пациенту на основании рентгенометрии определяли величину дефекта с учетом зоны иссечения кости для изготовления и последующей установки керамического имплантата, составляли чертеж имплантата. Вторым этапом проводили забор костного мозга из крыла подвздошной кости путем пункции ее с обеих сторон. В две пробирки помещали 15 мл пунктата, а также в отдельную пробирку – 30 мл крови, взятой из кубитальной вены. Пробирки помещали в стандартный евроконтейнер для перевозки биологического материала, который автомобильным транспортом перевозили в аэропорт г. Екатеринбурга для транспортировки в г. Москву, а затем в Центр биотехнологий г. Генуя. Срок транспортировки составлял не более 24 часов. На культивирование остеогенных стромальных клеток, изготовление и насыщение крупнопористого гидроксиапатитного керамического имплантата и его обратную транспортировку требовалось, в среднем, до 30 суток, после чего имплантат пересылался в УНИИТО. Весь этот период времени пациенты проводили под постоянным наблюдением в клинике, с тем чтобы исключить возможные контакты с инфекционными больными, повторные травмы и иные медицинские и социальные проблемы, которые могли бы осложнить предстоящее оперативное вмешательство.
Оперативное лечение проводилось стандартным образом, методом фиксации имплантата был выбран способ внеочагового остеосинтеза трубчатой кости как наименее травматичный и позволяющий осуществлять необходимую контролируемую компрессию на стыке «кость – имплантат». Пациенты находились в клинике до заживления кожных покровов, стабилизации общего состояния и для первичного наблюдения за мягкими тканями вокруг спиц аппарата внешней фиксации до 30 суток, затем выписывались под амбулаторное наблюдение. Рентгенологическое исследование проводилось ежемесячно в течение первого года после операции, затем в сроки, кратные 6 месяцам.
Рентгенологические признаки начальной остеоинтеграции определялись через месяц после операции с неуклонным прогрессированием в дальнейшем.
Решение о демонтаже аппарата внешней фиксации принималось строго индивидуально, основным критерием было наличие верифицированного сращения на уровне стыка «кость – имплантат». Сроки пребывания пациента в аппарате составили от 5 до 10 месяцев.
Результаты исследования и их обсуждение. В качестве клинического примера представляем наблюдение пациента П. (история болезни 95472), которому в 2000 г. проведена операция по замещению костного дефекта керамическим имплантатом, насыщенным остеогенными стромальными клетками.
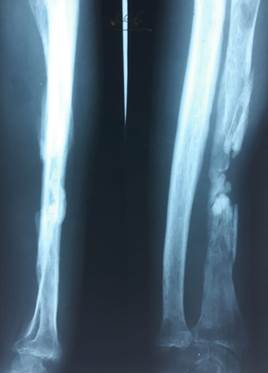
Травма получена 06.08.1999 г. на производстве, перелом носил открытый характер. В районной больнице поселка Шаля произведена первичная хирургическая обработка раны, наложена гипсовая повязка. Последующее наблюдение показало отсутствие сращения отломков, формирование псевдоартроза средней трети диафиза левой лучевой кости (рис. 1). Пациент был направлен для консультации и оперативного лечения в УНИИТО.
26.06.2000 г. госпитализирован в отделение УНИИТО с клиническим диагнозом: посттравматический дефект средней трети левой лучевой кости (8,8 см), сгибательно-разгибательная контрактура левого локтевого сустава, ротационная контрактура левого предплечья. Жалобы на нарушение функции левой верхней конечности, периодические боли в левом предплечье. Клинически: левое предплечье в глубокой гипсовой шине от головок пястных костей до локтевого сустава. По задней поверхности – в средней трети предплечья втянутый рубец длиной 15 см, плотный, прочно спаян с подлежащими тканями. Ось левого предплечья не нарушена. Выраженная атрофия мышц левого предплечья (–3 см). Имеется сгибательная контрактура левого локтевого сустава под углом 160° и разгибательная контрактура левого лучезапястного сустава под углом 160°. Движения в левом локтевом суставе: сгибание 70°, разгибание 160°, в левом лечезапястном суставе: тыльная флексия 0°, ладонная флексия 135°, ульнарная девиация 2°, радиарная –17°. Имеется нарушение чувствительности по тыльной поверхности 1-го пальца левой кисти. Сосудистых расстройств нет. Оценка качества жизни по Oswestry Disability Index (ODI) 40% – умеренное нарушение (пациент испытывает значительные боли и трудности при сидении, поднимании предметов и стоянии). Оценка по VAS 5–6 баллов – боль средней интенсивности. Оценка по SF-36 – 55 баллов.
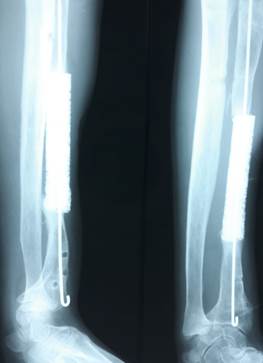
03.07.2000 г. был произведен забор костного мозга из крыльев подвздошной кости, 02.08.2000 г. – замещение дефекта средней трети диафиза левой лучевой кости керамическим имплантатом, насыщенным стволовыми клетками, остеосинтез аппаратом Илизарова и интрамедуллярной спицей (рис. 2).
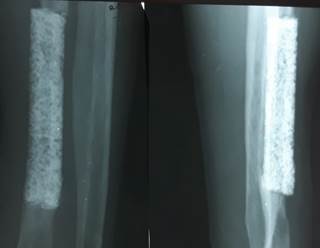
27.06.2001 г. произведен демонтаж аппарата Илизарова по поводу формирующегося костно-керамического блока в средней трети диафиза левой лучевой кости (рис. 3).
10.09.2001 г. произведено удаление интрамедуллярной спицы из левой лучевой кости.
При контрольном осмотре через 5 лет жалоб на боли в левой верхней конечности не предъявляет. Клинически: ось конечности правильная. Кожный рубец спокоен. Отечности тканей предплечья не выявлено. Сохраняется атрофия мышц левого предплечья на 2 см. Сохраняется ограничение разгибания в левом локтевом суставе до 160°, сгибание полное, дефицита движений в лучезапястном суставе нет. Длины сегментов равны, относительные длины конечностей равны. Рентгенологически определяется перестройка зоны «кость – имплантат» без зоны локального лизиса костной ткани, склероза проксимального и дистального фрагментов костного ложа. Результатом оперативного лечения пациент доволен (рис. 4).
Оценка качества жизни по Oswestry Disability Index (ODI) 5% – минимальное нарушение (пациент может осуществлять все виды жизнедеятельности). Оценка по VAS 1–2 балла в нагрузке – легкая боль. Оценка по SF-36 – 100 баллов.
|
|
|
|
Рис. 1. Рентгенограмма левого предплечья в двух стандартных проекциях. Определяется наличие псевдоартроза средней трети диафиза левой лучевой кости |
Рис. 2. Произведены замещение дефекта средней трети диафиза левой лучевой кости керамическим имплантатом, насыщенным стволовыми клетками, остеосинтез аппаратом Илизарова и интрамедуллярной спицей |
|
|
|
|
Рис. 3. Демонтирован аппарат внешней фиксации, определяются признаки формирующегося костно-керамического блока |
Рис. 4 Отдаленный результат оперативного лечения – полностью сформировавшийся костно-керамический блок, с полным восстановлением функции верхней конечности |
Выводы
1. Полученный исход оперативного лечения по результатам клинического, рентгенологического и функционального исследования следует считать отличным.
2. Предложенный способ применения крупнопористых керамических имплантатов, насыщенных аутологичными стромальными клетками костного мозга, может стать эффективной альтернативой травматичным и дорогостоящим способам устранения дефектов костной ткани.
Библиографическая ссылка
Бердюгин К.А., Кутепов С.М., Шлыков И.Л., Бердюгина О.В. ПЕРВЫЙ ОПЫТ ПРИМЕНЕНИЯ НА УРАЛЕ КЕРАМИЧЕСКИХ ИМПЛАНТАТОВ, НАСЫЩЕННЫХ АУТОЛОГИЧНЫМИ СТРОМАЛЬНЫМИ КЛЕТКАМИ КОСТНОГО МОЗГА, ПРИ ДЕФЕКТЕ ЛУЧЕВОЙ КОСТИ (СЛУЧАЙ ИЗ ПРАКТИКИ) // Современные проблемы науки и образования. 2022. № 3. ;URL: https://science-education.ru/ru/article/view?id=31839 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31839