Сердечно-сосудистые заболевания являются серьезной причиной снижения качества жизни пациентов, инвалидизации и смертности населения большинства стран мира, стабильно занимая лидирующее положение среди неинфекционной патологии. В России доля смертности от сердечно-сосудистой патологии достигает 56% [1, 2]. Максимальное распространение в настоящее время получила ишемическая болезнь сердца (ИБС), ассоциированная с атеросклерозом коронарных артерий, которая может быть причиной острого инфаркта миокарда с последующим формированием постинфарктного кардиосклероза и развитием других прогностически неблагоприятных осложнений [3]. Рост атеросклеротического поражения всего сосудистого русла в целом и ишемической болезни сердца в частности отчетливо связан с изменением образа жизни, развитием метаболического синдрома и сахарного диабета, также прогрессирующих в последние десятилетия [4].
По частоте встречаемости с ИБС соперничают нарушения сердечного ритма, в частности фибрилляция предсердий, несколько уступают им пороки сердца разного генеза. Несмотря на снижение доли ревмокардитов в общей популяции, происходит нарастание патологии клапанов и подклапанного аппарата сердца, ставшей следствием дилатации его полостей, гипертрофии миокарда или атеросклероза аорты, а также инфекционного эндокардита, который может развиваться как на исходно интактных, так и подверженных дегенеративным изменениям или имеющих врожденные дефекты клапанах. Заболеваемость инфекционным эндокардитом составляет порядка 3–10 на 100 000 населения с летальностью до 30% через 30 дней [5].
Комплексный клинический синдром, развивающийся на фоне любой сердечно-сосудистой патологии и ассоциированный со структурной и функциональной несостоятельностью миокарда, получил название «сердечная недостаточность» (СН), которую многие авторы выделяют как самостоятельную нозологическую единицу.
Результаты многочисленных эпидемиологических исследований, в том числе регистров ADHERE, EHFS-I, OPTIMIZ-HF, позволяют уверенно говорить о значимом и быстром росте числа пациентов с СН. Исследования показывают, что в среднем каждый пятый человек в своей жизни сталкивается с этим синдромом [6, 7]. Декомпенсация хронической сердечной недостаточности, при которой происходит повреждение сердечной мышцы и органов-мишеней, представляет наибольшую опасность для жизни пациента, кардинально меняя течение болезни и повышая риск летального исхода [8].
В связи с этим вопрос выявления нарушения функций миокарда, в том числе поиск признаков нарушения его метаболизма, является важной и актуальной проблемой здравоохранения.
В настоящее время для диагностики болезней сердца широко применяется эхокардиография с допплеровским исследованием [9]. Также известны способы диагностики поражений миокарда с применением нагрузочных тестов, в том числе в виде перемещения пациента в горизонтальной плоскости с динамической эхокардиографией [10]. Стандарты включают значительный перечень лабораторных методов выявления признаков сердечной недостаточности и нарушений метаболизма сердечной мышцы, спектр которых постоянно расширяется. В большинстве случаев лабораторные диагностические методы недостаточно специфичны, могут быть проявлением ряда других заболеваний и требуют дорогостоящего оборудования или расходных материалов.
Часто при выполнении оперативного вмешательства, особенно со значительной операционной травмой при резекции участка миокарда, лабораторные методики могут давать ложноположительные реакции, не позволяя вовремя заподозрить сердечно-сосудистые осложнения, которые являются причиной летальных исходов [11, 12]. Поэтому целесообразно обратить пристальное внимание на поиск методов скрининговой диагностики нарушений метаболизма миокарда у кардиохирургических пациентов в послеоперационном периоде.
Одним из перспективных методов верификации изменений обмена веществ является инфракрасная (ИК) спектроскопия сыворотки крови, позволяющая определить полный спектр находящихся в ней веществ, содержащих Р-О- и С-О-связи, к которым относятся все липиды, фосфорилированные белки, углеводы, креатинфосфокиназа и другие соединения [13, 14]. Метод ИК-спектроскопии при заболеваниях сердечной мышцы позволяет исследовать изменения в содержании его метаболитов, которые можно рассматривать как диагностические маркеры патологии миокарда и использовать при оценке риска возникновения данной патологии [15].
Цель исследования – выявление возможностей инфракрасной спектроскопии сыворотки крови при верификации нарушения метаболизма миокарда и оценке эффективности лечения кардиохирургических больных в послеоперационном периоде.
Материалы и методы исследования
С целью выявления специфических признаков заболеваний миокарда были обследованы 120 больных кардиохирургического профиля на базе ГБУ«Специализированная кардиохирургическая больница» Нижнего Новгорода, составившие основную группу, в которую вошли кардиологические больные с:
- ишемической болезнью сердца (ИБС) (n=80);
- длительно существующей фибрилляцией предсердий (ФП) (n=20);
- гемодинамически значимыми пороками сердца (n=20).
Группу контроля составили здоровые добровольцы, при комплексном обследовании которых не выявлено аритмий, заболеваний миокарда, подклапанного аппарата и клапанов сердца (n=50). От каждого пациента получено информированное добровольное согласие на участие в исследовании.
Забор крови в объеме 5 мл для комплекса исследований проводили накануне операции, а также в послеоперационном периоде на 1–10-е сутки утром, натощак, из кубитальной вены. Кровь пациента центрифугировали со скоростью 1000 об/мин в течение 15 мин. Отделенную сыворотку в количестве 1,0 мл высушивали в сухожаровом шкафу в чашке Петри при температуре 25°С на протяжении 24 часов. Сухой остаток сыворотки измельчали и суспензировали в вазелиновом масле.
Исследование компонентов энергетического метаболизма в обеих группах проводили методом ИК-спектроскопии сыворотки крови в области 1200–1000 см-1, характерной для фосфорсодержащих соединений [16]. В основной группе ИК-спектры определялись до и после оперативного вмешательства. Данные спектроскопии соотносились с основным диагнозом и тяжестью состояния пациента, определенными в соответствии со стандартными критериями (физикальное и лабораторное обследование, электрокардиография, эхокардиография, коронарография). При этом выделялись группы с наличием или отсутствием декомпенсации, т.е. прогрессирующей/тяжелой сердечной недостаточности.
На первом этапе исследования проводили измерение высот пиков полос поглощения с максимумами при 1165, 1160, 1150, 1140, 1130, 1100, 1070, 1050, 1040, 1025, 1005 см-1. На втором этапе математической обработки определяли значения отношений высот пиков полос поглощения (см-1/см-1): П1 – 1005/1050; П2 – 1165/1025; П3 – 1160/1165; П4 – 1040/1070; П5 – 1040/1150; П6 – 1070/1165; П7 – 1165/1150; П8 – 1025/1005; П9 – 1165/1140; П10 – 1150/1005; П11 – 1165/1130; П12 – 1070/1025; П13 – 1100/1050; П14 – 1005/1160 [17, 18].
Полученные данные по характеристикам поглощения ИК-излучения сыворотки крови были обработаны на IBM PC/AT с помощью пакетов прикладных программ Statistica-6.0 (Windows XP) и Microsoft Excel с использованием методов одномерной статистики. Результаты представляли в виде М±m, где М – среднее арифметическое, m – стандартное отклонение. Значимость различий средних значений определяли по t-критерию Стьюдента. Выборки считались принадлежащими к разным генеральным совокупностям при p≤0,05.
Результаты исследования и их обсуждение. В первой части исследования для выявления критериев диагностики нарушений метаболизма миокарда рассчитывали значения 14 параметров ИК-спектров сыворотки крови [17] обследуемых с различными заболеваниями сердца, после чего полученные значения сравнивали со значениями этих параметров крови здоровых добровольцев контрольной группы (табл. 1).
Таблица 1
Значения параметров инфракрасных спектров у здоровых лиц
|
№ пика |
П1 |
П2 |
П3 |
П4 |
П5 |
П6 |
П7 |
|
Значение |
0,55±0,15 |
0,57±0,11 |
1,41±0,07 |
1,25±0,29 |
1,06±0,13 |
1,22±0,40 |
0,54±0,06 |
|
№ пика |
П8 |
П9 |
П10 |
П11 |
П12 |
П13 |
П14 |
|
Значение |
1,35±0,21 |
0,50±0,08 |
1,95±0,32 |
0,84±0,26 |
1,01±0,41 |
0,28±0,17 |
0,7±0,07 |
Параметры, не вошедшие в интервалы нормы, суммировали и делили на общее количество параметров. Расчеты производили по формуле: Σ Пn /14, где n=1, 2 … 14. В ходе расчетов установили, что для выбранных патологий (ишемическая болезнь сердца, фибрилляция предсердий, пороки сердца) отношение ΣПn /14 принимает значение ≥0,21. В результате полученные отношения сравнивали с величиной 0,21, выбранной авторами на основании математических расчетов и анализа клинических данных, и делали заключение о наличии нарушения метаболизма миокарда.
По результатам математической обработки данных ИК-спектроскопии в основной группе четко выделились 3 подгруппы по нозологии.
В ходе исследования в подгруппе пациентов с ишемической болезнью сердца получены следующие значения 14 параметров, представленных в таблице 2.
Таблица 2
Значения параметров инфракрасных спектров у пациентов с ишемической болезнью сердца
|
№ пика |
П1 |
П2 |
П3 |
П4 |
П5 |
П6 |
П7 |
|
Значение |
0,81±0,09 |
0,31±0,03 |
1,40±0,03 |
1,24±0,02 |
1,35±0,05 |
2,05±0,15 |
0,52±0,02 |
|
№ пика |
П8 |
П9 |
П10 |
П11 |
П12 |
П13 |
П14 |
|
Значение |
1,45±0,03 |
0,89±0,07 |
1,80±0,11 |
0,35±0,06 |
1,12±0,09 |
0,23±0,04 |
0,9±0,09 |
Значения 7 параметров, которые не попали в интервалы нормы (П1, П2, П5, П6, П9, П11, П14), делили на общее число рассчитываемых значений отношений – 14. Полученная величина составила 0,50 (больше 0,21), что позволило заподозрить у пациентов этой подгруппы нарушение метаболизма сердечной мышцы.
Подгруппа пациентов с длительно существующей фибрилляцией предсердий при изучении тех же 14 параметров показала большее несоответствие: 9 показателей не соответствовали аналогичным в контрольной группе (П1, П2, П3, П4, П8, П10, П11, П13, П14) (табл. 3).
Таблица 3
Значения параметров инфракрасных спектров у пациентов с длительно существующей фибрилляцией предсердий
|
№ пика |
П1 |
П2 |
П3 |
П4 |
П5 |
П6 |
П7 |
|
Значение |
1,01±0,05 |
0,29±0,04 |
1,53±0,02 |
1,78±0,11 |
0,99±0,06 |
1,34±0,11 |
0,59±0,03 |
|
№ пика |
П8 |
П9 |
П10 |
П11 |
П12 |
П13 |
П14 |
|
Значение |
1,11±0,03 |
0,48±0,02 |
2,56±0,09 |
0,44±0,07 |
1,39±0,05 |
0,53±0,05 |
0,92±0,11 |
Отношение Σ Пn / 14 составило 0,64, что также демонстрировало высокую вероятность поражения миокарда.
В третью подгруппу основной группы вошли пациенты с гемодинамически значимыми пороками сердца (такими как митральная недостаточность, митральный стеноз и аортальный стеноз 2–3-й степени). При оценке 14 параметров отмечено всего 3 значения отношений, не соответствующих норме (П1, П4, П14) (табл. 4).
Таблица 4
Значения параметров инфракрасных спектров у пациентов с гемодинамически значимыми пороками сердца
|
№ |
П1 |
П2 |
П3 |
П4 |
П5 |
П6 |
П7 |
|
Значение |
0,40±0,11 |
0,55±0,05 |
1,45±0,03 |
0,80±0,12 |
1,10±0,03 |
1,30±0,09 |
0,54±0,04 |
|
№ |
П8 |
П9 |
П10 |
П11 |
П12 |
П13 |
П14 |
|
Значение |
1,39±0,04 |
0,51±0,03 |
1,99±0,05 |
0,70±0,11 |
0,67±0,17 |
0,19±0,07 |
0,60±0,02 |
Отношение Σ Пn / 14 составило 0,21, что также позволило подозревать у этой подгруппы пациентов формирование нарушения метаболизма сердечной мышцы.
Таким образом, метод ИК-спектроскопии сыворотки крови позволяет выявить признаки поражения миокарда при ишемической болезни сердца, длительно существующей фибрилляции предсердий и гемодинамически значимых пороках сердца.
Предлагаемый способ диагностики малоинвазивен и может быть рассмотрен в комплексе экспресс-диагностики и скринингового обследования большой популяции пациентов для выявления значимых нарушений метаболизма миокарда.
Вторая часть исследования касалась мониторинга нарушений метаболизма сердечной мышцы в послеоперационном периоде. Для оценки состояния миокарда после хирургического лечения заболевания сердца у пациентов, прооперированных в условиях искусственного кровообращения, рассчитывали значения двух параметров ИК-спектров сыворотки крови – П1, П2, отражающих содержание АТФ и глюкозы соответственно [14, 17] (табл. 5).
Таблица 5
Изменение параметров инфракрасных спектров сыворотки крови кардиохирургических больных в послеоперационном периоде
|
Сроки забора крови |
Отношения пиков полос поглощения |
||
|
П1 |
П2 |
||
|
Группа контроля |
|||
|
В начале исследования |
0,55±0,15 |
0,57±0,11 |
|
|
Основная группа |
|||
|
Перед операцией |
0,80±0,09* |
0,34±0,05* |
|
|
После операции (без декомпенсации / с декомпенсацией) |
1-е сутки |
1,28±0,21** |
0,22±0,03** |
|
3-и сутки |
0,89±0,10*/ 1,04±0,13*,** |
0,27±0,01*,**/ 0,12±0,03*,** |
|
|
6-е сутки |
0,73±0,09 |
0,27±0,01*,** |
|
|
9-е сутки |
0,63±0,05** |
0,32±0,01* |
|
* – различия статистически значимы по сравнению с группой контроля (р≤0,001).
** – различия статистически значимы по сравнению с основной группой до операции (р≤0,001).
У пациентов с благоприятным течением послеоперационного периода (без признаков декомпенсации, т.е. прогрессирующей/тяжелой сердечной недостаточности) значения исследуемых параметров статистически значимо (р≤0,001) изменяются и приближаются к норме. Однако при неблагоприятном течении послеоперационного периода нормализации значений параметров П1, П2 ИК-спектров сыворотки крови не наблюдалось и сердечная недостаточность прогрессировала (вплоть до летального исхода), или положительная динамика устанавливалась на более поздних этапах послеоперационного периода при наличии декомпенсации с тяжелой сердечной недостаточностью в ранние сроки.
Клинический пример 1. Больной К., 47 лет, оперирован по поводу ишемической болезни сердца: выполнено маммарокоронарное шунтирование передней нисходящей артерии и аортокоронарное шунтирование задней нисходящей артерии. В 1-е сутки после операции проводились инотропная поддержка миокарда, искусственная вентиляция легких с негативными изменениями ИК-спектров. Дальнейшее послеоперационное течение гладкое, без осложнений: по данным ИК-спектроскопии, на 3-и, 6-е и 9-е сутки отмечается положительная динамика со снижением значений П1 до уровня лучшего, чем в дооперационном периоде, и повышением значений П2 (рис. а).
Клинический пример 2. Больной Б., 44 лет, госпитализирован для оперативного лечения по поводу ишемической болезни сердца, проведено многокомпонентное 5-сосудистое маммароаортокоронарное шунтирование в условиях искусственного кровообращения. В послеоперационном периоде сохранялась клиника ишемии миокарда в бассейне дистальной трети передней нисходящей коронарной артерии, требовались пролонгированная инотропная поддержка миокарда и искусственная вентиляция легких. Послеоперационный период осложнился явлениями тампонады сердца, потребовавшей рестернотомии с эвакуацией сгустков крови из полости перикарда и заднего средостения. Сохраняющаяся ишемия стала причиной стентирования дистальной трети передней нисходящей коронарной артерии.
В послеоперационном периоде, несмотря на интенсивную терапию, длительно сохранялась клиника декомпенсации сердечной недостаточности: по данным ИК-спектроскопии, в 1-е и 3-и сутки состояние ухудшалось. В дальнейшем состояние стабилизировалось, а на 6-е сутки была отмечена положительная клинико-лабораторная динамика с регрессом ишемических явлений по данным инструментальных исследований, что нашло отражение в ИК-спектре сыворотки крови (рис. б).
Клинический пример 3. Больной М., 46 лет, поступил в клинику в связи с прогрессирующими клиническими проявлениями ишемической болезни сердца после уже перенесенного инфаркта миокарда. У пациента имелась аневризма левого желудочка с гипокинезией его нижней стенки, акинезом переднего и септального сегментов в средней и апикальной трети. Диагноз был подтвержден и детализирован в ходе комплексного обследования: выявлены окклюзия передней нисходящей коронарной артерии от устья с заполнением дистальных сегментов передней нисходящей артерии через межсистемные коллатерали, а также окклюзия огибающей артерии в средней трети, стеноз 1–2-й степени устья рано отходящей ветви тупого края, атероматоз и стеноз 2-й степени в среднем сегменте правой коронарной артерии. Фракция выброса левого желудочка составляла 33%, конечный диастолический и систолический объемы – 201 и 134 мл соответственно, ударный объем – 66 мл, митральная регургитация. Пациенту было показано хирургическое лечение. Были выполнены резекция аневризмы и пластика левого желудочка по Дору, пластика митрального клапана на опорном кольце, маммарокоронарное шунтирование передней нисходящей артерии, аортокоронарное шунтирование интермедиальной артерии.
С учетом критической сердечной недостаточности в послеоперационном периоде начата внутриаортальная баллонная контрпульсация, которая продолжена при переводе в отделение реанимации и интенсивной терапии. При пробуждении больной был неадекватен, отмечалось выраженное психомоторное возбуждение. На следующие сутки после операции сохранялось крайне тяжелое состояние за счет прогрессирующей сердечной, а затем и полиорганной недостаточности, отмечались снижение фракции выброса до 24%, прирост гликемии до 172 mg/dl. Еще через сутки отмечены клиника нарушения мозгового кровообращения, гипотония, что потребовало увеличения доз мезатона и кардиотоников для инотропной стимуляции миокарда. В биохимических анализах отмечался высокий уровень сердечных трансаминаз. Через 2 суток – резкое прогрессирование сердечной недостаточности, развитие комы III с лихорадкой до 39°С. Немедленно начаты реанимационные мероприятия, не принесшие результата: констатирована биологическая смерть (рис. в).
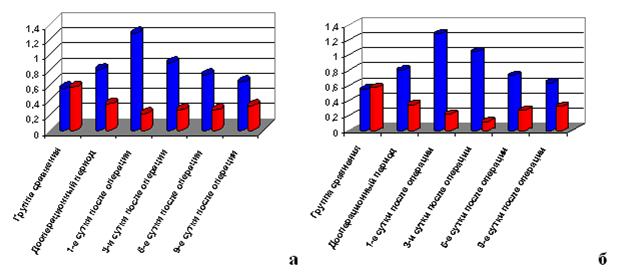
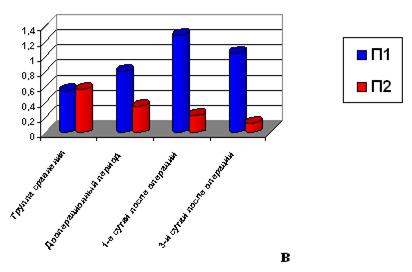
Изменение параметров ИК-спектров плазмы крови пациентов в послеоперационном периоде: а) без сохранения декомпенсации сердечной недостаточности; б) с сохранением декомпенсации сердечной недостаточности; в) с сохранением тяжелой декомпенсации сердечной недостаточности (летальный исход)
Таким образом, с помощью ИК-спектроскопии сыворотки крови можно также оценить эффективность проводимого лечения и прогнозирования состояния больных или исхода заболевания. В перспективе возможно использовать этот метод в качестве скринингового, дающего быстрый комплексный результат, и при положительной динамике данных обработки ИК-спектрограмм отказаться от постоянного мониторинга большого объема лабораторных данных. При отрицательной динамике, выявленной по данным инфракрасной спектроскопии, предполагается дополнительная детализация с применением методов, регламентированных клиническими рекомендациями и стандартами оказания медицинской помощи.
Заключение. Метод ИК-спектроскопии сыворотки крови расширяет арсенал имеющихся клинических приемов в данной области обследования кардиологических больных: он помогает клиницистам проанализировать выраженность изменений метаболических процессов в раннем послеоперационном периоде, что позволяет своевременно скорректировать проводимое лечение, персонифицировав его выбор.
Библиографическая ссылка
Красникова О.В., Немирова С.В., Гордецов А.С., Кондрашина О.В., Пискунова М.С., Кольтюкова Н.В., Федоров С.А. ПРИМЕНЕНИЕ ИНФРАКРАСНОЙ СПЕКТРОСКОПИИ СЫВОРОТКИ КРОВИ В КАРДИОЛОГИИ ДЛЯ ВЕРИФИКАЦИИ ПАТОЛОГИИ МЕТАБОЛИЗМА МИОКАРДА И ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ КАРДИОХИРУРГИЧЕСКИХ БОЛЬНЫХ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ // Современные проблемы науки и образования. 2022. № 3. ;URL: https://science-education.ru/ru/article/view?id=31823 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31823



