На сегодняшний день спинномозговая травма остается одним из наиболее сложно курируемых заболеваний, чаще приводящих к инвалидности пациентов. Разработка методов, способных восстановить утраченные функции спинного мозга, актуальна, учитывая, что СМТ поражает трудоспособное население, в том числе детей и молодежь. За последние десятилетия были рассмотрены различные подходы лечения спинномозговой травмы, включая формирование новых методик лечения, таких как применение блокаторов натриевых каналов, блокаторов кальциевых каналов, гормональная терапия, применение клеточных культур. По данным Новосёловой И.Н. и др. от 2019 года, на территории РФ ежегодно устанавливается диагноз СМТ у 8 тыс. человек. В 10–12% случаев травма спинного мозга затрагивает два и более уровней, множественные повреждения встречаются у 34%. По различным причинам травмы, сочетанные повреждения встречаются в 22–70% случаев, в 18–61% - кататравма. Ежегодный прирост пострадавших в возрастном диапазоне от 16 до 30 лет составляет 63,0 пациентов, моложе 40 лет - 80,0 (уровень доказательности A) [1]. По данным Scivoletto et al. за 2017 год, в России частота СМТ составляет 30 случаев на миллион населения. При этом 78% составляют мужчины, 22% женщины. По типу повреждения наиболее часты: частичное повреждение спинного мозга, которое представлено 56% от общего числа случаев, 46% - полное пересечение спинного мозга. По их подсчётам, лидирующими причинами СМТ в России являются автодорожные и спортивные травмы (уровень доказательности A) [2]. Цель исследования: обзор современных неоперативных методик лечения спинномозговой травмы с учётом патофизиологии формирования вторичного повреждения спинного мозга и возможность их применения в практике.
В обзор включены данные исследований по патогенезу и лечению спинномозговой травмы, опубликованные с 2014 по 2022 г., представленные в электронных базах PubMed, Google Scholar, Elsevier, National Institutes of Health (NIH). Поиск вёлся по ключевым словам: spinal cord injury, SCI, spinal cord injury therapy, spinal cord injury pathogenesis, spinal shock, hyper-interleukin-6. Стратегия поиска представлена на схеме ниже. Всего в обзор вошло 50 статей. Осуществлялся поиск полнотекстовых статей в основном на английском языке, представлена 1 статья на русском языке. Контакта с авторами статей не было.
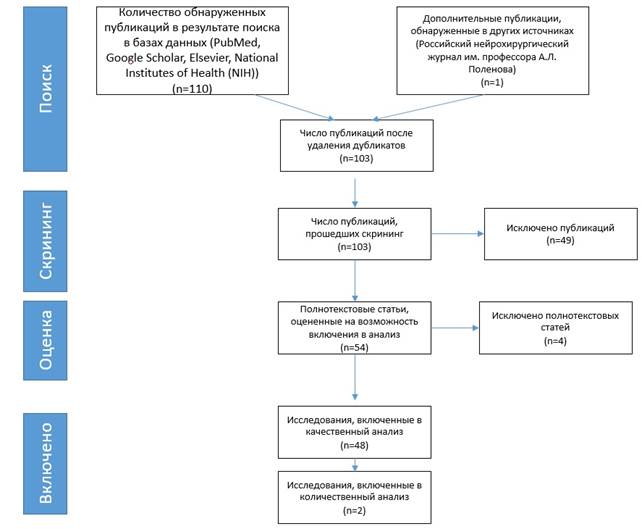
Рис. 1. Стратегия поиска научных статей
Обнаружено 111 научных статей. Их них в обзор вошло 50. В качественный анализ включено 48 статей, в количественный анализ 2 статьи (рис. 1). На рис. 2 представлено количество опубликованных исследований по запросу spinal cord injury в базе PubMed, показывающее экспоненциальный рост за последние 20 лет. Это подтверждает растущий рост интереса к изучению патогенеза и методам лечения пациентов со спинномозговой травмой и актуальность систематизации этих методов. В таблице приведены возможные места приложения лекарственных препаратов.
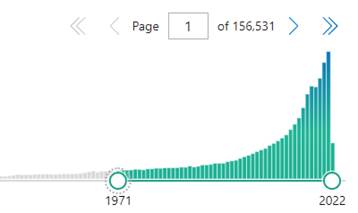
Рис. 2. Количество опубликованных исследований в базе PubMed по запросу spinal cord injury
Медицинские препараты, имеющие нейропротекторный эффект, цель и время их применения
|
Препарат |
Время применения |
Обоснование применения |
|
Рилузол |
Первые 12 часов |
Снижение площади отёка за счёт блокировки Na/Ca каналов и снижения числа Na в межклеточном пространстве |
|
Нимодипин |
Первые 15 минут до 2 суток |
Уменьшение выброса Ca и сохранения активности АТФ, снижение активности Na/K-насоса, снижение числа Na в межклеточном пространстве, снижение глутамата в очаге травмы |
|
Миноциклин |
Первые 2–3 недели |
Снижение активности GFAP в очаге травмы и повышение BDNF способствует репарации нервной ткани и снижению объёма астроглиального рубца |
|
Эритромицин, Азитромицин, Цефтриаксон |
Первые 7 дней |
Снижение активности ИЛ-10, ИЛ-1β, ФНО-α, участвующих в формировании астроглиального рубца, способствуют аксональной регенерациии |
Направления лечения спинномозговой травмы
Рилузол (бензотиазол), блокатор натриевых каналов, показавший в исследованиях способность снижения активности вторичного повреждения, а именно процесс эксайтотоксичности. Избыточное количество внутриклеточного натрия изменяет активность натрий-кальциевого насоса, обеспечивая еще больший приток кальция. Клеточная деполяризация активирует натриевые каналы, что приводит к притоку ионов хлора, и вода поступает в клетки вместе с натрием, вызывая отек. Повышенная концентрация натрия чрезмерно активирует обмен натрия и водорода, вызывая повышение внутриклеточного водорода. Возникающий внутриклеточный ацидоз увеличивает проницаемость мембран для кальция, усиливая ионный дисбаланс, вызванный травмой (уровень доказательности A) [3]. В течение первого часа также активируется калликреин-кининовая система, вызывая вазогенный отёк, нарушение гематоэнцефалического барьера и гибель нервной ткани, незначительно увеличивается титр калликреин-связанной пептидазы 7 (KLK7) и калликреин-связанной пептидазы 9 (KLK9), уровень других пептидаз не изменялся. В подострой фазе СМТ соотношение пептидаз резко меняется и преимущественно повышается титр калликреин-связанных пептидаз 1,5,6,8 (KLK1, KLK5, KLK6, KLK8) в то время, как уровень KLK7 и KLK9 увеличивался незначительно (уровень доказательности B) [4]. При этом брадикинин при взаимодействии с брадикининовым рецептором-2 (B2R) повышает пластичность спинномозговой ткани, но участвует в процессе эксайтотоксичности (уровень доказательности B) [5].
В нескольких исследованиях использовался пероральный приём Рилузола по 100 мг в течение 12 часов после травмы и по 50 мг 2 раза в сутки в течение 14 дней. После сравнения с группой пациентов, не получавших Рилузол, было отмечено, что у пациентов со СМТ (ASIA B), получавших препарат, произошло улучшение моторных функций по сравнению с контрольной группой [6]. К примеру, по результатам первой фазы мультицентрового исследования от 2014 года, было отобрано 36 пациентов с СМТ с различными уровнями повреждения (28 шейного отдела и 8 грудного отдела). Суточная доза Рилузола составляла 50 мг дважды в день. Пациенты оценивались в течение 14 дней, на протяжении времени приёма Рилузола. Предварительно 33 пациента подверглись ранней декомпрессии спинного мозга и стабилизации повреждённого участка позвоночного столба. В результатах исследования отмечается увеличение объёма движений и чувствительности, наиболее выраженное среди пациентов с травмой шейного сегмента (уровень доказательности B) [7].
Блокаторы кальциевых каналов (Нимодипин)
При выходе свободной крови в участок повреждения начинается распад эритроцитов, ведущий к освобождению ионов железа и кислорода, который в процессе окисления переходит в состояние свободных радикалов. Выделение перекиси водорода и оксида азота начинает процесс апоптоза поврежденной нервной ткани и процесс демиелинизации (уровень доказательности B) [8]. Острая аксональная дегенерация (ОАД) индуцирует другие эффекторы, такие как кальпаин цистеин протеазы, которые еще больше усиливают данный процесс.ОАД инициируется высоким притоком кальцияв аксоны.Это явление происходит в две фазы, более ранняя фаза наступает в течение 15 минут после травмы, а более поздняя фаза, называемая валлеровской дегенерацией, наступает в течение первых 2 суток. Одновременно с этим выброс эндогенных травма-ассоциированных клеточных белков (DAMP) в основном сконцентрирован вокруг поврежденных аксонов. Также DAMP нарушает целостность гематоэнцефалического барьера (рис. 3) [9; 10] (уровень доказательности A). Перегрузка митохондрий кальцием также препятствует дыханию митохондрий и приводит к истощению АТФ, отключая Na+/K+ АТФазы и увеличения внутриклеточного Na+. Также из-за уменьшения аденозинтрифосфата (АТФ) и непосредственного повреждения клеток возникает значительное повышение внеклеточного глутамата. Глутамат связывается с ионотропными (NMDA, AMPA и т.д.), а также метаботропными рецепторами, что приводит к прохождению кальция внутрь клеток (уровень доказательности A) [11].
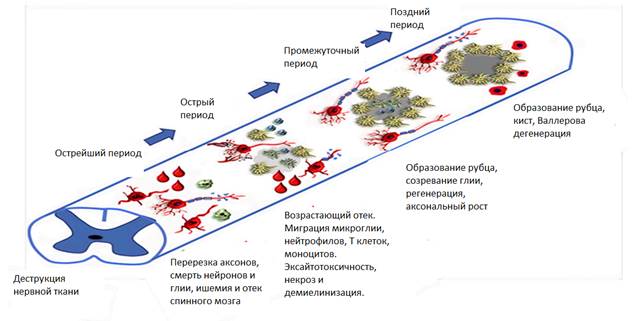
Рис. 3. Патофизиологические события в соответствии с фазами ПСМТ [9]
В 2021 году было проведено исследование с целью подтверждении эффективности применения блокаторов кальциевых каналов при СМТ. Данное утверждение было на основании того факта, что, по данным предыдущих исследований от 2020 года, показана эффективность применения данного препарата с целью снижения спастичности и воспалительной реакции в участке повреждения (уровень доказательности C) [12; 13]. Суть эксперимента состояла в следующем: лабораторным мышам на грудном уровне (Th8-11) была смоделирована СМТ по типу контузии тканей. После чего через 1 час после создания данной модели был введен Нимодипин в объёме 10 мг/кг в течение 6 недель. Оценка функционального объёма и рефлекторных ответов была проведена до и после формирования модели травмы. По данным исследования, было получено, что длительная терапия Нимодипином снижала объём функционального дефицита, улучшала функцию мочевого пузыря, уменьшала площадь поражённой ткани. По нашему мнению, данные препараты (блокаторы кальциевых и натриевых каналов) должны быть применены в первые 24–48 часов от момента травмы во избежание именно того каскада реакций, который описан выше, а именно: перегрузка митохондрии кальцием, увеличение внутриклеточного натрия, что приводит к формированию отёка и острой аксональной дегенерации.
Миноциклин
Недостаток кислорода и глюкозы, а также увеличение альбумина стимулирует накопление астроцитов в центре повреждения. Через 7–10 дней после СМТ астроциты размножаются и собираются вдоль края обширно поврежденной ткани. Затем эти астроциты мигрируют и организуются в виде рубцовой границы, окаймляющей место повреждения (фиброзные рубцы). Это покрытие рубца астроцитами завершается через 2–3 недели. Глиальный фибриллярный кислый белок (GFAP), разновидность белка промежуточных нитей III, экспрессируется в реактивных астроцитах, как и CSPG, и также повышаются уровни виментина, нестина, S100β, что приводит к гипертрофии клеток. Астроглиальный рубец состоит из микроглии, астроцитов и внеклеточного матрикса, содержащего хондроэтинсульфат протеогликаны (уровень доказательности B) [14]. От 2 недель до 6 месяцев после травмы астроцитарный рубец считается зрелым. Из-за наличия глиального рубца и других ингибирующих факторов, таких как CSPGs и белок, связанный с миелином, регенерация аксонов ограничена. Через 6 месяцев после травмы рубец непрерывно укрепляется по мере постепенного образования кист и полостей. Рубец образует физический и молекулярный барьер, ограничивающий распространение воспаления; однако это также препятствует регенерации и росту аксонов [15]. Прогрессирующий астроглиоз начинается через 1 день после СМТ и продолжается до 16-й недели. А количество макрофагов достигает максимума через 1–4 недели после СМТ, с постепенным снижением к 12–16 недели после СМТ, в то время как астроглиоз постепенно отгораживает область повреждения, что совпадает со снижением инвазии макрофагов. Это свидетельствуют о том, что стойкий астроглиоз вокруг области повреждения связан с постепенным снижением уровня провоспалительных и увеличением уровня противовоспалительных цитокинов [16].
Миноциклин - тетрациклиновый антибиотик с активным противовоспалительным действием. Данный препарат прошел множество исследований для подтверждения эффективности использования при спинномозговой травме. Антибиотик прошел 4 стадии исследований эффективности (опубликовано только 3 стадии), по данным 3 этапа, Миноциклин имел хороший эффект при купировании болевого синдрома (уровень доказательности A) [17]. Также Миноциклин снижает активность GFAP (глиальный фибриллярный кислый белок), участвующего в формировании рубца, и повышает уровень нейротрофического фактора мозга (BDNF), участвующего в репарации нервной ткани (уровень доказательности A) [18]. Перициты, клетки, покрывающие сосуды, тоже участвуют в формировании астроглиального рубца, происходит при активации А-перицитов, глиальный компонент которого состоит из самопродуцирующихся астроцитов и нейрональных стволовых клеток, миграции лейкоцитов и тоже инициируются в участок повреждения (уровень доказательности B) [19]. Миграция перицитов в участок повреждения регулируется за счёт выделения М2 макрофагами PDGF (тромбоцитарного фактора роста). Через 2 недели количество перицитов в 2 раза превышает количество астроцитов. Перициты секретируют специфические маркеры, которые стимулируют фибробласты (уровень доказательности A) [20].
По данным плацебо контролируемого исследования от 2012 года, было отобрано 52 пациента с острой спинномозговой травмой, 27 из которых получали миноциклин, а остальные плацебо. Уровни миноциклина учитывались как в сыворотке крови, так и в цереброспинальной жидкости. Дозировка миноциклина составляла 800 мг 2 раза в сутки и постепенно снижалась на 100 мг при каждом 12-часовом введении в течение 7 дней от момента травмы. В целом у пациентов, получавших миноциклин, восстановление двигательной активности было на шесть пунктов выше по шкале ASIA, чем у пациентов, получавших плацебо (95%-ный доверительный интервал от 3 до 14; Р = 0,20, n = 44). При травме грудного отдела спинного мозга не наблюдалось различий в восстановлении (n = 16). У пациентов с травмой шейного отдела позвоночника наблюдалась разница в 14 двигательных точках, которая приближалась к значимой (95%-ный доверительный интервал 0-28; Р = 0,05, n = 25). Пациенты с неполной двигательной травмой шейного отдела, возможно, испытали большую разницу (результаты не являются статистически значимыми, n = 9). Функциональные результаты демонстрировали различия, которые не имели статистической значимости, но которые могут свидетельствовать об улучшении у пациентов, получавших исследуемый препарат (уровень доказательности A) [21]. При этом не стоит опускать некоторые нейропротективные способности других антибиотиков, т.к. азитромицин и эритромицин снижают общее число провоспалительных цитокинов путем увеличения прорепаративных цитокинов (ИЛ-10 и т. д.), цефтриаксон также снижает число провоспалительных цитокинов (ИЛ-1β, ФНО-α) и способствует аксональной регенерации (уровень доказательности B) [22].
В подострой фазе СМТ соотношение пептидаз резко меняется и преимущественно повышается титр калликреин-связанных пептидаз 1,5,6,8 (KLK1, KLK5, KLK6, KLK8), в то время как уровень KLK7 и KLK9 увеличивался незначительно [4]. При этом брадикинин при взаимодействии с брадикининовым рецептором-2 (B2R) повышает пластичность спинномозговой ткани, но участвует в процессе эксайтотоксичности (уровень доказательности B) [5]. Параллельно с этим ввиду венозного застоя начинается отёк нервной ткани, который ввиду спазма сосудов спинного мозга приводит к ишемии ткани. За счёт нарушения гематоэнцефалического барьера в участок повреждения выходит большой объём нейтрофилов, макрофагов, приводящий к высвобождению провоспалительных цитокинов (ФНО-α, ИЛ-1, ИЛ-1β, ИЛ-6 и т.д.) и репаративных факторов, таких как эндотелиальный фактор роста сосудов (VEGF), фактор роста фибробластов (FGF), морфогенетические белки (BMP). Непосредственно после травмы уровень VEGF резко повышается, причем его уровень нормализуется к 14-му дню после травмы [23]. Фактор роста фибробластов (FGF) идёт по двум путям дифференцировки и имеет две активные формы aFGF и bFGF, которые выполняют следующие задачи: aFGF стимулирует выработку прорепаративных макрофагов, снижает активность хондроитинсульфат протеогликана (CSPG), а bFGF участвует в апоптозе поврежденной ткани, стимулирует формирование олигодендроцитов и астроцитов [24].
Гиперинтеролейкин-6
Гиперинтеролейкин-6 (hIL-6) - это дизайнерский цитокин, представляющий собой активную часть обычного ИЛ-6 и растворимый рецептор интеролейкина-6 (sIL-6R), активирующий гликопротеид-130 (gp130), усиливающий внутриклеточную передачу сигнала, который стимулирует более продолжительную работу цитокинов семейства IL-6, и повышающий аксональную регенерацию. Исследования от 2016 года показали, что при повреждении зрительного нерва у грызунов активность данной группы цитокинов сохранялась в течение 21 дня в обычных условиях, но при использовании hIL-6 увеличивались число и продолжительность жизни прорепаративных цитокинов и сигнальных путей, отвечающих за их активацию, до 6 недель после повреждения. Исходя из данного эксперимента, можно предположить, что применение дизайнерского белка при повреждении нервной ткани имеет определённые перспективы (уровень доказательности C) [25]. В январе 2021 года Leibinger et al. провели исследования по воздействию hIL-6 на восстановительные функции при травме спинного мозга. Эксперимент представлял собой введение hIL-6 субкартикально в головной мозг, через 30 минут после повреждения спинного мозга (разможжения спинного мозга). Путем вестерн-блотинга было установлено, что hIL-6 влияет на сигнальные пути, которые в свою очередь запускали процесс восстановления кортикоспинального тракта [26].
Клеточная терапия при СМТ
После инвазии нейтрофильных клеток микроглия/макрофаги заселяют поврежденный спинной мозг в течение 2–3 дней после СМТ, за счет активации глипротеина CD 68+, играющего важную роль в фагоцитарной активности макрофагов. Через 2 недели после травмы у взрослого человека в центре повреждений образовывалась типичная структура рубца со значительным накоплением CD68+ клеток (активированных макрофагов/микроглии), окруженных фибробластами, реактивными астроцитами и компонентами базальной пластинки, коллагеном I, фибронектином, CSPG. Напротив, в месте повреждения через 2 недели после травмы наблюдалось минимальное накопление CD68+ клеток, фибронектина и коллагена I, CSPG, ламинина, но со скромным накоплением GFAP (глиофибриллярного кислого белка) клеток в центре поражения. Популяция макрофагов пополняется из проникающих в кровь моноцитов или из макрофагов ЦНС, которые находятся в периваскулярных областях внутри мозговых оболочек и субарахноидальном пространстве. Популяция микроглии/макрофагов достигает своего пика через 7–10 дней после травмы при СМТ, за которым следует снижение в подострой и хронической фазах (уровень доказательности B) [27]. В то время как макрофаги и микроглия имеют много общих функций и иммунологические маркеры, они имеют разное происхождение. Микроглия - это резидентные иммунные клетки ЦНС, которые происходят из желточного мешка в эмбриональный период. Макрофаги происходят из моноцитов крови, которые происходят из миелоидного потомства в костном мозге. Макрофаги населяют эпицентр повреждения, в то время как резидентные клетки микроглии в основном расположены в зоне вокруг поражения. После активации макрофаги и микроглия морфологически и иммуногистологически неразличимы. Макрофаги и микроглия играют благотворную роль в регенерации ЦНС. Они способствуют процессу восстановления за счет экспрессии факторов, способствующих росту, таких как фактор роста нервов (NGF), нейротрофин-3 (NT3) и тромбоспондин. Макрофаги и микроглия важны для процесса заживления ран после СМТ из-за их способности к фагоцитозу и удалению поврежденных клеток и остатков миелина после СМТ. На основе сигналов микросреды макрофаги/микроглия могут быть поляризованы либо на провоспалительные (M1-подобные), либо на противовоспалительные прорегенеративные (М2-подобный) фенотипы и, соответственно, способствуют процессам повреждения или восстановления после СМТ. Некоторые данные показывают, что провоспалительный М1-подобный микроглии/макрофагам может быть индуцирован воздействием специфического цитокина Th1, интерферона (IFN)-γ (уровень доказательности B) [28]. Более того, микроокружение, по-видимому, приводит к поляризации M1 активированных макрофагов. Исследования SCI показали, что повышенный уровень провоспалительного цитокина, TNF-α и внутриклеточное накопление железа приводят к М1-подобному провоспалительному фенотипу в макрофагах после травмы (уровень доказательности B) [29]. Второй этап воспалительного процесса начинается через 3 суток после травмы и представляет собой миграцию макрофагов, В- и Т-лимфоцитов в место повреждения. Т-лимфоциты активируются в ответ на презентацию антигена макрофагами, микроглией и другими антигенпрезентирующими клетками CD4+ хелперные Т-клетки продуцируют цитокины, которые стимулируют выработку антител к В-клеткам и активируют фагоциты. Т- и В-лимфоциты играют ключевую роль в адаптивном иммунном ответе после СМТ. Лимфоциты проникают в поврежденный спинной мозг в течение первой недели травмы и остаются в участке повреждения. В отличие от врожденного иммунного ответа, который может быть активирован непосредственно чужеродными антигенами, адаптивный иммунный ответ требует сложного сигнального процесса в Т-клетках, вызываемого антигенпрезентирующими клетками. Подобно другим иммунным клеткам, Т- и В-лимфоциты принимают различные фенотипы и способствуют как повреждению, так и процессам восстановления в ответ на сигналы микросреды. СМТ вызывает специфический для ЦНС аутоиммунный ответ в Т- и В-клетки, которые остаются активными хронически. Реактивные Т-клетки могут оказывать прямое токсическое воздействие на нейроны и глиальные клетки (уровень доказательности A) [30]. Также стоит отметить, что происходит нарушение работы серотонинэргической системы, отвечающей за координированную локомоторную функцию совместно с глутаматэргическими путями. Серотонин (5-HT) участвует в локомоции посредством взаимодействия с центральным генератором паттернов (GCP) – группы нейронов, в основном расположенной в грудопоясничном отделе спинного мозга, регулируя ритм движений и последовательные сокращения мышц, регуляцию мочевого пузыря, регенерацию аксонов (уровень доказательности A) [31; 32]. После повреждения рострально расположенные серотонинэргические нейроны начинают увеличиваться в числе и активности через 8 дней после повреждения и их число снижается в каудальной части от очага поражения (уровень доказательности B) [33].
В лечении СМТ долгое время проводились исследования по использованию клеточных групп с целью функционального и анатомического восстановления спинного мозга. При этом пути введения данных клеточных групп были абсолютно различными (внутривенное, интратекальное, интрапаренхиматозное, субарахноидальное и т.д.). Время введения на данный момент не определено, но при этом можно утверждать, что введение в первые 3 недели после СМТ даёт достаточно положительные результаты, но при этом есть методики введения данных групп в более поздние периоды травмы (уровень доказательности B) [34]. В отношении дозирования клеточных групп вопрос остаётся открытым. Клеточные процессы, происходящие в острый период спинномозговой травмы, представлены на рис. 4 [11].
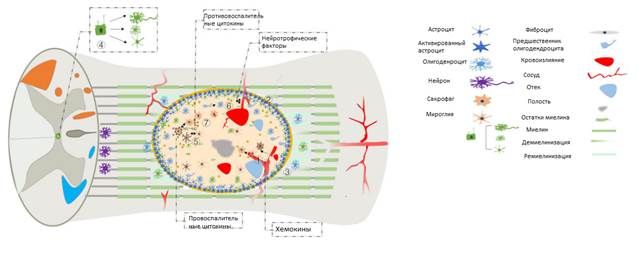
Рис. 4. Клеточный дисбаланс при спинномозговой травме [11]
При использовании адипозных стволовых клеток (AdSC), введенных внутривенно, основной упор делается на то, что они склонны к продукции гемоксигеназы-1 (ГО-1), имеющей антиоксидантные и противовоспалительные свойства путем блокирования сигнальных путей апоптоза клеток MLK3/MKK7/JNK3 [35]. Исследования были проведены как на людях, так и на животных. По данным исследований, прошедших 1 фазу клинических испытаний, AdSC были имплантированы интратекально пациентам в возрастной группе от 19 до 70 лет, с различными типами СМТ. Вводимые дозы составляли интратекально 9*107 клеток/ 3 мл и 5*107 клеток/ 2 мл, интрапаренхиматозно 2*107/ 1 мл, внутривенно 2*108/ 20 мл. При проведении МРТ были отмечены структурные изменения, один пациент показал моторное и сенсорное восстановление. При всем этом данные исследований показали статистически не значимые результаты (уровень доказательности B) [36]. Hur et al.провели клиническое исследование с участием 14 пациентов с СМТ.Изолированные аутологичные AdSC, полученные в результате липосакции подкожной жировой ткани, вводили пациенту интратекально через люмбальную пункцию.МРТ, гематологические исследования, электрофизиологическое обследование и оценка двигательной чувствительности были проведены до и через 8 месяцев после трансплантации.Результаты показали, что аутологичные AdSC не имели значительных побочных реакций при лечении СМТ, а у некоторых пациентов наблюдалось небольшое улучшение неврологической функции (уровень доказательности B) [37].
Стволовые клетки красного костного мозга (BMMSC) имеют большее число исследований. Основная возрастная группа пациентов данных исследований - это пациенты от 18 до 55 лет, имеющие СМТ различных уровней. BMMSC были аутологичные, основные пути введения интравенозный и интратекальный, одно исследование использовало введение в область повреждения. Контроль проводился в основном от 48 часов до 1 года после введения клеточных групп. По результатам данных исследований, основным показателем восстановления были восстановление чувствительности, восстановление моторных функций. Из осложнений отмечались боль в спине, головная боль (уровень доказательности B) [38], [39]. Также отмечается, что данные клеточные группы имеют возможность к блокированию TLR-4 сигнального пути, вследствие чего снижается активность ИЛ-1β и ФНО-α, снижая провоспалительную активность в участке травмы (уровень доказательности B) [40].
Обволакивающие клетки обонятельного нерва (OEC), группа клеток, имеющих такие же репаративные функции, как у шванновских клеток и астроцитов. По данным исследования от августа 2021 года, OEC стимулирует выработку нейтрофических факторов (GAP-43) и выживание поврежденной ткани, уменьшение объёма астроглиального рубца за счёт регуляции и снижения экспрессии CSPG (уровень доказательности B) [41]. В исследованиях от января 2021 г. при внутривенном введении OEC, было получено уменьшение отёка нервной ткани, выработка антагонистов рецептора ИЛ-1(ИЛ-1Ra), снижение провоспалительных хемокинов, в том числе снижение ИЛ-1α, ИЛ-1β. Было также зарегистрировано повышение уровня липополисахаридазы (ЛПС), которая в свою очередь является источником ИЛ-1Ra, снижающего активность микроглии (уровень доказательности B) [42]. Примером клинического применения может являться следующий клинический случай: мужчина 38 лет после перенесенной СМТ с повреждением спинного мозга на уровне Th 9 по ASIA A, после 21 месяца после травмы отмечал ухудшение моторики и функциональный дефицит. В качестве донора клеток была взята аутологическая обонятельная луковица для культивирования клеток (после аносмия не отмечалась). Далее при оперативном лечении была произведена диссекция рубца, в участок удаленного рубца интегрированы OEC. По истечении 8 месяцев неврологический дефицит регрессировал с ASIA A до ASIA C. Наблюдалось улучшение стабильности туловища, частичное восстановление произвольных движений нижних конечностей и увеличение мышечной массы в левом бедре, а также частичное восстановление поверхностных и глубоких ощущений.Также были некоторые признаки улучшения висцеральной чувствительности и улучшенной ауторегуляции сосудов в левой нижней конечности (уровень доказательности C) [43].
Шванновские клетки (SC) исследуются как тип лечения СМТ более 40 лет. SC показали высокую пластичность при имплантации в поврежденный спинной мозг. SC, имплантированные в культуре клеток, сохраняют функциональную способность к восстановлению нервов и (повторной) миелинизации. Данная культура клеток, по данным различных лет, безопасна при трансплантации. Основной областью изъятия SC являются периферические нервы, ганглии, корешки спинного мозга (уровень доказательности B) [44]. При применении введённых интрапаренхиматозно через 1 неделю SC в терапии СМТ в экспериментах было отмечено уменьшение объёма кист, уменьшение очага повреждения, регресс функционального дефицита (уровень доказательности B) [45].
Физиологические методы лечения
Гипотермия - это один из способов физиологического лечения спинномозговой травмы, способствующий замедлению процессов вторичного повреждения СМТ, а именно снижению активности окислительных процессов в очаге повреждения. По данным исследования 2022 года, гипотермия давала наилучший результат, когда являлась дополнением к основному лечению, имела меньший процент осложнений при системном использовании. При всём этом мы должны помнить, что применение гипотермии сопряжено с рисками коагулопатии, нарушения сердечного ритма, тромбоза глубоких вен конечностей, инфицирования, острого респираторного дистресс-синдрома. Число исследований при применении гипотермии в терапии СМТ достаточно велико, но при этом имеет противоречивые данные, в силу чего мы считаем применение данного метода лечения опциональным (уровень доказательности С) [46].
Электростимуляция - это одна из методик лечения последствий спинномозговой травмы. Различают нервно-мышечную электростимуляцию (НМЭС) и функциональную электростимуляцию (ФЭС). Эти виды электростимуляции используются с целью активации мышечных сокращений. Достигается путём установки инвазивных или неинвазивных (поверхностных) электродов на парализованные мышцы. Основная частота, используемая у пациентов с СМТ, 20–50 Гц. Использование электростимуляции у пациентов с СМТ даёт обнадёживающие результаты в восстановлении определённого объёма движений при комбинации с физической реабилитацией, но имеет низкий показатель при лечении болевого синдрома (уровень доказательности С) [47; 48]. Также стоит отметить применение транскраниальной стимуляции постоянным током (tDSC) для лечения хронических болей при СМТ. Наиболее широко предполагаемый механизм заключается в том, что tDCS модулирует спонтанную активность нейронов коры путем поляризации клеточной мембраны, которая может длиться до 90 минут. tDCS не запускает потенциалы действия, но влияет на синхронизацию спайков отдельных нейронов, получающих надпороговые сигналы. Эффекты tDCS на возбудимость коры зависят от полярности. Анод деполяризует мембрану нейрона и повышает возбудимость коры, тогда как катод гиперполяризует мембрану нейрона и снижает возбудимость коры. Но однозначного мнения по механизму работы данной методики не установлено. Противопоказаниями для применения данной методики является наличие рядом металлических имплантов и других установленных стимуляторов. Возможными осложнениями данного метода лечения являются сонливость, ожоги, судорожный синдром, заболевания кожи и т.д. Исходя из всех рассмотренных исследований, имеется определённый положительный результат, но отсутствие единого протокола применения и рандомизированных клинических исследований ограничивает его применение (уровень доказательности С) [49].
По результатам данного анализа можно утверждать, что среди всех препаратов, рассмотренных в данном обзоре, наиболее доказанную эффективность, по последним исследованиям, имеют Нимодипин и Миноциклин. По результатам всех приведенных исследований они имеют высокий уровень доказательности. Остальные препараты (Цефтриаксон, Рилузол, Эритромицин, Азитромицин) нуждаются в более подробном изучении влияния на очаг СМТ. Среди клеточных культур на данный момент имеются только предварительные исследования их применения, но при этом требующие дальнейшего исследования для введения в практическую деятельность. Физиологические методы лечения имеют низкий уровень доказательности, поэтому необходимо проведение исследований для подтверждения их эффективности.
С учётом проведенного анализа всех данных методик можно заключить, что применение некоторых препаратов, клеточных культур должно перейти в активную практическую деятельность с учетом особенностей пациента и полученных данных. Например, применение метилпреднизолона в первые 8 часов после травмы, так как данный препарат имеет более исследованную активность в отношении СМТ, снижает провоспалительную активность и объём отека, который непосредственно приведет к ишемии ткани. Хотя в его отношении МП достаточно много споров, так как в рекомендациях по его применению есть разногласия. В «Американских рекомендациях» от 2002 года МП рекомендуется как оптимальный, противовоспалительный препарат, опционально применяемый в течение 24–48 часов. Уже в 2013 году та же Американская ассоциация нейрохирургов исключила МП из применения из-за недостаточной доказательной базы и отсутствия одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (уровень доказательности B) [50]. В силу данных утверждений мы считаем, что МП стоит рассмотреть как один из вариантов применения стероидных препаратов в течение первых 8 часов после травмы, а не для рутинного использования (уровень доказательности C). В дальнейшем более актуальным становится применение клеточных культур (стволовых клеток, шванновских клеток, обволакивающих клеток обонятельного нерва), на основании клинических исследований, начала использования данных культур в практике (стволовые клетки) за рубежом, противовоспалительную активность, антиапоптозную активность, усиление ангиогенеза, наличие доказательной базы делает данную методику лечения возможной к рассмотрению в качестве нового этапа лечения. При этом не стоит забывать о побочных эффектах данной терапии, таких как формирование онкологических процессов, иммунные реакции организма, головная боль, изменение температурных показателей тела, инфекция. В отношении антибиотикотерапии: мы можем оперировать более широким спектром препаратов, но при этом рекомендуем использовать антибиотики с доказанным нейропротективным действием. Физиологические методы лечения показали лишь частичную и недостаточно убедительную эффективность, но несмотря на это, некоторые из них применяются в практическом лечении.
Библиографическая ссылка
Карпов Д.А., Сафин Ш.М., Трифонов Я.В. НЕЙРОПРОТЕКТИВНАЯ ТЕРАПИЯ ПРИ СПИННОМОЗГОВОЙ ТРАВМЕ // Современные проблемы науки и образования. 2022. № 4. ;URL: https://science-education.ru/ru/article/view?id=31794 (дата обращения: 18.02.2026).
DOI: https://doi.org/10.17513/spno.31794



