Инфекции области хирургического вмешательства (ИОХВ) и устойчивость к противомикробным препаратам представляют собой две неразделимые глобальные угрозы. Были выпущены детальные рекомендации по снижению риска послеоперационных инфекций,включая хирургическую антибиотикопрофилактику.Несмотря на это, по оценкам ВОЗ, глобальная заболеваемость ИОХВ составляет от 3% до 50% в зависимости от типа операции.В Европе ИОХВ составляют 17% всех инфекций, связанных с оказанием медицинской помощи. В странах с низким и средним уровнем дохода на ИОХВ приходится около 60% от общего числа осложнений. Следовательно, до 60% хирургических пациентов получают антибиотики в послеоперационном периоде, находясь в больнице, и до 50% выписываются с курсом антибиотиков.Многие из этих подходов могут быть неподходящими,тем самым подпитывая и не решая проблему [1, 2].
По мнению ряда авторов, эндогенным источником инфекции и причиной ИОХВ является кишечник, особенно в абдоминальной хирургии. Некоторые ученые считают, что кратковременная локальная или генерализованная кишечная непроходимость возникает при любой операции на органах брюшной полости [3].И действительно, кишечный барьер, включающий люминальную микробиоту, слизистый слой и физический барьер, состоящий из эпителиальных клеток и иммунных клеток, играет особую роль в здоровье и заболевании.В последнем случае постепенно возникает супераддитивная инфекция, и Escherichia coliиBacteroides являются наиболее распространенными организмами.Брюшинная полость остро воспаляется с образованием воспалительного экссудата, который распространяется по всей брюшине, что приводит к дилатации кишечника и паралитической непроходимости кишечника.Перитонит вызывает кишечную непроходимость сначала из-за воспаления, затем – из-за бактериальных токсинов, и, наконец, образующиеся фибринозные спайки могут задерживать восстановление функции кишечника.Бактериальный липополисахарид вызывает кишечную непроходимость, инициируя воспалительную реакцию в слоях гладких мышц кишечника и последующее снижение сократительной способности гладких мышц. Одним из защитных механизмов в данном случае являются ферментные системы, ингибирующие липополисахариды. Фермент кишечной щеточной каемки – кишечная щелочная фосфатаза (КЩФ) – ингибирует медиаторы воспаления и является важным положительным регулятором барьерной функции кишечника и микробного гомеостаза [4–7].
В последние годы вновь актуализировались сведения об успешном применении оксигенированной воды (ОВ) в медицине с целью уменьшения негативного действия гипоксии. Приводятся данные о современном понимании процессов обеспечения гомеостаза кислорода в клетках, о ключевом компоненте, ответственном за регуляцию молекулярного ответа на гипоксию, – семействе транскрипционных факторов HIFs (Hypoxia-Inducible Factors) – факторов, индуцируемых гипоксией. Приводятся положительные результаты применения ОВ в спортивной медицине, лечении сахарного диабета, онкологических заболеваний, а также хирургических инфекций [8, 9].
Увеличение числа сообщений об устойчивости к противомикробным препаратам и ограниченное количество открытий и разработок новых антибиотиков стимулировали инновации в других областях исследований и привели к оживлению исследований, посвященных бактериофагам. Фаговая терапия в основном использует облигатные литические фаги для уничтожения соответствующих бактерий-хозяев, оставляя клетки человека нетронутыми и снижая более широкое воздействие на комменсальные бактерии, которое часто возникает в результате использования антибиотиков.Фармакокинетические исследования показали, что после однократного перорального приема 20–30 мл фагов их определяли в крови через 1 ч и в моче через 2 ч. Высокий уровень фаговых частиц сохранялся в сроки 3–6 суток, что связано с репликацией бактериофагов на гомологичных фагочувствительных бактериях. Действительно, бактериофаги имеют несколько важных преимуществ, которые способствуют их лечебно-профилактическому потенциалу: высокая специфичность, быстрая инактивация после эрадикации возбудителя, способность к репликации, стимуляция иммунитета, возможность проникновения через матрикс биопленочных инфекций, инертность в отношении человеческих тканей, возможность местного и перорального применения и др. Фаговая терапия, быстро развиваясь, способствовала получению положительных терапевтических результатов и проведению многочисленных клинических испытаний [10, 11, 12].Тем не менее, одна из самых больших проблем, с которыми сталкивается эта альтернатива антибиотикам, связана с правилами и политикой, касающимися клинического использования и внедрения.
Цель исследования: оценить результаты применения поливалентных бактериофагов (ПВБФ) и ОВ для профилактики ИОХВ в неотложной абдоминальной хирургии.
Материал и методы исследования
Поведено многоцентровое ретроспективное рандомизированное когортное контролируемое исследование (уровень доказательности IIb). Объектом исследования являлись пациенты после экстренных открытых интраабдоминальных операций, выполненных в клиниках г. Астрахани, г. Ставрополя и Республики Калмыкия. Сроки исследования – 2019-2022 гг. Всего пролечены 88 больных, которые были распределены на две равные сопоставимые группы – основную и сравнения. Средний возраст больных в группах колебался от 19 до 82 лет. Мужчин было 53, женщин – 35.
В основной группе лечение дополнялось применением ПВБФ и ОВ. В качестве ПВБФ применялся Секстафаг® – фильтрат фаголизатов бактерий Staphylococcus, Streptococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, энтеропатогенных Escherichia coli, Klebsiella pneumoniae (ЛС-001049; НПО «МИКРОГЕН», Россия). Всем больным основной группы ПВБФ вводили перорально или через кишечный зонд в дозе 20 мл 3 раза в сутки. Дополнительно, после операций Класса 3 и Класса 4 (по классификации Altemeir's) перед наложением швов на лапаротомную рану последняя орошалась раствором ПВБФ. ОВ представляла собой специально подготовленную очищенную природную абактериальную воду, обогащенную кислородом в количестве 25–30 мг/дм3 (250000 ppm) с минерализацией 400–500 мг/дм3. (Сертификат соответствия – № РОС-RU-АЯ 48. В 07908; паспорт качества – № 01/05 гк., гос. регистрации № 30.АЦ. 02.006.У000003.03.08). ОВ вводилась перорально или через зонд 3 раза в сутки по 100 мл с последующим пережатием зонда на 60 мин. ПВБФ и ОВ вводились в течение 5 суток. Дозозависимая эффективность в данном исследовании не изучалась. В группе сравнения лечение проводилось традиционно, без использования методов иммунизации. Антибиотикопрофилактика и антибиотикотерапия в обеих группах проводились согласно действующим СанПиН и утвержденным Клиническим рекомендациям.
В качестве стратификационного критерия включения в группы исследования использован калькулятор хирургического риска ACS NSQIP (2007–2022, American College of Surgeons National Surgical Quality Improvement Program®). Данная система, помимо вида хирургического вмешательства, включает особенности преморбидного фона, класс ASA, антропометрические данные и др. Критерием включения в группы исследования мы приняли риск ИОХВ, равный 30±3%. Тяжесть состояния больных оценивалась по Индексу брюшной полости (ИБП по В.А. Савельеву) и шкале APACHE II (табл. 1).
Таблица 1
Стратификация пациентов по виду нозологии и тяжести состояния (абс; М±m)
|
Нозология/ИБП; APACHE II |
Основная группа (n=44) |
Группа сравнения (n=44) |
|
Острая обтурационная толстокишечная непроходимость (опухолевая) |
12 |
11 |
|
Ущемленная вентральная грыжа |
9 |
10 |
|
Острая спаечная кишечная непроходимость |
10 |
10 |
|
Острый аппендицит |
7 |
8 |
|
Перфоративная язва желудка и 12-перстной кишки |
6 |
5 |
|
ИБП |
15,6±1,1 |
15,8±0,9 |
|
APACHE II |
14,3±0,8 |
14,7±0,7 |
Критериями исключения являлись острое нарушение мезентериального кровообращения, а также случаи, осложненные в момент поступления тяжелым абдоминальным сепсисом и септическим шоком. Послеоперационные осложнения отслеживались в сроки от 0 до 30 дней.
Выделение и идентификацию возбудителей проводили с использованием анализатора VITEK 2 Compact 30 4700733 (Франция). Определяли колониеобразующие единицы (КОЕ) в 1 мл тонкокишечного химуса.
Для изучения степени выраженности кишечной недостаточности динамически вычисляли энтеральный морфофункциональный коэффициент (ЭМФК), который определяли на 1-е, 3-и и 5-е сутки лечения [13].
При помощи метода иммуноферментного анализа аппаратом «Cobas e411» (Швейцария) определяли общую щелочную фосфатазу (Ед/л), ее изоформу – кишечную щелочную фосфатазу (Ед/л), а также их соотношение ЩФ/КЩФ (%) в сыворотке крови и кишечном содержимом. Исследования проводили на 0–1-е сутки и 5-е сутки.
Для характеристики и стратификации возникших послеоперационных ИОХВ применяли Саутгемптонскую шкалу оценки ран (Southampton Wound Assessment Scale – SWAS) [14]. Согласно данной шкале, все осложнения разделены на 5 классов (от 0 до V).
Статистические взаимосвязи между показателями оценивались с применением корреляционного модуля «Basic Statistics and Tables STATISTICA 10.0». Использовался метод стратификационной рандомизации. С целью определения достоверности р различий между группами применялся t-критерий Стьюдента. Статистически значимыми считались различия при р≤0,05.
Результаты исследования и их обсуждение. При изучении транслюминального энтерального патобиома оказалось, что в начале лечения микробный пейзаж в основной группе и группе сравнения статистически не отличался. Патобиом был представлен разнообразной Грам+ и Грам– микрофлорой. Всего выделены 11 основных патогенов. Отмечалось превышение пороговых значений уровня контаминации за счет энтеропатогенных штаммов Escherichia coli – 8,7±0,5×108 КОЕ в 1 мл, а также Klebsiella pneumoniae 9,3±0,6×109 КОЕ в 1 мл. Кроме того, обратило на себя внимание повышенное представительство нехарактерных для энтерального микробиома патогенов – Staphylococcus aureus 6,6±0,4×106 КОЕ в 1 мл и Staphylococcus saprophyticus 7,4±0,3×107 КОЕ в 1 мл.
На 5-е сутки лечения транслюминальный энтеральный патобиом в группах исследования отличался. Отмечена тенденция к нормализации микробного пейзажа в основной группе, что подтверждалось снижением уровня контаминации вышеуказанными патогенами на 1–2 порядка (р≤0,05). Микробиом в основном был представлен привычными для тонкого кишечника микроорганизмами. Обратило на себя внимание значительное снижение представительства патогенов рода Clostridium, которое в основной группе уменьшилось с 8,6±0,4×108 КОЕ в 1 мл до 4,8×104 КОЕ в 1 мл (р≤0,05). В группе сравнения на 5-е сутки уровни энтеральной контаминации оставались высокими (рисунок).
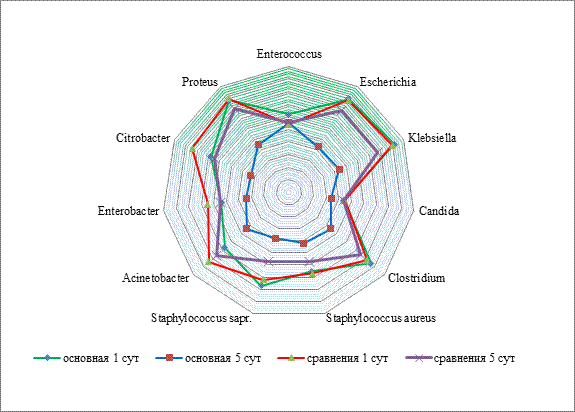
Изменение транслюминального энтерального патобиома в группах исследования (КОЕ×101-10 КОЕ в 1 мл)
При изучении маркеров энтеральной недостаточности в начале лечения оказалось, что значения ЭМФК в обеих группах в среднем соответствовали кишечной недостаточности II (субкомпенсированной) стадии и статистически не отличались. Кроме этого, отмечался дефицит кишечной изоформы щелочной фосфатазы, т.е. в соотношении ЩФ/КЩФ имелся дисбаланс с преобладанием ЩФ, что свидетельствовало о выраженном воспалении.
На 3-е сутки лечения в основной группе показатель ЭМФК, полученный в результате ультрасонографического исследования, был достоверно ниже (р≤0,05). В группе сравнения достоверного снижения ЭМФК удалось достичь только к 5-м суткам лечения. Соотношение ЩФ/КЩФ достоверно приходило к нормальным значениям к 5-м суткам в основной группе (р≤0,05). В то же время восстановления уровня КЩФ в группе сравнения не отмечено (табл. 2).
Таблица 2
Изменения биохимических и инструментальных показателей в группах исследования (M±m; абс.)
|
Группы исследования |
Объект исследования |
ЩФ/КЩФ (%) |
ЭМФК (баллы) |
|||
|
1-е сутки |
5-е сутки |
1-е сутки |
3-и сутки |
5-е сутки |
||
|
Основная (n=44) |
Сыворотка |
0,64±0,28 |
0,41±0,15* |
18,6±0,8 |
6,8±0,4* |
4,6±0,2 |
|
Химус |
6,03±0,16 |
3,06±0,11* |
||||
|
Сравнения (n=44) |
Сыворотка |
0,68±0,18 |
0,58±0,14 |
19,1±0,24 |
14,2±0,8 |
8,8±0,7* |
|
Химус |
6,11±0,24 |
5,21±0,18 |
||||
* – значения при р≤0,05
При анализе послеоперационных осложнений в виде ИОХВ оказалось, что глубокая или тяжелая раневая инфекция, сопровождающаяся разрушением тканей (класс V), в основной группе была представлена в 1 случае – внутрибрюшной абсцесс. В то же время в группе сравнения данный вид осложнений отмечен в 4 случаях: 2 – нагноение лапаротомной раны с полной эвентрацией, 1 – межпетельный внутрибрюшной абсцесс и 1 – несостоятельность швов кишечного анастомоза. Всего в основной группе отмечено 6 (13,63%) ИОХВ, в группе сравнения – 14 (31,81%) случаев осложнения (табл. 3).
Таблица 3
Послеоперационные осложнения в группах исследования (Southampton wound assessment scale) (абс; %)
|
Класс осложнения |
Подкласс |
Основная группа |
Группа сравнения |
|
I |
IA |
– |
– |
|
IB |
– |
– |
|
|
IC |
1 |
1 |
|
|
II |
IIA |
– |
– |
|
IIB |
– |
– |
|
|
IIC |
1 |
– |
|
|
IID |
– |
– |
|
|
III |
IIIA |
1 |
– |
|
IIIB |
– |
1 |
|
|
IIIC |
– |
1 |
|
|
IIID |
– |
2 |
|
|
IV |
IVA |
1 |
2 |
|
IVB |
1 |
3 |
|
|
V |
1 |
4 |
|
|
Всего |
6 (13,63%) |
14 (31,81%) |
|
При микробиологическом исследовании возбудителей оказалось, что во всех случаях ИОХВ V класса выявлена смешанная инфекция. Высевались микробные ассоциации Escherichia coli+Acinetobacter – 2 случая, Staphylococcus aureus+Citobacter – 2 случая, Staphylococcus epidermidis+Enterobacter cloacae – 1 случай.
В среднем сроки лечения в ОРИТ в основной группе составили 2,6 дня, в группе сравнения – 3,9. Общий средний койко-день в основной группе составил 8,9 дня, в группе сравнения – 13,7. Летальных случаев в группе сравнения – 2, в основной группе – 1.
Таким образом, профилактическое применение ПВБФ и ОВ позволило корректировать энтеральный патобиом, а также уровень контаминации тонкой кишки патогенами. Снижение уровня контаминации изолятами рода Clostridium мы связываем с эффектами действия ОВ. Конечно, изучение самого распространенного вещества на Земле – воды – является непростой задачей. Имеются ранее опубликованные научные работы об эффективности ОВ при анаэробной инфекции [15]. Вероятно, одним из эффектов ОВ является создание неблагоприятных условия для роста и размножения облигатных анаэробов. Количество ИОХВ в основной группе уменьшилось более чем в 2 раза. Учитывая проведенные микробиологические исследования, можно отметить острую необходимость в разработке и клиническом применении новых фагов, в частности против Citobacter и Acinetobacter.
Результаты показывают, что профилактическое применение ПВБФ и ОВ может представлять собой подход к сохранению барьерной функции кишечника, блокированию проникновения провоспалительных триггеров в портальную систему, предотвращению вызванной кишечным системным воспалением микробной транслокации. Сложные взаимодействия бактериофагов, оксигенированных препаратов и возбудителей на фоне иммунологического дефицита сложно поддаются моделированию и изучению, однако дальнейшее проведение многоцентровых исследований и метаанализов, по нашему мнению, будет являться перспективным направлением в борьбе с ИОХВ.
Заключение. Профилактическое применение ПВБФ и ОВ в экстренной абдоминальной хирургии позволяет нормализовать индуцированный энтеральный патобиом, уменьшить контаминацию патогенами, в более ранние сроки купировать кишечную недостаточность и уменьшить более чем в 2 раза риск возникновения ИОХВ.
Библиографическая ссылка
Топчиев М.А., Паршин Д.С., Чотчаев М.К., Нурмагомедов А.Г., Мисриханов М.К., Бадма-Горяев О.В. ПОТЕНЦИАЛ БАКТЕРИОФАГОВ И ОКСИГЕНИРОВАННОЙ ВОДЫ ДЛЯ ПРОФИЛАКТИКИ ИНФЕКЦИЙ ОБЛАСТИ ХИРУРГИЧЕСКОГО ВМЕШАТЕЛЬСТВА В ЭКСТРЕННОЙ АБДОМИНАЛЬНОЙ ХИРУРГИИ // Современные проблемы науки и образования. 2022. № 3. ;URL: https://science-education.ru/ru/article/view?id=31736 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/spno.31736



