Сепсис является одной из самых обсуждаемых проблем современной медицины. Это связано, прежде всего, с увеличением частоты его возникновения и высокой смертностью, достигающей даже в ведущих клиниках 40% при сепсисе и 80–90% при септическом шоке [1]. Важно распознать данный процесс на раннем этапе, чтобы как можно скорее реализовать меры поддержки, которые оказались бы успешными [2]. В разное время для диагностики сепсиса и мониторинга его лечения использовались различные биомаркеры. Три провоспалительных цитокина (ФНО-α, ИЛ-1β и ИЛ-6), а также C-реактивный белок (CРБ), хорошо зарекомендовавший себя, были исследованы как потенциальные биомаркеры. В 1990-х гг. исследователи обнаружили, что уровни прокальцитонина (ПКТ), предшественника гормона кальцитонина, были повышены у пациентов с бактериальной инфекцией, и ПКТ стал еще одним потенциальным биомаркером [3]. В 2003 г. в обновленное определение сепсиса были добавлены повышенные уровни как СРБ, так и ПКТ. Также на сегодняшний день нет сомнений, что нейтрофильные гранулоциты участвуют в инициации, модуляции, регулировании и разрешении реакций врожденного и адаптивного иммунитета через прямые (путем межклеточного контакта) и опосредованные (через продукцию цитокинов и других биологически активных медиаторов) механизмы [4, 5].
Огромный вклад в улучшение понимания и детализацию биологии нейтрофилов внесла прижизненная микроскопия [6]. Благодаря прижизненной микроскопии удалось изучить процессы рекрутирования, адгезии, миграции нейтрофилов, более детально охарактеризовать эффекторные механизмы, такие как фагоцитоз и образование нейтрофильных внеклеточных ловушек (НВЛ) (neutrophil extracellular traps — NETs) [7]. Внеклеточные сети жизненно важны для очистки от патогенов, но одновременно они вызывают сопутствующее повреждение тканей хозяина при сепсисе [8].
Также хотелось бы обратить внимание на роль пептидиларгининдеиминазы 4 (PAD4), которая необходима для образования НВЛ под действием НАДФ-оксидазы, опосредованной посредниками с активными формами кислорода [7]. Следовательно, активация PAD4 может быть одной из целей формирования внеклеточных сетей. PAD4 представляет собой кальций-зависимый фермент, который катализирует превращение пептидил-аргинина в пептидил-цитруллин. PAD4 локализован в цитоплазме моноцитов, Т- и В-клеток, нейтрофилов, эозинофилов и натуральных киллеров и может перемещаться в ядро после активации клеток.
Хотелось бы отметить, что ни один биомаркер сепсиса не может быть идеальным. Вероятнее всего, биомаркеры должны быть реализованы в виде мультимаркерных панелей. Предстоит проделать значительную работу по определению правильной комбинации. Поскольку большинство новых инновационных подходов к лечению сепсиса нацелены на конкретные биомаркеры, более надежные способы их измерения способствуют успеху этих новых методов лечения.
Цель исследования: построить модели прогноза риска неблагоприятного исхода пациентов с сепсисом с использованием иммунологических показателей на основании множественной логистической регрессии и линейного дискриминантного анализа.
Материалы и методы исследования
Для решения поставленных задач за период с 2014 по 2019 гг. на базе НИИ иммунологии ФГБОУ ВО ЮУГМУ Минздрава России было проведено иммунологическое обследование 44 пациентов, находившихся на лечении в отделениях реанимации и интенсивной терапии ГБУЗ Челябинская областная клиническая больница. Диагноз выставлялся лечащим врачом либо врачом-реаниматологом в соответствии с действующей классификацией. Диагноз сепсиса был подтвержден микробиологическим исследованием. Возраст пациентов варьировал от 19 до 78 лет, средний возраст 54,9 года. Из 44 пациентов 24 были мужчины и 20 – женщины. В зависимости от исхода заболевания пациенты были разделены две группы: в 1-ю группу (n=25) включены пациенты с благоприятным исходом, во 2-ю группу (n=19) – пациенты с летальным исходом. В зависимости от локализации сепсиса в исследование были включены 28 пациентов (63,3%) с абдоминальным сепсисом и 16 (36,7%) пациентов с экстраабдоминальными источниками инфекции сепсиса. Забор венозной крови проводили в динамике с момента постановки диагноза в течение 5 суток или до летального исхода. Учитывались показатели на 1-е и 3-и сутки при благоприятном исходе, а при неблагоприятном – на 1-е и предшествующие летальному исходу сутки. Материалом для исследования функциональной активности нейтрофилов и уровня биологически активных веществ служили: цельная периферическая кровь и сыворотка крови. Выполнялось исследование формирования внеклеточных сетей нейтрофильными гранулоцитами [9]. Определение уровня PAD4 проводили с помощью набора фирмы Wuhan Fine Biotech Co., Ltd, Китай. Этот набор был основан на «сэндвич»-варианте иммуноферментного анализа. А также определялись уровни цитокинов и прокальцитонина методом иммуноферментного анализа.
Для построения моделей прогноза риска неблагоприятного исхода использовали множественную логистическую регрессию и линейный дискриминантный анализ. Для отбора наиболее перспективных предикторов применяли технологию построения «Случайного леса» (Random forest) из деревьев классификации и регрессии, в которой оценивали важность предикторов в 2, 3, 4 и 5 их сочетаниях. Отобранные предикторы использовали далее в моделях логистической регрессии. Для дискриминантного анализа исходные данные трансформировали степенным преобразованием Бокса–Кокса, а отбор показателей в модель проводили прямой пошаговой техникой. Нормальность распределения преобразованных показателей проверяли критерием Шапиро–Уилка, а равенство ковариационных матриц в группах с различным исходом – с помощью M-критерия Бокса. Качество полученных моделей оценивали по статистической значимости эффектов отдельных предикторов (р≤0,05) и по диагностической эффективности (чувствительности и специфичности) всей модели. Расчеты выполнены в пакетах Statistica (version 8.0; StatSoft Inc.) и MedCalc (version 13.0; Medcalc Software LTD).
Результаты исследования и их обсуждение
После получения результатов определения уровней прокальцитонина, PAD4, внеклеточных ловушек и цитокинов в периферической крови у больных сепсисом были выявлены статистически значимые различия, что дало возможность рассматривать их в качестве кандидатов для включения в модель для диагностики. Поскольку их количество оказалось относительно велико по сравнению с объемами выборок, на первом этапе мы предприняли попытку отбора наиболее информативных показателей на основе техники построения «Случайного леса» (Random Forest) из деревьев классификации и регрессии.
Для построения деревьев классификации и их случайного леса были использованы следующие количественные показатели: ИЛ-1ß, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-18, ФНО-α, PAD 4, НВЛ, ПКТ – в периферической крови у больных с сепсисом на 1-е и 3-е сутки (для летального исхода – в сутки, предшествующие смерти).
Анализ позволил вывить следующие закономерности. Во-первых, для всех показателей прогностическая ценность была выше на 3-и (последние) сутки по сравнению с 1-ми сутками. Во-вторых, двух предикторов явно недостаточно для прогноза; 5 предикторов также чаще уступают по ценности более простым моделям. В большинстве случаев максимальная ценность предикторов наблюдается в их сочетаниях по 3–4 показателя. Поэтому в дальнейших попытках построения моделей мы ориентировались на эти числа. Также в разных сочетаниях чаще всего наиболее информативными были интерлейкины, кроме ИЛ-18, особенно ИЛ1-β, а также НВЛ, особенно в сочетаниях из 3–4 показателей. Информативность PAD4 в сочетаниях из 3–4 предикторов также была относительно велика – около 0,7.
На втором этапе с использованием наиболее информативных показателей были построены несколько моделей множественной логистической регрессии. Была выбрана наиболее информативная модель для прогноза исхода сепсиса.
Характеристика данной модели представлена в таблице 1.
Таблица 1
Параметры и характеристика модели 2 логистической регрессии для прогноза неблагоприятного исхода (n=44)
|
Показатели |
Коэффициент регрессии± станд. ошибка |
Отношение шансов [95% ДИ] |
Оценка значимости Р |
|
НВЛ, 3-и/последние сутки |
0,12453± 0,050903 |
1,13 [1,03; 1,25] |
0,014 |
|
PAD4, 3-и/последние сутки |
0,059557± 0,032544 |
1,06 [1,00; 1,13] |
0,067 |
|
IL 6, 3-и/последние сутки |
0,013257 ± 0,0063731 |
1,01 [1,00; 1,03] |
0,038 |
|
Константа |
–6,9761 |
– |
– |
|
Модель полностью: χ2ML=34,23; df=3; Р<0,0001 Чувствительность: 88,0% [71,3; 96,5], Специфичность: 84,2% [63,6; 95,3] Диагностическая эффективность: 86,1% Доля верно классифицированных: 86,4% [74,0; 94,1] Площадь под ROC-кривой: 0,941 [0,826; 0,990] |
|||
Данная модель позволила верно классифицировать 86,4% пациентов, поэтому на практике мы предлагаем использовать именно ее.
Соответствующие формулы внесены также в расчетную таблицу MS Excel и могут использоваться на практике. Измеренные для пациента значения умножаются на соответствующие коэффициенты регрессии. Сумма всех произведений и константы модели дает величину логита, по которому далее вычисляется вероятность неблагоприятного исхода. В качестве примера в таблице 2 приведен пример расчета для пациента. Значения показателей для данного пациента, включенных в модель, приведены в колонке «Значение».
Таблица 2
Пример расчета для пациента
|
Показатель |
Значение х |
Коэффициент |
|
НВЛ, 3-и/последние сутки |
52 |
0,12453 |
|
PAD4, 3-и/последние сутки |
28,8 |
0,059557 |
|
IL 6, 3-и/последние сутки |
206,14 |
0,013257 |
|
Константа |
|
–6,9761 |
|
Логит |
3,94749958 |
|
|
Вероятность неблагоприятного исхода р |
0,981 |
|
|
Исход: |
Неблагоприятный |
|
Поскольку р больше 0,5, данного пациента следует отнести в группу риска, причем риск летального исхода очень велик (значение близко к 1). Если бы полученное значение было меньше 0,5, оснований причислять его к группе риска не было бы.
Дискриминантный анализ является одним из методов многомерного статистического исследования. Цель дискриминантного анализа состоит в том, чтобы на основе измерения различных характеристик (признаков, параметров) объекта классифицировать его, т.е. отнести к одной из нескольких групп (классов) некоторым оптимальным способом. Под оптимальным способом понимается либо минимум математического ожидания потерь, либо минимум вероятности ложной классификации. Для реализации поставленной задачи использовался пошаговый метод дискриминантного анализа «Forwardstepwise», где программа на каждом шаге оценивала вклад в функцию дискриминации переменных, не включенных в модель. Переменная, дающая наибольший вклад в функцию дискриминации, включалась в модель, после чего система переходила к следующему шагу в определении весового значения следующего показателя.
Предварительная проверка гистограмм распределения наших показателей показала, что они в большинстве случаев были с выраженной положительной асимметрией и существенно отличались от симметричного нормального распределения. Поскольку классический дискриминантный анализ является параметрической техникой, на первом этапе мы трансформировали наши исходные показатели с помощью преобразования Бокса–Кокса (Box–Cox transformation).
Аналогичным образом были преобразованы все исследуемые иммунологические показатели, полученные значения были использованы далее в дискриминантном анализе. При этом, поскольку число показателей было велико относительно объема выборки, использовали прямую пошаговую технику автоматического отбора показателей, результаты которой корректировали далее самостоятельно. В итоге были получены следующие статистически значимые предикторы для прогноза неблагоприятного исхода: ИЛ18, НВЛ, PAD4. Информация по полученной модели представлена в таблице 3.
Таблица 3
Результаты дискриминантного анализа для выделения пациентов группы риска по исходу
|
Член модели: показатель |
Коэффициент а |
F-критерий (df=1/40) |
Оценка значимости р |
|
X1: IL18, 3-и/последние сутки |
–0,61395 |
20,28 |
0,0001 |
|
X2: PAD4, 3-и/последние сутки |
–534,998 |
6,98 |
0,0117 |
|
X3: НВЛ, 3-и/последние сутки |
–0,84693 |
11,37 |
0,0017 |
|
Константа |
396,8417 |
|
|
|
Модель полностью: F(3/40)=20,27; Р<0,0001; Чувствительность: 100% (95% ДИ от 87,8 до 100,0). Специфичность: 84,0% (95% ДИ от 66,3 до 94,3) Диагностическая эффективность: 92,0%; Доля верно классифицированных: 90,9%. |
|||
Видно, что полученная модель обладала 100%-ной чувствительностью: все пациенты с неблагоприятным исходом были классифицированы верно. Специфичность была ниже: 4 пациента из 25 были неверно отнесены к группе высокого риска. Тем не менее, качество модели следует признать высоким. Данная модель реализована в виде расчетного листа программы Microsoft Excel; пример расчетов по модели представлен на рисунке.
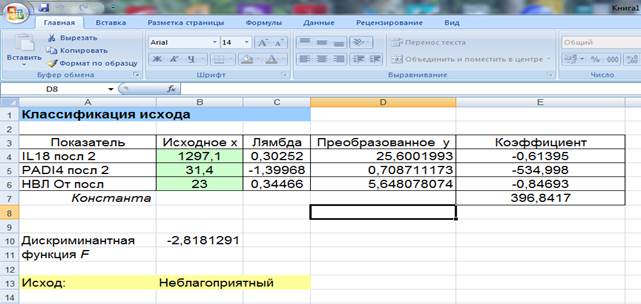
Расчетный лист программы Microsoft Excel
Заключение
Таким образом, предложенные диагностические модели позволяют на основании иммунологических показателей прогнозировать риск развития тяжелого сепсиса с вероятностью неблагоприятного исхода с высокой точностью, а следовательно, и своевременно назначать лечение и корректировать его.
Библиографическая ссылка
Полторак А.Е., Савочкина А.Ю. ИСПОЛЬЗОВАНИЕ ИММУНОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ ДЛЯ СОЗДАНИЯ МОДЕЛИ ПРОГНОЗА ИСХОДА СЕПСИСА НА ОСНОВЕ МНОЖЕСТВЕННОЙ ЛОГИСТИЧЕСКОЙ РЕГРЕССИИ И ДИСКРИМИНАНТНОГО АНАЛИЗА // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31668 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31668



