Экспериментальные и учебные операции на животных – важная составляющая в программе подготовки студентов медицинского вуза и повышения качества хирургических навыков у врачей. Данный метод уходит корнями в глубокую древность, однако впервые истинно научное развитие экспериментальная хирургия получила благодаря великому русскому хирургу Н.И. Пирогову, который по праву считается основоположником этого метода. В 1840 г. Н.И. Пирогов писал: «Я считаю, что операция лишь тогда может рассматриваться как действительное приобретение для науки, когда теория этой операции прочно обоснована опытами...» [1]. Николай Иванович личным примером доказал важность проведения как экспериментальных, так и учебных операций на животных.
В дальнейшем огромный вклад в экспериментальную хирургию внес лауреат Нобелевской премии, академик И.П. Павлов, разработавший целую серию оперативных приемов и доступов, ставших классикой экспериментальной хирургии. Свой неоценимый вклад в развитие экспериментальной хирургии внесли нобелевский лауреат А. Каррель – изобретатель сосудистого шва, У. Холстед – хирург-новатор в самых различных областях хирургии, Т. Бильрот – один из величайших хирургов в истории, основоположник классических абдоминальных операций, С.С. Брюхоненко – изобретатель аппарата искусственного кровообращения, известный своими опытами по автономному существованию органов, В.П. Демихов – отец современной трансплантологии, и многие другие прославленные хирурги [2].
Операция на животных не утратила своей актуальности и по сей день ввиду отсутствия абсолютной альтернативы [3, 4, 5]. Навык работы с живой тканью, а также наблюдение за животным в послеоперационном периоде, отработка важных классических хирургических приемов и навыков, а также введение новых – все это возможно исключительно при оперировании экспериментального животного. Ранее для этой цели широко использовались собаки ввиду доступности и относительной схожести их анатомии с человеческой [6, 7]. Однако за последние 20–25 лет многие медицинские вузы страны потеряли возможность проведения таких операций. Причинами стали как экономическое состояние учреждений, невозможность содержать животных, так и отсутствие и недоступность препаратов для наркотизации, а со временем исчез и навык организации операций на животных. Но в последние годы в Российской Федерации наблюдается возрождение учебно-экспериментальной работы, и это во многом связано с необходимостью устранить нарастающее за предыдущие годы снижение качества практической подготовки молодых хирургов, которые не имели ранее опыта работы с живой тканью, а также с внедрением в клиническую практику новых операций, методик, оборудования. При этом отсутствие алгоритмов организации постоянной учебно-экспериментальной работы, которая была бы адаптирована к современному оборудованию, препаратам и отвечала бы всем поставленным на современном этапе развития медицины задачам, являет собой серьезную проблему, препятствующую внедрению такой работы в повседневную практику вузов.
На базе ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России функционирует лаборатория экспериментальной хирургии, которая используется для проведения хирургических экспериментов, необходимых для научных исследований. Однако с 2017 г. лаборатория под непосредственным патронажем кафедры оперативной хирургии и топографической анатомии расширила свою деятельность. Для практической подготовки студентов и врачей ее коллектив адаптировал операционную, создал собственные алгоритмы ведения операций, наладил хирургическую работу и по сей день совместно с кафедрой неврологии, нейрохирургии и медицинской генетики, а также хирургами-клиницистами различных специальностей выполняет серию обучающих и показательных операций для врачей и студентов с их практическим участием.
Многие операции впервые в Российской Федерации выполнены на экспериментальных животных. Одной из таких операций является коррекция аномалии Киари, на примере которой мы опишем наш опыт организации регулярной учебно-экспериментальной работы.
Аномалия Киари – это опущение миндалин мозжечка в большое затылочное отверстие с их вклинением вследствие анатомических особенностей строения затылочной кости и варианта развития самого мозжечка [8]. Данная патология – сравнительно редкая, встречающаяся у 0,1–0,5% населения [9]. По результатам собственных клинических наблюдений в Северо-Кавказском регионе мы отметили высокий процент встречаемости этой аномалии ввиду наличия этнически обусловленной платибазии. Клиническая манифестация болезни происходит в трудоспособном возрасте, от 20 до 40 лет, причем чаще встречается у женщин [8, 10]. Для ее коррекции используется относительно несложное оперативное вмешательство: резекция чешуи затылочной кости по средней линии, в пределах нижней выйной линии, дополненная ляминэктомией С1 позвонка с целью декомпрессии миндалин мозжечка, а при значительном их опущении дополнительно производится вскрытие твердой мозговой оболочки (ТМО) и возможна резекция пролабирующих миндалин с последующей пластикой ТМО.
Учитывая актуальность владения этой операцией в эндемичном по данной нозологии регионе, крайне важна отработка практической части операции на живой модели. Нами были введены в практику обучения врачей, в том числе клинических ординаторов, модель и алгоритм оперативного вмешательства, позволяющие освоить не только коррекцию аномалии Киари, но и ряд других операций в области задней черепной ямки, а также освоить базовые методики нейрохирургических операций в целом.
При подготовке хирургических кадров важным элементом, отражающим качественную сторону практической подготовки, является кривая обучаемости, согласно которой качество выполнения операций, выражающееся в низких уровнях послеоперационных осложнений, летальности, хорошем прогнозе выздоровления и реабилитации пациентов, напрямую коррелирует с постоянным практическим овладением методикой выполнения операции, ее совершенствованием и количеством выполненных однотипных операций. Следовательно, введение в практическую подготовку врачей экспериментальной модели на животном позволяет набрать необходимый опыт и повысить качество овладения и выполнения данных операций, что в дальнейшем положительно скажется при выполнении оперативных вмешательств на пациентах. Повышение качества практической подготовки посредством выполнения операций на животных моделях и является целью разработки алгоритма хирургических манипуляций и внедрения операций в практику подготовки специалистов.
Материалы и методы исследования. Нами был создан алгоритм ведения хирургической работы экспериментальной операционной, отвечающий современным требованиям к учебно-экспериментальному процессу. Во-первых, для такой работы на сегодняшний день используются карликовые лабораторные свиньи – мини-пиги. Использование собак давно ушло на второй план. Однако работа с мини-пигами экономически менее выгодна, но при этом анатомическое строение свиней максимально приближено к таковому у человека. Поэтому нами было решено использовать экономически более выгодный вариант – поросят весом 30–35 кг породы «крупная белая». Содержание таких поросят производится в виварии университета при соответствующих условиях. За день до предполагаемой операции животное перемещается в бокс, где производится первичная санитарная обработка, ограничиваются, но не исключаются полностью еда и питье. За 5 ч до операции еда исключается.
За 1 ч до операции с целью седации и миорелаксации животному в холку производится инъекция смеси ксилазина и золазепама в дозе 5 мг/кг и 4 мг/кг массы тела соответственно. После инъекции могут наблюдаться гиперсаливация, кратковременная двигательная активность, рвота, непроизвольные мочеиспускание и дефекация. Спустя 6–10 мин животное теряет двигательную активность и может быть перенесено в предоперационную для подготовки. В этом состоянии производятся мытье и бритье животного. Для данной операции выбриваются передняя и задняя поверхности шеи, голова. Свинье устанавливается периферический венозный катетер в центральную или латеральную вену уха, производится его проверка, и сразу же внутривенно вводится премедикация: раствор атропина сульфата 0,1%-ный – 0,05 мг/кг, раствор анальгина 50%-ный – 0,5 мл/10 кг, раствор димедрола 1%-ный – 0,5 мл/10 кг, цефтриаксон 500 мг/10 кг, причем все в разных шприцах, между вливаниями производится промывание катетера 10 мл физиологического раствора. После премедикации практически сразу вводится препарат для индукции наркоза: пропофол 1%-ный – 2,5 мг/кг. Одновременно производится установка уретрального катетера с присоединением резервуара. Область операционного поля обрабатывается 70%-ным этиловым спиртом, животное переносится в операционную, фиксируется на операционном столе с помощью металлических ограничителей в положении на спине с запрокинутой назад головой, под область лопаток подкладывается матерчатый валик для придания шейному отделу разгибательного положения. Следующим важным этапом любой экспериментальной операции на свинье является обеспечение центрального венозного доступа, так как периферический не способен выдерживать постоянную инфузионную нагрузку и может приходить в функциональную негодность. Наиболее удобными сосудами для центрального венозного доступа являются внутренняя или наружная яремные вены (рис. 1А, 1B). Причем для упрощения методики их пункции мы рекомендуем выполнять их хирургическое выделение. Кожа передней поверхности шеи обрабатывается йодопироном, накрывается стерильным хирургическим бельем, которое либо подшивается к коже, либо прикалывается цапками, и после еще раз обрабатывается йодопироном. Внутривенно вводится раствор трамадола 5%-ный – 2 мг/кг. Любые разрезы мы рекомендуем выполнять после предварительной инфильтрации тканей либо 5%-ным раствором новокаина, либо физиологическим раствором. Это способствует гемостазу, происходит гидравлическая препаровка тканей, что облегчает ход операции. Для доступа к вене посередине расстояния от яремной вырезки до щитовидного хряща, точно по медиальному краю брахиоцефальной мышцы (аналог грудино-ключично-сосцевидной мышцы человека), производится линейный разрез кожи и жировой клетчатки до 3–4 см. Мышца крючком оттесняется латерально, с помощью диссектора разволокняется соединительная ткань, на глубине около 3 см визуализируется вена. Вена должна быть видна на протяжении не менее 2 см (рис. 1С). Участок размерами 3х3 мм на передней поверхности вены очищается от адвентиции, вена прижимается пальцем каудальнее этого участка, и с помощью иглы из набора для центральной венозной катетеризации производится ее пункция, игла продвигается по направлению к сердцу не более чем на 1 см (учитывая риск перфорации), при этом как бы приподнимая наружную стенку вены. После этого медленно вводится гибкий металлический проводник на длину 15–18 см. Он должен проходить без препятствий, легко. Далее выполняются проведение по проводнику гибкого катетера на всю его длину и удаление проводника. Катетер тут же проверяется шприцем с физиологическим раствором с гепарином (вначале создается разряжение, а после получения дозы крови – нагнетание раствора) (рис. 1D, 1F). Кровь должна забираться легко. Основной наркоз пропофолом через центральный венозный катетер шприцевым насосом в дозе 10 мг/кг/час – в течение 30 мин, 5 мг/кг/час – остальное время. Это обеспечит стойкое пролонгирование наркоза. Одновременно с установкой системы болюсно вводится раствор дроперидола 0,25%-ный – 3 мг/кг. Введение дроперидола производится каждые 45 мин. Венозный катетер подшивается к коже, рана рыхло тампонируется гемостатической губкой, ее края сводятся лейкопластырной стяжкой для возможности постоянного доступа к вене.
Следующим этапом предоперационной подготовки является выполнение трахеостомии (рис. 1G, 1I). Опыт показывает, что проведение операций без искусственной вентиляции легких значительно повышает риск интраоперационных осложнений, таких как внезапная остановка дыхания, гипоксия, гиповентиляция, вызванных, прежде всего, миорелаксирующими эффектами препаратов для наркоза, а также вагусными реакциями. Поэтому контроль над дыханием – важный элемент предоперационной подготовки.
Для интубации свиней необходим определенный навык, в целом это относительно трудоемкий процесс. Поэтому в нашей экспериментальной операционной выполняется нижняя трахеостомия. Во-первых, выполнение такой операции позволяет студентам и врачам овладеть этой крайне важной для любого хирурга манипуляцией в полной мере; во-вторых, это дополнительно дает возможность работы с живым материалом, осваиваются навыки работы с коагулятором; в-третьих, такая простая манипуляция позволяет быстро и без особых трудностей начать искусственную вентиляцию легких. Надо заметить, что хирургическая анатомия этой области практически идентична человеческой, что делает данную операцию максимально приближенной к таковой на человеке. Область трахеи от щитовидного хряща до яремной вырезки еще раз обрабатывается йодопироном, производится линейный разрез кожи и подкожной клетчатки от перстневидного хряща на 3 см книзу, по средней линии. Края раны разводятся либо ранорасширителем Янсена или Адсона, либо крючками Фолькмана. Гемостаз производится коагуляцией биполярным пинцетом на мощности 50 Вт. Диссектором или зажимом типа «москит» расслаиваются мышцы, причем пальцем пальпируют кольца трахеи и убеждаются в ее срединном положении. Устанавливаются крючки Фарабефа, дном раны должна быть хорошо визуализируемая трахея. Верхнее ее кольцо фиксируется крючком Шассеньяка, подтягивается кпереди, и скальпелем поперечно рассекаются 2 нижележащих кольца, устанавливается трахеостомическая трубка, раздувается манжета. Далее убеждаются в наличии экскурсии, вентилируемости легких, проходимости трубки. Края раны ушивают, трубку надежно подшивают к коже несколькими швами. С целью миорелаксации и выключения самостоятельной работы дыхательной мускулатуры болюсно вводят раствор пипекурония бромида 0,2%-ный – 0,05 мг/кг. В дальнейшем поддерживающая доза препарата – 0,02 мг/кг каждые 30–45 мин. После этого подсоединяют аппарат искусственной вентиляции легких. В нашей операционной используются аппарат Фаза-5 и аппарат РО-2, работающие по открытому контуру, с минимальным разряжением, без кислородной поддержки. Присоединение кислородного баллона производится только при операциях, вызывающих гипоксию, например на сердце, при выключении одного легкого, массивных вмешательствах на мозге. Наша практика показывает, что кислородное обеспечение вовсе не обязательно для большинства проводимых в рамках учебно-экспериментальной работы операций, и животные хорошо переносят проведение ИВЛ атмосферным воздухом.
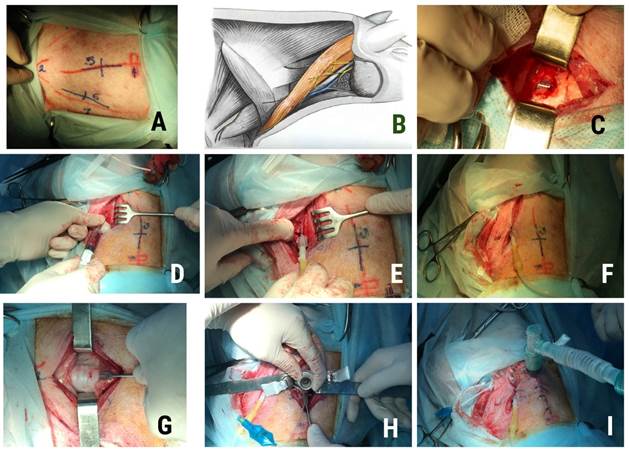
Рис. 1. Хирургический этап подготовки свиньи для учебно-экспериментальной операции
Примечание. A – Ориентиры для выполнения центрального венозного доступа и трахеостомии у свиньи. Вид передней шейной области, сверху. Головной конец справа. Красная линия 1 – медиальный край брахиоцефальной (кивательной) мышцы, красный угол; 2 – яремная вырезка, стрелкой указана проекция перстневидного хряща, Синие линии: 5 – проекция разреза для выполнения трахеостомии; 6 – проекция разреза для выполнения центрального венозного доступа; B – Анатомия доступа к наружной яремной вене у свиней: m.brachiocephalicus и лежащая медиально наружная яремная вена; С – после разреза кожи и ПЖК в отмеченной проекции виден участок полнокровной вены с блестящей адвентицией; D – Пункция яремной вены. Медиальные структуры шеи оттеснены крючком Фолькмана. В шприце с физиологическим раствором с гепарином появилась венозная кровь – признак верно проведенной венепункции; E – К катетеру подключена система для внутривенных инфузий; F – Система для инфузий подключена, на рану наложен временный узловой шов; G – Края разреза разведены крючками Фарабефа, хорошо визуализируются кольца трахеи. Трахея фиксирована и подтянута кнаружи двузубым крючком. В правом углу раны (головной конец) виден нижний край щитовидной железы; H – Установка трахеостомической трубки. Крючки не убираются, пока не будет окончательно проверены проходимость трубки и ее верное положение. Головной конец сверху; I – Трубка подшита к коже, фиксирована. Наложены фиксирующие швы на кожу. Подключен аппарат искусственной вентиляции легких
На этом хирургический этап подготовки животного к самой операции заканчивается, и свинью переворачивают на живот, при этом нужно следить, чтобы центральный венозный катетер с системой для инфузий и трахеостомическая трубка с системой для ИВЛ не сместились и не были перекручены или пережаты. Под область ключиц подкладывают валик, голову фиксируют в скобе, ножной конец стола и скобу опускают так, чтобы шея прияла сгибательное положение, а головной конец был ниже холки. Производят двукратную обработку йодопироном, оперируемую область обкладывают стерильным бельем, которое подшивают к коже, затем поле обрабатывают еще раз. Доступ можно производить без использования оптики, однако саму операцию удобнее производить с использованием бинокулярных очков или, что еще лучше, операционного микроскопа. В нашем распоряжении имеется и то и другое. Разрез кожи и подкожной жировой клетчатки рекомендуем делать широкий, по средней линии, от лямбдовидного шва до 5–7-го шейного позвонка. Подкожная жировая клетчатка у свиней более выражена, чем у человека. Гемостаз – коагуляция биполярным пинцетом. На рану накладывается нейрохирургический ранорасширитель Егорова. Медиально визуализируется «белая линия» шеи, по которой скальпелем производится разрез. Рассекается также надкостица затылочной кости, кровоточащие мышцы коагулируются. Обнажаются остистые отростки С2–С4, задний бугорок С1, наружный затылочный выступ. Надкостница с затылочной кости осторожно отделяется распатором, причем кость затирается хирургическим воском для предупреждения воздушной эмболии через эмиссарные вены. Дальнейший этап удобнее выполнять под микроскопом с увеличением 7–8 крат. Визуализируются атланто-окципитальное сочленение и край большого затылочного отверстия. Под него по средней линии подводят тонкий мозговой шпатель и маятникообразными движениями слегка отслаивают твердую мозговую оболочку. Не убирая шпателя, с помощью малых пистолетных кусачек Ферри–Смит–Керрисона выкусывают часть затылочной кости, делая возможным большее оттеснение твердой мозговой оболочки от кости. Прикрывая ТМО мозговым шпателем, малыми кусачками Егорова–Фрейдина или Янсена выкусывают окно в затылочной кости 1х1 см, которое постепенно расширяют и доводят до размера 2х3 см. После этого кусачками Ферри–Смит–Керрисона выкусывают дужки С1 и, если необходимо, С2, причем нужно производить ляминэктомию более латерально, не забывая при этом о высоком риске повреждения позвоночных артерий, лежащих еще латеральнее. На данном этапе можно считать, что проведена декомпрессия миндалин мозжечка. Однако можно расширить операцию и вскрыть твердую мозговую оболочку (рис. 2).
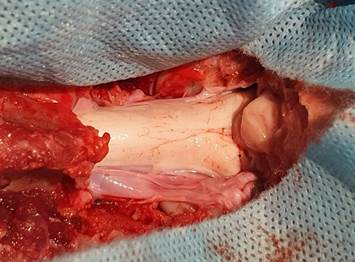
Рис. 1. Этап операции по коррекции аномалии Киари на свинье. Слева – каудальный, справа – ростральный концы. ТМО вскрыта, откинута в стороны. В правом углу раны видны миндалины мозжечка
Делается это микрохирургическими ножницами после предварительной коагуляции ее биполярным пинцетом с мощностью 15–20 Вт. Обильно вытекает ликвор. Животному перед вскрытием оболочки желательно болюсно ввести 0,3 мл раствора адреналина, болюсно ввести 2 мл пропофола и установить на максимальную скорость систему для инфузий, временно сменив раствор пропофола на чистый физиологический раствор. Далее мы выполняли резекцию миндалин мозжечка с помощью биполярного пинцета с мощностью 20–25 Вт. После резекции твердую мозговую оболочку ушивали проленом 5/0 микрохирургическим иглодержателем. Шов должен быть частым, лучше применять шов Мультановского для обеспечения герметичности и профилактики ликвореи. На шов накладывается полоска гемостатической губки. Мы пришли к выводу, что лучшие результаты при профилактике ликвореи дают губки, предварительно пропитанные кровью и несколько отжатые. Создается так называемая кровяная заплата, которая применяется для герметизации твердой мозговой оболочки после люмбальных пункций, если имеет место утечка ликвора. Этап после вскрытия ТМО не должен длиться более 15–25 мин, в противном случае глубина наркотизации может теряться. При длительности работы более 20 мин рекомендуем вводить болюсно 1 мл пропофола каждые 20 мин. После герметизации ТМО к инфузионной системе вновь подключают раствор пропофола со стандартной скоростью. Рана ушивается послойно ПГА 3/0, на кожу накладывается простой узловой шов капроном 3/0. Рана области центрального венозного катетера ушивается узловыми швами, при этом катетер сохраняется и продолжает функционировать. Накладывают повязки на раны. За 25–30 мин до планируемого окончания операции введение поддерживающей дозы пипекурония бромида и дроперидола не производят. После обработки швов раствором йодопирона или бриллиантовой зелени прекращают введение раствора пропофола. Внутривенно вводят раствор атропина сульфата 0,1%-ный – 1 мл, а спустя 15 мин – внутривенно раствор Неостигмина метилсульфата 0,05%-ный – 1 мл. Болюсно вводят раствор эуфиллина 2,4%-ный – 0,24 мг/кг и кофеина-бензоата натрия 10%-ный – 5 мг/кг. Спустя полчаса после первой инъекции неостигмина метилсульфата его вводят подкожно в количестве 1 мл. Отсоединяют аппарат ИВЛ, определяют наличие самостоятельного дыхания, его адекватность и постоянность. Извлекают трахеостомическую трубку, рану ушивают послойно, обрабатывают швы. Извлекают венозные катетеры. Животное к этому времени должно моргать, реагировать на болевые раздражители, должна появляться двигательная активность. Для предупреждения нежелательной гиперактивности рекомендуем конечности связать бинтами. Животное переносят в стерильный бокс, согревают водяными грелками, предоставляют доступ к воде. Спустя 1,5–2 ч конечности можно развязать. Дальнейший уход предусматривает введение антибиотиков, обработку послеоперационной раны с последующим снятием швов на 7–10-й день.
Результаты исследования и их обсуждение. Нами была проведена работа по внедрению в практическую подготовку студентов и врачей операций на животных, адаптированных к современным условиям, оборудованию и препаратам, разработаны протокол и алгоритм предоперационной и первичной хирургической подготовки экспериментальных животных, описаны алгоритмы оперативных вмешательств на примере операции по коррекции аномалии Киари, впервые в Российской Федерации произведена учебно-экспериментальная операция по коррекции аномалии Киари на животном, ведутся разработки моделей других операций. Алгоритм включает в себя все звенья подготовки и интраоперационного ведения животного, соотносимые с таковыми в клинике. Это позволяет студентам и молодым хирургам овладеть навыками предоперационной подготовки, первичными хирургическими навыками работы с живыми тканями, остановки кровотечения, научиться работать с биполярной и монополярной коагуляцией, дает возможность изучить и практически отработать выполнение трахеостомии, обнажение сосудистых пучков и катетеризацию центральных вен, отработать швы мышц, кожи. Конкретная операция также позволяет получить навыки самостоятельной работы со спинным мозгом, мозжечком, твердой мозговой оболочкой, выполнить ее герметизацию, освоить микрохирургическую технику и работу под операционным микроскопом. Помимо указанных хирургических навыков, студенты и молодые специалисты могут изучить технику ведения наркоза, что важно для понимания целостной картины хирургического процесса.
Необходимо отметить, что оставшееся в живых животное после реабилитации, которая длится не более 10–14 дней, снова может быть использовано в другой операции.
Заключение
Эксперимент в хирургии, равно как и учебные операции на животных – неотъемлемая и крайне важная часть обучения студентов и врачей, являющаяся необходимым вкладом в формирование хирургического клинического мышления, хирургической тактики, оперативной техники и повышающая качество выполняемых операций уже на пациентах. Ввиду различных социально-экономических причин некогда мощная российская школа учебно-экспериментальной хирургии претерпевала период застоя и упадка, не происходило ее поддержки и развития. В последние годы происходит ее возрождение в медицинских вузах страны. Но часто восстановить такую деятельность бывает непросто из-за отсутствия алгоритмов действия, а современная медицина при этом требует новых методик оперирования, умения работать с новым высокотехнологичным оборудованием, препаратами; изменились подходы к лечению многих заболеваний. Нами на примере операции по коррекции аномалии Киари был описан опыт успешного внедрения учебно-экспериментальной деятельности в повседневную практику вуза исходя из современных реалий. Помимо этого, впервые на территории Российской Федерации была проведена подобная операция на животном с учебной целью. Использование крупного поросенка породы «крупная белая» не только экономически более выгодно по сравнению с мини-пигами (также он является наилучшей моделью из-за схожести анатомии с человеком), но и позволяет использовать его как единовременно, так и многократно в качестве модели для различных хирургических направлений и операций. На одном поросенке можно не только сделать одну полноценную операцию, но и сразу же расширить ее, трансформировать, модифицировать в другую, что позволяет овладеть за один раз сразу несколькими операциями и хирургическими приемами. Параллельно студенты и врачи могут освоить навыки трахеостомии, венесекции, оказания полноценного анестезиологического пособия, овладеть работой хирургическим инструментарием и оборудованием, наблюдать все этапы подготовки животного, изучить на практике режим стерильности операционной, проследить за послеоперационным периодом, что позволяет создать единую завершенную картину хирургического процесса.
Библиографическая ссылка
Лебенштейн-Гумовски М.В., Шатохин А.А., Башаханов Р.М., Байрамкулов У.И., Азизов А.А., Сумкина О.Б. ОПЫТ ВНЕДРЕНИЯ В ПРАКТИЧЕСКУЮ ПОДГОТОВКУ ВРАЧЕЙ И СТУДЕНТОВ ОПЕРАЦИЙ НА ЖИВОТНЫХ В РАМКАХ РАБОТЫ ЭКСПЕРИМЕНТАЛЬНОЙ ОПЕРАЦИОННОЙ НА ПРИМЕРЕ МОДЕЛИ ОПЕРАЦИИ НА ЗАДНЕЙ ЧЕРЕПНОЙ ЯМКЕ ПО ПОВОДУ КОРРЕКЦИИ АНОМАЛИИ КИАРИ // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31634 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31634



