Ожирение за последние десятилетия приняло масштаб эпидемии: по прогнозам ВОЗ, к 2030 г. до 41% всего населения будут страдать от избыточной массы тела. Экономическое бремя связанных с ожирением нозологий в России составляет более 500 млрд руб. в год [1].
Данное заболевание является мультифакторным, в его развитии, помимо социальных и экологических факторов, важную роль играет наследственность. По данным метаанализа ассоциации генома (GWAS) установлены 97 локусов, связанных с ожирением, что составляет лишь 2,7% от вариантов развития ожирения [2]. Генетические локусы, связанные с заболеваниями при ожирении (такими как сахарный диабет, артериальная гипертония, сердечно-сосудистые заболевания), могут влиять на регуляцию гомеостатических процессов, приводя к их манифестации [3].
Недостаточно исследованным при этом остается вопрос генетической предрасположенности к ожирению и ассоциированным с ним кардиометаболическим нарушениям в детской популяции [4]: артериальной гипертонии, ремоделированию левого желудочка, дисфункции эндотелия, инсулинорезистентности и др. [5, 6, 7]. Кроме того, не выявлены связи между локусами ожирения и полиморфизмами генов, определяющими развитие патологии сердечно-сосудистой системы, в том числе полиморфизмами рецептора брадикинина и фермента химазы.
Наиболее изученным геном, связанным с ожирением, является ген FTO, расположенный в хромосоме 16 (16q12.2). Полиморфные участки данного гена различаются в разных популяциях [8]. В исследованиях была установлена ассоциация полиморфизмов rs9939609 гена FTO и генов, связанных с риском сердечно-сосудистых заболеваний. Данный полиморфизм гена FTO широко представлен в европейской популяции (41%), тем не менее, основное внимание до сих пор уделяли его влиянию на индекс массы тела у взрослого населения.
Брадикинин, являясь мощным вазодилататором, способствует снижению артериального давления через его действие на рецептор BDKRB2, который кодируется геном, локализованным на хромосоме 14q32 и экспрессируемым в большинстве тканей человека. У лиц с ожирением полиморфизм BDKRB2 ins/del(9b) (rs5810761) связывают с развитием тромбоза вен [9], также он является фактором риска гипертрофии левого желудочка.
Другим белком, принимающим участие в регуляции тонуса сосудов, является химаза. Это фермент, который включен в альтернативный путь синтеза ангиотензина II, минуя ангиотензин-превращающий фермент. Показано, что ингибиторы химазы способствуют предотвращению пролиферации сосудов, улучшению сердечной функции и ингибированию ремоделирования сосудов и сердечной мышцы [10]. Ген химазы 1 CMA1 расположен на длинном плече хромосомы 14. Полиморфизмы гена CMA1 связывают с сердечной недостаточностью и стенозом аорты. Так, полиморфизм rs1800875 гена CMA1/В связан с гипертрофией сердечной мышцы, особенно у мужчин [11].
Целью данного исследования явилось изучение взаимосвязи полиморфизмов генов рецептора брадикинина (BDKRB2 ins/del(9b)), химазы (CMA1/В 1903A>G) и гена, связанного с ожирением (fat mass and obesity associated, FTO rs9939609), в детской и подростковой популяции.
Материал и методы исследования
Одномоментное (поперечное) исследование проведено на базе МБУЗ «Детская городская поликлиника № 4 г. Ростова-на-Дону» за период 2018–2020 гг. В обследовании приняли участие 370 детей и подростков с ожирением от 3 до 17 лет (основная группа) с индексом массы тела (ИМТ) >30, а также 123 ребенка и подростка того же возраста без ожирения (ИМТ ˂20), соответствующие >75-процентному перцентилю в зависимости от пола и возраста (группа сравнения). Индекс массы тела рассчитывали путем деления значения массы тела (кг) на квадрат роста (м2). Массу тела замеряли с использованием медицинских весов, рост – с использованием ростомера. Для верификации индекса массы тела использовали процентильные таблицы соотношения возрастно-половых значений и ИМТ.
Методы извлечения ДНК и генотипирования
Образцы геномной ДНК выделяли из цельной крови пациентов стандартным фенол-хлороформным методом. Однонуклеотидный полиморфизм определяли с помощью полимеразной цепной реакции (ПЦР). Использовались специфичные праймеры (табл. 1).
Таблица 1
Тип полиморфизма, последовательности праймеров и номенклатура аллелей полиморфных ДНК-локусов
|
Локус |
Полиморфизм (rs номер) |
Праймеры |
|
FTO |
A23525T rs9939609 г |
5’-AACTGGCTCTTGAATGAAATAGGATTCAGA-3’ 5’- AGAGTAACAGAGACTATCCAAGTGCAGTAC-3’ |
|
CMA1 (14q11.2) |
-1903A>G (rs1800875) |
5’ – GGAAATGTGAGCAGATAGTGCAGTC – 3’ 5’ – AATCCGGAGCTGGAGAACTCTTGTC – 3’ |
|
BDKRB2 (14q32.1-q32.2) |
+9/-9 (rs5810761) |
5’- TCTGGCTTCTGGGCTCCGAG - 3’ 5’- AGCGGCATGGGCACTTCAGT -3’ |
Для выявления однонуклеотидной замены полиморфного варианта -1903A>G гена СМА1 использовали метод полиморфизма длин рестрикционных фрагментов (ПДРФ), ампликон инкубировали вместе с эндонуклеазой рестрикции BstXI.
Статистический анализ. Для оценки ген-генных взаимоотношений использовали метод снижения размерности – MDR (Multifactor Dimensionality Reduction). Мультилокусные генотипы были объединены в группы высокого и низкого риска для сведения предикторов генотипа к одному измерению. После получения набора моделей для определения наилучшей общей из них использовали индексы сбалансированной точности тестирования (TBA) и согласованности перекрестной валидации (CVC). Коррекцию на множественные сравнения проводили с использованием пермутационного теста. Статистически значимыми считали модели с уровнем значимости p˂0,05.
Соответствие эмпирического распределения генотипов и аллельных вариантов/генотипов генов FTO, BDKRB2 и CMA1/В теоретически ожидаемому распределению при равновесии Харди–Вайнберга анализировали с использованием χ2 теста. Была проведена коррекция для непрерывности и расчета соотношения шансов и 95%-ного доверительного интервала (95% CI). Для определения риска ожирения, связанного с аллелями риска, проводили расчет связи между генотипом и аллелем ожирения с использованием отношения шансов (OR) и 95%-ного доверительного интервала (CI), где непараметрические данные выражали с помощью компьютерной программы WinPepi версии 11.655 с использованием χ2 теста и критерия Фишера.
Результаты исследования и их обсуждение
При проведении сравнительного анализа распределения частот аллелей генов FTO, BDKRB2 и CMA1/В установлено, что носительство аллеля Т чаще наблюдалось в основной группе относительно контрольной группы детей и подростков. Распределение аллелей генов BDKRB2 и CMA1/В не различалось в основной группе и группе не страдающих ожирением детей и подростков (табл. 2).
Таблица 2
Частота аллелей полиморфизмов генов FTO, BDKRB2 и CMA1/В в группе детей и подростков с ожирением и в группе сравнения
|
Гены |
Аллели |
Ожирение |
Контроль |
χ2 |
p |
ОШ (95% ДИ) |
|
|
n = 740 (%) |
n = 400 (%) |
95% CI |
|||||
|
BDKRB2 ins/del (9b) |
Ins9 |
679 (91,76) |
372 (93,0) |
0,558 |
0,489 |
0,84 |
0,53–1,33 |
|
Del9 |
61 (8,24) |
28 (7,0) |
1,19 |
0,75–1,90 |
|||
|
CMA1-1903A>G |
A |
586 (79,2) |
237 (79,0) |
2,427 |
0,120 |
1,21 |
0,95–1,55 |
|
G |
154 (20,8) |
63 (21,0) |
0,82 |
0,64–1,05 |
|||
|
FTO |
T |
348 (47,0) |
150 (37,5) |
9,580 |
0,002 |
1,48 |
1,15–1,90 |
|
A |
392 (53,0) |
250 (62,5) |
0,68 |
0,53–0,87 |
|||
Далее был проведен анализ частот генотипов, в результате было установлено, что в группе детей и подростков с ожирением чаще встречаются генотипы Ins9/del9 (BDKRB2 ins/del (9b)), AA (CMA1-1903A>G) и AA (FTO rs9939609 T>A) относительно детей и подростков группы сравнения (табл. 3).
Таблица 3
Анализ распределения частот генотипов FTO, BDKRB2 и CMA1/В в группе детей и подростков с ожирением и в группе сравнения
|
BDKRB2 ins/del (9b) |
Ожирение n=370 |
Контроль n=200 |
X2 |
ОШ (95% ДИ) |
P |
|
Ins9/ins9 |
317 |
181 |
2,738 |
0,63 (0,36–1,09) |
0,113 |
|
Ins9/del9 |
45 |
10 |
7,639 |
2,63 (1,30–5,33) |
0,005 |
|
del9/del9 |
8 |
9 |
2,452 |
0,47 (0,18–1,23) |
0,128 |
|
P-HWE |
0,0001 |
0,0000 |
|
|
|
|
CMA1-1903A>G |
% |
% |
X2 |
ОШ (95% ДИ) |
P |
|
AA |
82 |
29 |
4,860 |
1,68 (1,06–2,67) |
0,027 |
|
AG |
188 |
113 |
1,686 |
0,80 (0,56–1,12) |
0,219 |
|
GG |
100 |
58 |
0,252 |
(0,62–1,33) 0,91 |
0,625 |
|
P-HWE |
0,720 |
0,029 |
|
|
|
|
FTO rs9939609 T>A |
% |
% |
X2 |
ОШ (95% ДИ) |
P |
|
TT |
83 |
35 |
1,924 |
1,36 (0,88–2,11) |
0,194 |
|
AT |
182 |
80 |
4,414 |
1,45 (1,03–2,06) |
0,043 |
|
AA |
105 |
85 |
11,650 |
0,54 (0,37–0,77) |
0,001 |
|
P-HWE |
0,806 |
0,038 |
|
|
|
При анализе ассоциаций выявлены две статистически значимые связи: полиморфизм rs1800875 гена CMA1 связан с увеличением риска ожирения (р=0,027) у гетерозиготных носителей минорного аллеля G по доминантному типу наследования, а также установлена связь полиморфизма rs9939609 гена FTO с ростом риска ожирения у гетерозиготных носителей аллеля А по рецессивному типу наследования (табл. 4).
Таблица 4
Частоты генотипов и аллелей полиморфизмов генов FTO, BDKRB2 и CMA1/В при доминантной и рецессивной моделях наследования
|
Гены |
Генотипы |
Ожирение n=370 (%) |
Контроль n=200 (%) |
χ2 |
P |
ОШ (95% ДИ) |
|
BDKRB2 ins/del (9b) |
adel9/del9 + ins9/del9 vs ins9/ins9 |
53 (14,3) 317 (85,7) |
19 (9,5) 181 (90,5) |
2,738 |
0,113 |
1,59 (0,92–2,77) |
|
bdel9/del9 vs ins9/del9 + ins9/ins9 |
8 (2,2) 362 (97,8) |
9 (4,5) 191 (95,5) |
2,452 |
0,128 |
0,47 (0,18–1,23) |
|
|
CMA1-1903A>G |
aGG + AG vs AA |
288 (77,8) 82 (22,2) |
171 (85,5) 29 (14,5) |
4,860 |
0,027 |
0,60 (0,37–0,95) |
|
bGG + AG vs AA |
100 (27,0) 270 (73,0) |
58 (29,0) 142 (71,0) |
0,252 |
0,625 |
0,91 (0,62–1,33) |
|
|
FTO rs9939609 T>A |
aAA + AT vs TT |
287 (77,6) 83 (22,4) |
165 (82,5) 35 (17,5) |
1,924 |
0,194 |
0,73 (0,47–1,14) |
|
bAA vs AT + TT |
105 (28,4) 265 (71,6) |
85 (42,5) 115 (57,5) |
11,650 |
0,001 |
0,54 (0,37–0,77) |
При изучении межгенных взаимоотношений полиморфизмов ins/del(9b) гена BDKRB2, 1903A>G гена CMA1/В и rs9939609 гена FTO были получены модели межгенных взаимоотношений при ожирении у детей и подростков. С использованием метода MDR показано, что связь ожирения и двухлокусных взаимоотношений BDKRB2 ins/del(9b) и CMA1/В 1903A>G составила 59% (р=0,0001), а связь трехлокусных взаимоотношений BDKRB2 ins/del(9b), CMA1/В 1903A>G и FTO T>A составила 0,52% (р=0,0001) (табл. 5).
Таблица 5
Анализ межгенных взаимодействий с помощью метода снижения размерности (MDR)
|
Полиморфизмы генов |
Тестируемая сбалансированная точность (TBA) |
Индекс перекрестной проверки согласованности (CVC) |
χ2 |
P |
ОШ (95% ДИ) |
|
BDKRB2 ins/del(9b) – CMA1/В 1903A>G |
0,585
|
10/10 |
17,142 |
0,0001 |
2,136 (1,48–3,07)
|
|
BDKRB2 ins/del(9b) – CMA1/В 1903A>G – FTO T>A |
0,594 |
10/10 |
18,974 |
0,0001 |
2,185 (1,53–3,11) |
При этом интересно, что взаимоотношения между тремя локусами носят антагонистический характер (рис. 1).
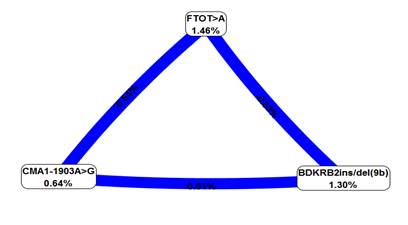
Рис. 1. График межгенных взаимодействий BDKRB2 ins/del(9b), CMA1/В 1903A>G и FTO T>A у детей и подростков с ожирением
Примечание: Информационная ценность маркеров представлена на вершинах, а информационная ценность взаимодействия для пары локусов – на линии, где сила и направленность взаимодействия выражены в % энтропии.
При анализе двухлокусных взаимоотношений полиморфизмов генов FTO и BDKRB2, а также BDKRB2 и CMA1/В установлены комбинации сочетанных генотипов риска ожирения: FTO TT+ BDKRB2 ins9/ins9, FTO AT+BDKRB2 ins9/ins9, FTO TT+BDKRB2 ins9/del9, FTO AT+BDKRB2 ins9/del9, FTO AA+BDKRB2 ins9/del9, CMA1 AA+BDKRB2 ins9/ins9, CMA1 AA+BDKRB2 ins9/del9, CMA1 AG +BDKRB2 ins9/del9, CMA1 AG+BDKRB2 del9/del9, CMA1 GG+BDKRB2 ins9/del9 (рис. 2).
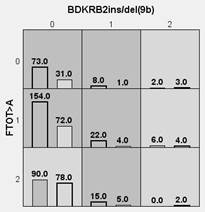
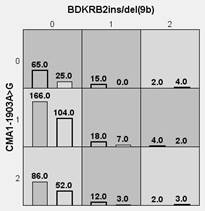
Рис. 2. Двухлокусные взаимоотношения полиморфизмов генов FTO и BDKRB2, а также BDKRB2 и CMA1/В у детей и подростков с ожирением (левые столбики в ячейках) и контрольной группы (правые столбики в ячейках)
Примечание: темно-серые ячейки – генотипы повышенного риска, светло-серые – пониженного риска; 0 – гомозиготы по первому аллелю, 1 – гетерозиготы, 2 – гомозиготы по второму аллелю.
Интересно отметить, что при комбинации полиморфизма гена BDKRB2 с одним из локусов генов FTO либо химазы сочетанные генотипы характеризовались повышенным риском ожирения.
При рассмотрении трехлокусных взаимоотношений полиморфизмов генов FTO, BDKRB2 и CMA1/В количество сочетанных генотипов с повышенным риском ожирения составило шестнадцать, 50% из которых в сочетании и с генотипом FTO TA: CMA1 AA + BDKRB2 ins9/ins9 + FTO TT, CMA1 AG + BDKRB2 ins9/ins9 + FTO TT, CMA1 AA + BDKRB2 ins9/del9 + FTO TT, CMA1 AG + BDKRB2 ins9/del9 + FTO TT, CMA1 GG + BDKRB2 ins9/del9 + FTO TT, CMA1 AG + BDKRB2 del9/del9 + FTO TT, CMA1 AA + BDKRB2 ins9/ins9 + FTO TА, CMA1 AG + BDKRB2 ins9/ins9 + FTO TА, CMA1 GG + BDKRB2 ins9/ins9 + FTO TА, CMA1 AA + BDKRB2 ins9/del9 + FTO TА, CMA1 AG + BDKRB2 ins9/del9 + FTO TА, CMA1 GG + BDKRB2 ins9/del9 + FTO TА, CMA1 AG + BDKRB2 del9/del9 + FTO TА, CMA1 GG + BDKRB2 del9/del9 + FTO TА, CMA1 AA + BDKRB2 ins9/del9 + FTO АА и CMA1 GG + BDKRB2 ins9/del9 + FTO АА (рис. 3).
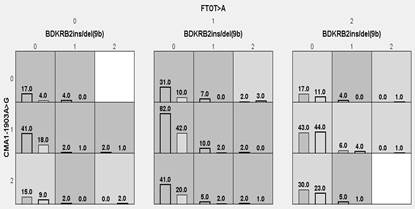
Рис. 3. Трехлокусные взаимоотношения полиморфизмов генов FTO, BDKRB2 и CMA1/В у детей и подростков с ожирением (левые столбики в ячейках) и контрольной группы (правые столбики в ячейках
Примечание: см. рис. 2.
Таким образом, несмотря на то, что генетическая основа патогенеза ожирения сложна и предполагает умеренный вклад в риск заболевания из-за генетических вариаций многих генов, в данном исследовании определены генотипы повышенного риска ожирения на основании анализа межгенных взаимоотношений трех полиморфизмов: rs9939609 гена FTO, гена ins/del(9b) BDKRB2 и гена 1903A>G CMA1/В.
Заключение
Детское ожирение – важная проблема общественного здравоохранения, поскольку оно повышает риск сердечно-сосудистых заболеваний, сахарного диабета и др. В рамках крупных полногеномных ассоциативных исследований (GWAS) в настоящее время выявлено множество генетических локусов, связанных с избыточной массой тела или ожирением у взрослых [12]. При этом генетические локусы, лежащие в основе ожирения у детей, менее изучены. Актуальность исследования данного вопроса определяется тем, что вклад одних и тех же генетических локусов может различаться в зависимости от возраста, в том числе из-за различного взаимодействия генов с окружающей средой или распределения жировой ткани в организме [13]. В ряде работ указывается на идентифицированные локусы, связанные с детским ожирением [14, 15]. У детей описана роль определенных известных локусов для индекса массы тела взрослого человека, например FTO и ADCY3 [16, 17]. Тем не менее, в литературе отсутствуют данные о полном спектре локусов, связанных с ожирением у детей и подростков. Связано это, в первую очередь, со слабой разработанностью данной проблемы. Также в литературе нет указаний на взаимосвязь локусов ожирения и полиморфизмов генов, определяющих развитие сопутствующих ожирению заболеваний.
В данной работе представлены результаты анализа полиморфизмов гена, связанного с ожирением (FTO rs9939609), а также генов рецептора брадикинина (BDKRB2 ins/del(9b)) и химазы (CMA1/В 1903A>G) у детей и подростков Ростовской области (Россия). При изучении распределения вариаций частот аллелей данных генов не было установлено значительных различий между основной (с ожирением) и контрольной группами. Исключение составило распределение аллеля Т, частота которого была выше у детей и подростков с ожирением. Были определены и преобладающие генотипы в основной группе. Также показано, что повышение риска ожирения характерно для носителей полиморфизмов rs1800875 гена CMA1 и rs9939609 гена FTO. Анализ двух- и трехлокусных взаимоотношений показал повышение риска ожирения при включении в его развитие исследованных полиморфизмов генов FTO T>A, BDKRB2 ins/del(9b) и CMA1/В 1903A>G. При том что с использованием метода снижения размерности (MDR) был установлен антагонистический характер между всеми исследованными генами, выявлен ряд комбинаций сочетанных генотипов риска ожирения. В случае двухлокусного взаимоотношения генов FTO и BDKRB2, а также BDKRB2 и CMA1/В выявлены 10 генотипов, а в случае трехлокусного взаимоотношения полиморфизмов всех исследованных генов – 16 генотипов повышенного риска ожирения. Это подтверждает факт, что даже незначительные изменения генов функционально связанных белков могут приводить к формированию нового генотипа.
Дальнейшие исследования ассоциаций данных полиморфизмов в связи с их фенотипами могут определить стратегию фармакологической коррекции кардиометаболических нарушений у детей и подростков с ожирением.
Библиографическая ссылка
Бочарова О.В., Теплякова Е.Д., Абд Али А.Х., Шкурат Т.П., Карантыш Г.В. АССОЦИАЦИЯ ОЖИРЕНИЯ И ПОЛИМОРФИЗМОВ ГЕНОВ РЕЦЕПТОРА БРАДИКИНИНА (BDKRB2 INS/DEL(9B)), ХИМАЗЫ (CMA1/В 1903A>G) И ГЕНА, СВЯЗАННОГО С ОЖИРЕНИЕМ (FTO RS9939609), У ДЕТЕЙ И ПОДРОСТКОВ // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31630 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31630



