Остеомиелит на протяжении длительного времени остается серьезной проблемой здравоохранения. Согласно выводам Международного консенсусного совещания 2018 г. по скелетно-мышечным инфекциям, частота возникновения остеомиелита колеблется от 0,1% до 30% [1, 2] и продолжает неуклонно расти [3]. На сегодняшний день существующие методы лечения широко варьируют и не принимаются повсеместно [4, 5], что требует дальнейшего поиска эффективных терапевтических стратегий для решения данной проблемы.
Необходимым звеном в исследовании остеомиелита является использование животных моделей, позволяющих создать воспроизводимую, контролируемую модель патологии, которой можно манипулировать для создания различных проявлений болезни. Наиболее эффективными моделями для изучения остеомиелита являются крысы [6]. Существуют различные способы моделирования остеомиелита у экспериментальных животных, в том числе основанные на бактериальной инокуляции и использовании дополнительных способов индукции инфекции (таких как склерозирующие агенты, фибриновый клей, герметики, внедрение инородных тел) [7]. Частое использование в качестве бактериального агента Staphylococcus aureus обусловлено его ведущей позицией в видовом спектре возбудителей остеомиелита [4, 8]. Лучшая воспроизводимость моделей остеомиелита отмечена в случае применения погружных металлических костных фиксаторов, при этом, как правило, чаще всего используются накостные пластины, интрамедуллярные стержни или ортопедические винты [9, 10]. Однако использование модели остеомиелита, воспроизводимой в условиях внешней аппаратной чрескостной фиксации, также позволяет получить однотипные клинико-рентгенологические изменения, идентичные патологическому процессу, наблюдаемому у человека.
Цель исследования – изучить особенности клинико-рентгенологической картины при моделировании остеомиелита у крыс в условиях внешнего металлоостеосинтеза.
Материал и методы исследования. Исследование проведено на 13 крысах линии Вистар обоего пола в возрасте 13–16 месяцев с массой тела 320–360г (самки) и 430–520г (самцы). Все экспериментальные исследования и манипуляции были выполнены в соответствии с требованиями «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1986) и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, а также были одобрены Комитетом по этике ФГБУ «НМИЦ ТО им. академика Г.А. Илизарова». Содержание и уход за животными осуществляли в соответствии с ГОСТ 33216-2014.
Животные рандомно были разделены на 2 группы – опытную (n=8) и контрольную (n=5). Оперативное вмешательство выполняли в условиях операционной, под общим наркозом, адаптированным по весу (Рометар 2% – 1–2 мг/кг, Биовета, Чехия; Золетил 100 – 10–15 мг/кг, «Virbac Sante Animale», Франция). Всем крысам через вертикальный разрез кожи и подкожной клетчатки выполняли доступ к передней поверхности бедренной кости и производили трепанацию диафиза кости на границе верхней и средней трети высокоскоростным сверлом диаметром 1,0мм. Затем крысам опытной группы интрамедуллярно вводили 50 мкл суспензии, содержащей 1×108 КОЕ Staphylococcus aureus (MSSA, музейный штамм). Животным контрольной группы инфицирования не проводили. Далее всем крысам в костномозговой канал вводили конец крючкообразно изогнутой спицы диаметром 1,0 мм на глубину 7мм. Операционную рану ушивали послойно наглухо рассасывающимся шовным материалом (Vicryl 4-0, ETHICON).
Следующим этапом на уровне нижней трети бедренной кости осуществляли консольное введение спицы диаметром 0,6мм. Затем обе спицы соединяли между собой методом армирования и заливали самотвердеющей пластмассой «Протакрил-М» (рис. 1).
Во избежание искажения результатов исследования обезболивающие и антимикробные средства животным в послеоперационном периоде не применяли, обработку спиц и операционной раны не проводили. На протяжении всего периода наблюдения крыс содержали в индивидуальных клетках с неограниченным доступом к пище и воде.
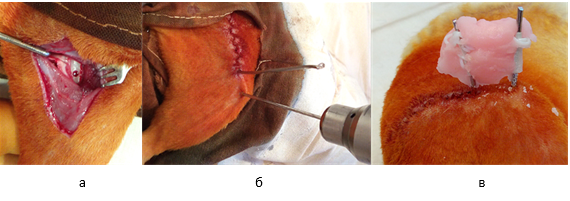
Рис. 1. Этапы оперативного вмешательства: а – трепанационное отверстие в диафизе бедренной кости; б – введение консольной спицы; в – соединение спиц самотвердеющей пластмассой
Клинические наблюдения проводили ежедневно на протяжении всего эксперимента. Во время осмотра отмечали общее состояние животных, особенности поведения и изменение функционального состояния оперированного сегмента, визуально оценивали состояние мягких тканей в области оперативного вмешательства и мест входа спиц.
Рентгенографическое исследование области бедра (аппарат TOSHIBA (Rotanode) Model E7239. N: 10G749 (Япония); 2,0 mA, 42-43 kV, фокусное расстояние 90 см, выдержка автоматическая) проводили сразу после операции для подтверждения позиционирования металлоконструкции, а также на 15-е и 21-е сутки наблюдения. Снимки выполняли в прямой и боковой проекциях.
Эвтаназию осуществляли на 21-е сутки эксперимента методом декапитации наркотизированных животных и производили забор патматериала для дополнительных исследований.
Результаты исследования и их обсуждение
Клиническая картина остеомиелита определяется, главным образом, объемом поражения кости. В представленной работе общее состояние животных обеих группы, состояние слизистых оболочек и кожного покрова на протяжении всего эксперимента оценивалось как хорошее. Состояние кожи в области оперативного вмешательства соответствовало нормальному физиологическому. Заживление операционной раны протекало без особенностей, по первичному натяжению. Опороспособность оперированной конечности была сохранена у всех животных (100%).
У животных контрольной группы отека в области оперированного сегмента и выделения экссудата из спицевых каналов, нарушения функций тазобедренного и коленного сустава не было выявлено.
У крыс опытной группы в 1–3-и сутки после операции наблюдалось снижение потребления корма и воды. Отек в области оперированного сегмента у 5 крыс (62,5%) регистрировался на 1–5-е сутки после оперативного вмешательства, у 1 крысы (12,5%) – в 1–3-и и 14-е сутки, у 1 крысы (12,5%) – на 2-е, 8-е и 20-е сутки; у 1 крысы (12,5%) отек образовывался со 2-х суток и сохранялся до конца периода наблюдения. Признаки болезненности по срокам в основном совпадали с отеком.
Выделение геморрагического экссудата из обоих спицевых каналов отмечали в 1-е сутки после операции у 5 крыс (62,5%). При дальнейшем наблюдении характер экссудата и сроки его выделения из спицевых каналов у животных в пределах группы имели некоторые отличия. У 2 крыс (25%) на 7–9-е сутки регистрировали выделение серозного экссудата; на 9–10-е сутки экссудат становился гнойным. Его выделение из спицевых каналов продолжалось у 1 крысы до момента демонтажа аппарата по причине его нестабильности (13-е сутки), у другой – до окончания эксперимента, несмотря на то, что аппарат был демонтирован на 15-е сутки (рис. 2). Выделение экссудата отмечали из проксимального и дистального каналов попеременно. Кроме того, у одной из этих крыс уже на 7-е сутки зафиксированы атрофия четырехглавой мышцы бедра и кратковременное ограничение функции коленного сустава на 14-е сутки.

Рис. 2. Внешний вид животного на этапе эксперимента. Отделение гнойного экссудата из спицевых каналов, срок эксперимента 15 суток
У 2 крыс (25%) на 5-е сутки произошел самопроизвольный демонтаж металлоконструкции вследствие неосторожного передвижения животных в клетке. С 6–8-х суток у данных животных началось выделение гнойного экссудата из проксимального канала, которое продолжалось до окончания срока наблюдения, причем у одной из крыс на 21-е сутки экссудат характеризовался как гнойно-геморрагический. Нарушения функции суставов оперированной конечности у этих животных зафиксировано не было.
У 1 крысы (12,5%) впервые выделение гнойного экссудата из дистального спицевого канала было отмечено на 15-е сутки. На 16-е сутки зарегистрированы ограничение функции коленного сустава и нестабильность аппарата, произведен его демонтаж. К 20-м суткам экссудат приобрел серозный характер.
У 3 крыс постоянные гнойные выделения либо из проксимального, либо из дистального канала регистрировали с 9–10-х до 17–20-х суток. У одной из крыс с 3-х по 13-е сутки после операции в паховой области определялось плотное ограниченное образование округлой формы, с 14-х по 21-е сутки отмечались его размягчение и флюктуация. На основании клинической картины был диагностирован абсцесс, локализованный на медиальной поверхности бедра. Нестабильность аппарата определена на 15-е сутки, произведен его демонтаж. Амплитуда движений в тазобедренном суставе сохранялась в полном объеме на протяжении всего эксперимента; функция коленного сустава была резко ограничена с 3-х по 17-е сутки. Еще у одной крысы нарушение функции коленного сустава выявлено на 8–10-е и 16-е сутки, на 14-е сутки отмечался кратковременный отек тканей в области сустава.
Таким образом, у животных обеих групп не было выявлено выраженных признаков интоксикации. В опытной группе отек в области оперированного сегмента в разные сроки наблюдения был зарегистрирован у 100% животных. Демонтаж аппарата по причине его нестабильности был произведен у 4 крыс (50%) на 13–16-е сутки после операции, у 2 крыс (25%) произошел самопроизвольный демонтаж конструкции вследствие механического воздействия на ранних сроках эксперимента, у 2 крыс (25%) нестабильности металлоконструкции не выявлено. Гнойные выделения из спицевых каналов наблюдались у 100% животных, преимущественно с 8–10-х до 17–21-х суток. Нарушение функции коленного сустава определено у 4 крыс (50%), патологии функции тазобедренного сустава не было выявлено ни у одного животного (0%).
В целом данные, полученные при клиническом наблюдении за экспериментальными животными, согласуются с результатами других исследований и зависят от способа моделирования остеомиелита, количества инокулированного инфекционного материала и использованной животной модели [11-13].
Рентгенографическое исследование. Одним из основных методов диагностики остеомиелита является рентгенография [14]. В проведенном исследовании рентгенологические критерии диагностики и оценки тяжести патологического процесса основывались на ранее описанных критериях остеомиелита. На рентгенограммах пораженного сегмента оценивали характер, выраженность и распространенность структурных изменений кости [13, 14].
У всех животных контрольной группы на 15-е и 21-е сутки эксперимента наблюдали схожую рентгенологическую картину. Контуры бедренной кости оставались ровными, четко очерченными. Корковая пластика имела равномерную толщину и рентгенологическую плотность. Рентгенологическая тень интермедуллярного канала была равномерная, очаги просветления отсутствовали. Места введения спиц имели четкий контур без зон просветления (рис. 3а, 3б).
В опытной группе на 15-е сутки после операции в большинстве случаев (67%) корковая пластинка кости сохраняла четкий наружный контур и имела равномерную рентгенологическую плотность. У 2 животных (33%) в прямой проекции выявляли истончение и неравномерность структуры корковой пластинки на протяжении диафиза кости. Зоны просветления вокруг спицевых фиксаторов отсутствовали. У 1 крысы отмечали наличие гладкой периостальной тени на краниальной поверхности кости. В проекции интермедуллярного канала в 100% случаев как в прямой, так и в боковой проекции отмечали слабозаметные хаотичные округлые участки просветления (рис. 3в, 3г).
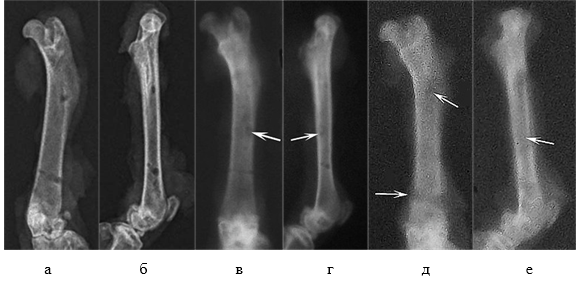
Рис. 3. Рентгенограммы области бедра крысы в прямой (а, в, д) и боковой (б, г, е) проекциях: а, б – контрольная группа, срок эксперимента 21 сутки; в, г – опытная группа, срок эксперимента 15 суток; г, д – опытная группа, срок эксперимента 21 сутки
На 21-е сутки эксперимента у 50% животных на рентгенограммах в боковой проекции отмечали истончение и размытие контура корковой пластинки в области диафиза. Также в большинстве случаев (83,3%) отмечали рентгенологические признаки обширной резорбции костной ткани в области дистального спицевого канала (рис. 3д) и участок просветления в месте расположения интрамедуллярной спицы (рис. 3е).
У 33,3% крыс на краниальной и латеральной поверхности кости определялись гладкие периостальные наслоения средней рентгенологической плотности. У всех животных отмечали наличие рыхлых эндостальных теней разной степени выраженности, распространяющихся по всей длине диафиза. Костномозговой канал на всем протяжении имел неравномерную структуру низкой рентгенологической плотности (рис. 2г).
Таким образом, результаты рентгенологического исследования показали, что у животных опытной группы уже к 15-м суткам после операции развивались признаки воспаления, ограниченного интермедуллярным пространством, проявляющиеся наличием слабозаметных хаотичных округлых участков просветления.
К 21-м суткам эксперимента происходило распространение воспалительного процесса на все структурные элементы кости, что характеризовалось наличием мелкоочаговых полостей в костномозговом канале, а также признаков процессов деструкции корковой пластинки и резорбции губчатой кости дистального метафиза.
В контрольной группе животных рентгенологических признаков остеомиелита выявлено не было.
Результаты рентгенографического исследования, описанные в данной работе, не противоречат данным других экспериментов по моделированию остеомиелита, вызванного S.aureus [13], и аналогичны радиологическим признакам остеомиелита у человека [14].
Выводы
Интрамедуллярная инокуляция 1×108 КОЕ Staphylococcus aureus, являющегося основным патогеном остеомиелита, приводит к развитию инфекционного процесса у крыс, который по клинической и рентгенологической картине соответствует местным патологическим изменениям у пациентов с костной инфекцией. Представленная модель может быть использована для исследования возможных методов терапевтического воздействия.
Работа выполнена в соответствии с планом научных исследований в рамках программы НИР государственного задания 2021–2023 гг. ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России.
Библиографическая ссылка
Кубрак Н.В., Дюрягина О.В., Овчинников Е.Н., Дьячков А.Н. КЛИНИКО-РЕНТГЕНОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ОСТЕОМИЕЛИТА В УСЛОВИЯХ ВНЕШНЕГО МЕТАЛЛООСТЕОСИНТЕЗА (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ) // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31621 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31621



